Ранние прогностические критерии развития плацентарной недостаточности у беременных с железодефицитной анемией
Цель исследования — выявить ранние прогностические критерии развития плацентарной недостаточности у беременных с железодефицитной анемией (ЖДА).
Материалы и методы. Обследовано 143 беременных: 107 пациенток с ЖДА (основная группа) и 36 женщин с физиологическим течением беременности (контрольная группа). Основная группа в свою очередь была разделена на две подгруппы: 1-я (n=28) — беременные с ЖДА, выявленной до 12 нед гестации, 2-я (n=79) — беременные с ЖДА, диагностированной в сроке 20–24 нед. При первичном обнаружении лабораторных признаков ЖДА у всех пациенток основной группы определяли степень окислительной модификации белков сыворотки крови по уровню карбонильных производных на основании реакции взаимодействия окисленных аминокислотных остатков белков с 2,4-динитрофенилгидразином с образованием альдегид- и кетондинитрофенилгидразонов (АДНФГ, КДНФГ). В такие же сроки уровень данных белков исследован в сыворотке крови беременных контрольной группы.
Результаты. Установлено, что изменение уровней АДНФГ и КДНФГ при спонтанном окислении является ранним прогностическим критерием формирования плацентарных нарушений у беременных с ЖДА, выявленной в I и II триместрах беременности. Разработана математическая модель развития плацентарной недостаточности у беременных с ЖДА, позволяющая сформировать группы риска.
Железодефицитная анемия (ЖДА) является наиболее распространенной экстрагенитальной патологией при беременности [1, 2]. По данным ВОЗ (2011 г.), 38% беременных (32,4 млн. человек) в возрасте 15–49 лет страдают ЖДА. Частота данной патологии среди беременных в России составляет 32% [3]. ЖДА при беременности возникает в результате недостаточного удовлетворения повышенной потребности организма матери и плода в железе, необходимом для кроветворения [4].
У 12% женщин ЖДА развивается до наступления беременности [5], в 22–28% случаев диагностируется в І триместре беременности, во ІІ триместре частота ЖДА возрастает до 42% [6, 7]. Железодефицитное состояние во время беременности вызывает ряд осложнений: невынашивание беременности, преэклампсию, преждевременную отслойку нормально расположенной плаценты, первичную и вторичную плацентарную недостаточность [3, 8, 9]. Во время родов ЖДА приводит к аномалиям родовой деятельности, кровотечениям, акушерскому травматизму со стороны матери и плода, что ухудшает перинатальные исходы. В связи с этим при распространении анемии более 40% эксперты ВОЗ определяют проблему уже не как сугубо медицинскую, а затрагивающую государственные интересы.
До 60% перинатальной патологии формируется в антенатальном периоде, основной причиной ее является плацентарная недостаточность [10, 11]. При ЖДА плацентарная недостаточность развивается в 18–24% случаев [9]. В ряде исследований сочетание ЖДА и плацентарной недостаточности отмечено в 40,6% наблюдений [12].
Большая распространенность ЖДА среди беременных, частота проявления признаков железодефицита на ранних сроках гестации и высокий процент развития плацентарной недостаточности на фоне данной экстрагенитальной патологии обусловливают поиск ранних прогностических критериев формирования плацентарных нарушений у беременных с ЖДА.
Цель исследования — выявить ранние прогностические критерии развития плацентарной недостаточности у беременных с железодефицитной анемией.
Материалы и методы. Работа выполнялась в 2010–2015 гг. на базе женской консультации Городской клинической больницы №40 Н. Новгорода с функцией областного перинатального центра совместно с кафедрой биологии НижГМА.
Проведено обследование 107 беременных с ЖДА (основная группа) и 36 женщин без ЖДА с физиологическим течением беременности (контрольная группа). Основная группа в свою очередь была разделена на две подгруппы: 1-я (n=28) — беременные с ЖДА, выявленной до 12 нед гестации; 2-я (n=79) — беременные с ЖДА, диагностированной в сроке 20–24 нед.
Исследование проведено в соответствии с Хельсинкской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено Этическим комитетом НижГМА. От каждой пациентки получено информированное согласие.
Алгоритм обследования женщин соответствовал положениям приказа Министерства здравоохранения Российской Федерации от 12 ноября 2012 г. №572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)».
Все беременные с ЖДА имели легкую степень заболевания и получали антианемическую терапию (Сорбифер, содержащий двухвалентное железо, перорально в суточной дозировке 200–300 мг непрерывным курсом натощак за 1 ч до еды; при достижении нормального уровня гемоглобина по результатам общего анализа крови терапия тем же лекарственным средством продолжалась длительно в дозировке 100 мг на ночь через день с целью насыщения депо железа в организме беременной).
Критерии постановки диагноза ЖДА легкой степени:
снижение уровня гемоглобина в общем анализе крови: в I триместре беременности — менее 110 г/л; во II триместре — менее 105 г/л; эритроциты — менее 3,9·1012/л; гематокрит — менее 37%; средний объем эритроцитов — менее 80; средняя концентрация гемоглобина в эритроците — менее 300;
уровень сывороточного ферритина — ниже 30 мг/дл.
Критерии исключения из групп:
ЖДА средней и тяжелой степени;
злокачественные новообразования;
бактериальные и вирусные инфекции;
воспалительные заболевания в острой фазе;
наследственная патология у матери и плода;
аномалии развития половой системы у матери;
привычные интоксикации (курение, алкоголь, наркотики);
многоплодие;
преэклампсия;
аномалии расположения и прикрепления плаценты.
В ходе исследования оценивали интенсивность процессов свободнорадикального окисления белков плазмы крови по уровню карбонильных производных для выявления маркеров плацентарной недостаточности. Исследовали реакции взаимодействия окисленных аминокислотных остатков белков с 2,4-динитрофенилгидразином с образованием альдегид- и кетон-динитрофенилгидразонов — АДНФГ, КДНФГ (Levine R.L., 1990; Дубинина Е.Е. и др., 1995). Уровни полученных соединений регистрировали на спектрофотометре Genesis-10UV (Thermo Scientific, США) при длинах волн 270 и 363 нм, выражали в единицах оптической плотности, отнесенных к 1 г белка, применяя коэффициент молярной экстинкции 22·103 М–1см–1. Для определения концентрации общего белка использовали набор реагентов фирмы Vital Diagnostic (Россия).
Ретроспективно была изучена частота формирования плацентарной недостаточности в основной группе беременных на основании данных ультразвуковой фетометрии, плацентометрии и доплерографии сосудов маточно-плацентарно-плодового комплекса (ультразвуковой аппарат MEDISON MYSONO U6-RUS; Samsung Medison, Южная Корея), морфологического исследования плацент по общепринятой методике, описанной Миловановым А.П. (1999), и установлена связь с уровнями АДНФГ и КДНФГ в сыворотке крови женщин данной группы.
С помощью логистического регрессионного анализа (Nilsdotter A.-K. et al., 2003; Gossec L. et al., 2005; Жилина Е.В., 2010) была получена математическая модель развития плацентарной недостаточности у беременных с ЖДА.
Обработку результатов исследования проводили с использованием лицензионной программы Statistica 8.0.
Результаты и обсуждение. Все беременные проживали на территории одного района Н. Новгорода; в основной и контрольной группах, а также подгруппах основной группы достоверно не различались по возрасту и социальному статусу (p>0,05).
В анамнезе у беременных 1-й подгруппы (12; 42,9%) достоверно чаще отмечали тяжелые менструальные кровотечения по сравнению с группой контроля (р<0,05), что объясняет предсуществующий характер ЖДА у этих женщин. Частота хронического гастродуоденита у них (10; 35,7%) статистически значимо превышала частоту этой патологии в группе контроля (1; 5,6%), что соотносится с данными литературы о роли патологии желудочно-кишечного тракта в генезе ЖДА (р<0,05) [13, 14]. 2-я подгруппа по количеству беременных с указанной выше патологией достоверно не отличалась от контрольной группы (р>0,05).
При совместном с кафедрой биологии Нижегородской государственной медицинской академии исследовании интенсивности процессов свободнорадикального окисления белков плазмы крови по уровню карбонильных производных были определены два наиболее значимых фактора, влияющих на возможность развития плацентарной недостаточности у беременных с ЖДА — продукты окислительной деструкции белка при спонтанном окислении: АДНФГсп и КДНФГсп [15].
На основе полученных данных была разработана математическая модель расчета риска (РПН) возникновения плацентарной недостаточности у женщин с ЖДА:
PПН=exp[(–4,156+(0,432)·АДНФГсп+(–0,038)·КДНФГсп)]/1+exp[(–4,156+(0,432)·АДНФГсп+(–0,038)·КДНФГсп)].
Установлено, что при PПН≥0,54 вероятно развитие плацентарной недостаточности.
Переменные, используемые в уравнении логистической регрессии, имели следующую характеристику (табл. 1).
 Таблица 1. Характеристика переменных в уравнении логистической регрессии Таблица 1. Характеристика переменных в уравнении логистической регрессии
|
Была выполнена оценка шансов осложнения плацентарной недостаточностью гестационного процесса у беременных с ЖДА (табл. 2). При возрастании на единицу значения i-й переменной шанс развития плацентарной недостаточности увеличивается в число раз, равное ОШ.
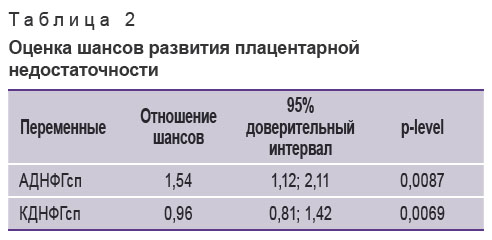 Таблица 2. Оценка шансов развития плацентарной недостаточности Таблица 2. Оценка шансов развития плацентарной недостаточности
|
При этом интервал значений для каждой из переменных включает истинное значение с вероятностью 95%, а статистическая значимость параметров выражена в значении p-level [15].
Полученная регрессионная модель была проверена построением ROC-кривой. Значение показателя AUC оказалось равным 0,96, что свидетельствует о высоком качестве полученного результата [15].
Установлено, что диагностическая чувствительность полученного теста — 93%, диагностическая специфичность — 80%, диагностическая эффективность — 87%.
Среднее значение РПН, согласно разработанной нами математической модели, в контрольной группе составило 0,052±0,052, что статистически значимо отличалось от показателей в 1-й (РПН=0,821±0,096) и 2-й подгруппах основной группы (РПН=0,688±0,155) (р<0,05).
Таким образом, разработанная математическая модель по значениям РПН у беременных с ЖДА с высокой диагностической чувствительностью и эффективностью позволяет сформировать группы риска по плацентарной недостаточности.
Заключение. Изменение уровней альдегид- и кетондинитрофенилгидразонов пи спонтанном окислении (АДНФГсп и КДНФсп) является ранним прогностическим критерием формирования плацентарных нарушений у беременных с железодефицитной анемией, выявленной как в I, так и во II триместрах беременности.
Финансирование исследования и конфликт интересов. Исследование не финансировалось какими-либо источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- Khalafallah A.A., Dennis A.E. Iron deficiency anaemia in pregnancy and postpartum: pathophysiology and effect of oral versus intravenous iron therapy. J Pregnancy 2012; 2012: 630519, https://doi.org/10.1155/2012/630519.
- Di Renzo G.C., Spano F., Giardina I., Brillo E., Clerici G., Roura L.C. Iron deficiency anemia in pregnancy. Women’s Health 2015; 11(6): 891–900, https://doi.org/10.2217/whe.15.35.
- Короткова Н.А., Прилепская В.Н. Анемия беременных. Современная профилактика и терапия. Эффективная фармакотерапия 2016; 1: 34–41.
- Breymann C. Iron deficiency anemia in pregnancy. Semin Hematol 2015; 52(4): 339–347, https://doi.org/10.1053/j.seminhematol.2015.07.003.
- Радзинский В.Е., Ордиянц И.М. Альтернативные подходы к анемии беременных. Акушерство и гинекология 2007; 3: 65–67.
- Анчева И.А. Комплексная прегравидарная подготовка женщин с дефицитом железа. Практическая медицина 2015; 1(86): 41–43.
- Кулаков В.И., Серов В.Н., Соколова М.Ю. Неионные препараты железа в лечении железодефицитной анемии у беременных. Российский вестник акушера-гинеколога 2007; 7(5): 48–52.
- Yasmeen S., Aktar N., Azim E., Siddique S., Shah S.M., Chaklader M.A., Khatun S., Debnath R.C., Rahman M.M., Bari M.N. Iron polymaltose complex in the treatment of iron deficiency anemia in pregnancy. Mymensingh Med J 2016; 25(3): 506–513.
- Айламазян Э.К., Самарина А.В., Тарасова М.А. Рекомбинантный эритропоэтин в лечении анемии беременных и родильниц. Акушерство и гинекология 2003; 2: 68–70.
- Жилякова О.В., Захарова И.В., Нелидова Н.Э., Белугина О.С., Торопкина Е.Л., Белова Н.Г. Влияние анемии на маточно-плацентарный комплекс. Сибирский медицинский журнал (Томск) 2010; 4–2: 96–98.
- Лазарева Г.А., Хурасева А.Б., Клычева О.И. Современный взгляд на проблему фетоплацентарной недостаточности. Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация 2014; 18(27): 5–10.
- Серов В.Н., Тютюнник В.Л., Михайлова О.И. Современные представления о лечении плацентарной недостаточности. Российский медицинский журнал 2010; 4: 157.
- Cantor A.G., Bougatsos C., Dana T., Blazina I., McDonagh M. Routine iron supplementation and screening for iron deficiency anemia in pregnancy: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2015; 162(8): 566, https://doi.org/10.7326/m14-2932.
- Siu A.L. Screening for iron deficiency anemia and iron supplementation in pregnant women to improve maternal health and birth outcomes: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 2015; 163(7): 529, https://doi.org/10.7326/m15-1707.
- Макушева М.А. Свободнорадикальный статус материнского организма на фоне абдоминальной декомпрессии при физиологическом течении. Дис. … канд. биол. наук. Н. Новгород; 2013.










