Костнозамещающие имплантаты из материала «Рекост-М» на основе 3D-моделирования для закрытия посттрепанационных дефектов черепа: доклинические и клинические исследования
Цель исследования — оценить возможность применения инновационного имплантата из уретанового костнозамещающего материала «Рекост-М» для персонифицированной реконструкции посттрепанационных дефектов черепа на основе 3D-технологий.
Материалы и методы. Для исследования свойств костнозамещающего материала «Рекост-М» проводили физико-механические и токсикологические испытания, а также доклинические испытания на культурах фибробластов и кроликах. Клинические данные разработанного имплантата изучали в рамках мультицентрового исследования.
Результаты. Замещение посттрепанационных дефектов черепа имплантатами из костнозамещающего материала «Рекост-М» зарекомендовало себя как надежный метод краниопластики. Использование 3D-технологии позволяет моделировать индивидуальные имплантаты любой сложности.
Введение
В настоящее время на мировом рынке имплантационных материалов для закрытия костных дефектов используются следующие:
синтетические (протакрил, палакос) [1];
аутоматериалы (аутокость) [2, 3];
керамические имплантаты (корундовая керамика);
металлы (титан и сплавы) [4, 5];
гидроксиапатит.
Одним из факторов, существенно влияющих на выбор материала, является биосовместимость. Имеются указания на то, что полиметилметакрилат и другие полимеры метакриловой кислоты не обладают достаточной биосовместимостью, часто токсичны для окружающих тканей и приводят к недопустимо большому количеству осложнений. Процесс полимеризации протакрила составляет более 1,5 ч, в течение которых наблюдаются достаточно сильный разогрев и выброс токсичных газов.
Корундовая керамика в 5% случаев дает трофические нарушения мягких тканей и требует удаления.
Некоторые авторы [3] считают, что для коррекции костных дефектов наиболее целесообразно применение аутопластических материалов, в частности аутокости. При отсутствии собственной кости предпочтительным материалом является аллокость, которая стимулирует процессы костеобразования со стороны тканей реципиента и служит источником новообразования костного регенерата.
Однако аутопластические материалы тоже не безобидны, так как могут вызывать осложнения воспалительного характера или подвергаться рассасыванию.
Сообщения, касающиеся применения титана и его сплавов, указывают на его достаточную биосовместимость и минимальное количество осложнений [4, 5].
Однако биосовместимость — не единственная проблема, с которой сталкивается хирург при закрытии костного дефекта. Существует проблема восстановления естественного рельефа дефекта, особенно если он занимает сложные по конфигурации анатомические зоны. Смоделировать из титановой сетки сложную конфигурацию дефекта довольно проблематично.
Гидроксиапатитный цемент применяется для закрытия дефектов черепа, но размер дефекта не должен превышать 30 см2. При больших дефектах для улучшения физико-механических параметров гидроксиапатит необходимо армировать титановой сеткой. Также следует отметить его высокую (в десятки раз) стоимость по сравнению с другими материалами.
Все сказанное объясняет, почему проблема создания материала для закрытия костных дефектов, не имеющего перечисленных недостатков, остается крайне актуальной [6, 7].
«Айкон Лаб ГмбХ» (Россия) с 2011 г. ведет разработку материалов для закрытия костных дефектов при реконструктивно-пластических операциях, для изготовления костных имплантатов, замещения дефектов при различных костных патологиях. В 2014 г. синтезирован новый костнозамещающий материал «Рекост» и его отвержденный вариант «Рекост-М», содержащий остеокондуктивный и биосовместимый полимер [8]. В качестве такого полимера выступает полимер полиуретанового ряда, полученный из полиоксипропиленгликоля со средней молекулярной массой 1000, 4,4’-диизоцианатодифенилметана и глицерина (в Федеральной службе по надзору в сфере здравоохранения 03 июля 2014 г. получено регистрационное удостоверение на медицинское изделие №РЗН 2014/1646 «Материал полимерный костнозамещающий для реконструктивно-восстановительной хирургии серий «Рекост» и «Рекост-М»).
Физико-механические испытания материала проводились на оборудовании Zwick/Roell Z100 (Германия).
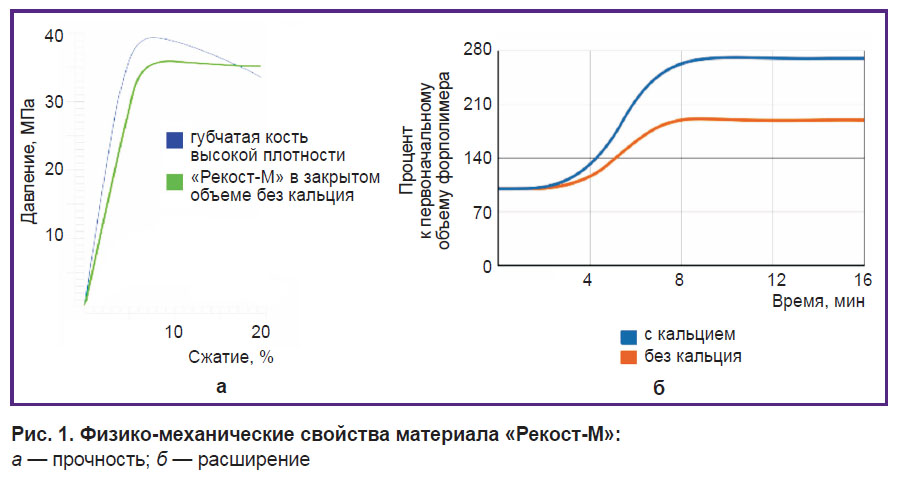
Полученный материал имеет размер пор 50–400 мкм. Прочность на сжатие составляет 25–35 МПа, адгезия к металлу и кости — 60–65 кг/см2. Установлено, что физико-механические свойства материала «Рекост-М» (прочность и расширение) близки к нативной костной структуре и могут быть адаптированы для конкретной клинической задачи (рис. 1).
|
Рис. 1. Физико-механические свойства материала «Рекост-М»: а — прочность; б — расширение |
До момента полного затвердевания данный костнозамещающий материал обладает пластичностью и позволяет выполнять моделирование и склеивание. Он может быть сформован в виде пластин, цилиндров и другой формы индивидуальных имплантатов на основе 3D-технологии.
Доклинические и клинические испытания
Доклинические испытания костнозамещающего материала «Рекост-М» по ИСО ГОСТ 10993 проводились в Нижегородском научно-исследовательском институте травматологии и ортопедии (Россия). Выполнены две серии экспериментов по изучению воздействия образцов материала на процессы адгезии, процессы пролиферации и синтез фибронектина дермальными фибробластами человека в системе in vitro. Для этого в стерильном боксе в чашке Петри готовили костнозамещающий материал следующим способом: к 10 мл форполимера добавляли 0,7 мл полиола с растворенным в нем катализатором. Затем по достижении полного затвердевания костнозамещающего материала в специальные ячейки площадью 1 см2 помещали маленькие пробы материала размером 0,1 см2 и наносили на них культуру фибробластов человека с разным промежутком времени. Контролем служила чистая культура фибробластов.
На первом этапе эксперименты проведены на трех штаммах дермальных фибробластов человека с двумя сериями костнозамещающего материала.
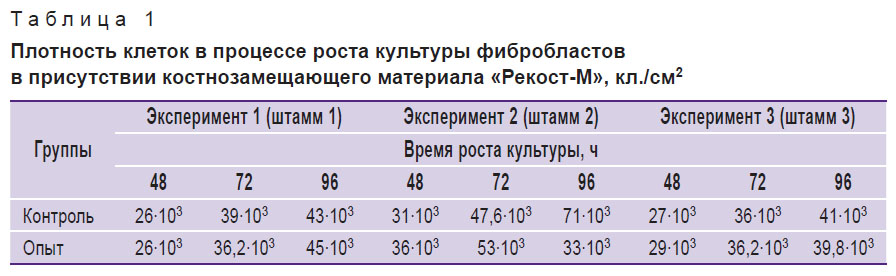
В табл. 1 представлено изменение плотности клеток на единицу площади культурального сосуда в процессе роста культуры в присутствии костнозамещающего материала. Исходная посевная концентрация — 20·103 кл./мл.
|
Таблица 1. Плотность клеток в процессе роста культуры фибробластов в присутствии костнозамещающего материала «Рекост-М», кл./см2 |
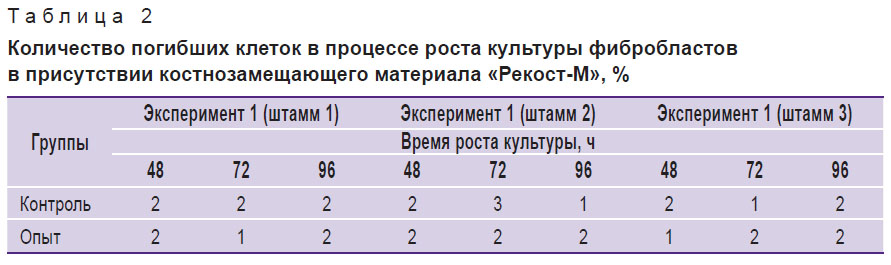
В табл. 2 представлено изменение процента погибших клеток в процессе роста культуры в присутствии костнозамещающего материала. Исходная посевная концентрация — 20·103 кл./мл. Жизнеспособность клеток определялась с помощью окраски витальным красителем трипановым синим.
|
Таблица 2. Количество погибших клеток в процессе роста культуры фибробластов в присутствии костнозамещающего материала «Рекост-М», % |
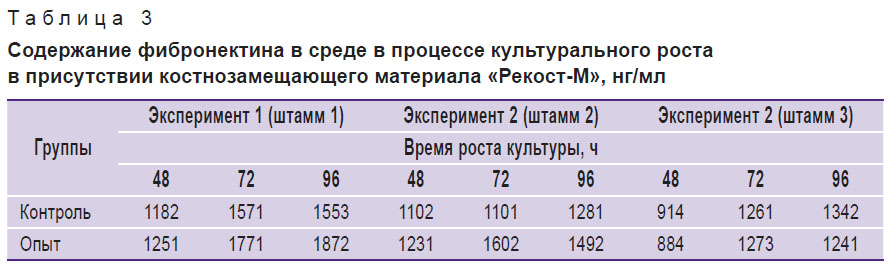
В табл. 3 представлено изменение содержания фибронектина (нг/мл) в культуральной среде в процессе роста культуры в присутствии костнозамещающего материала. Исходная посевная концентрация — 20·103 кл./мл.
|
Таблица 3. Содержание фибронектина в среде в процессе культурального роста в присутствии костнозамещающего материала «Рекост-М», нг/мл |
Результаты обеих серий экспериментов показали, что испытуемые образцы костнозамещающего материала не нарушают процессов адгезии, не влияют на процессы пролиферации и не изменяют синтез фибронектина клетками соединительной ткани в культуре.
Таким образом, эксперименты на культуре фибробластов человека свидетельствуют, что материал «Рекост-М» является биосовместимым, у него отсутствует цитотоксичность in vitro.
На втором этапе проведены испытания на 12 животных (кролики, чистая линия). Выполнена имплантация исследуемого материала в бедренную кость по три имплантата каждому размерами 3×5 мм. Состояние кроликов нормализовалось через 12–24 ч. Температура — нормальная, животные — активны. Местных воспалительных реакций не отмечается.
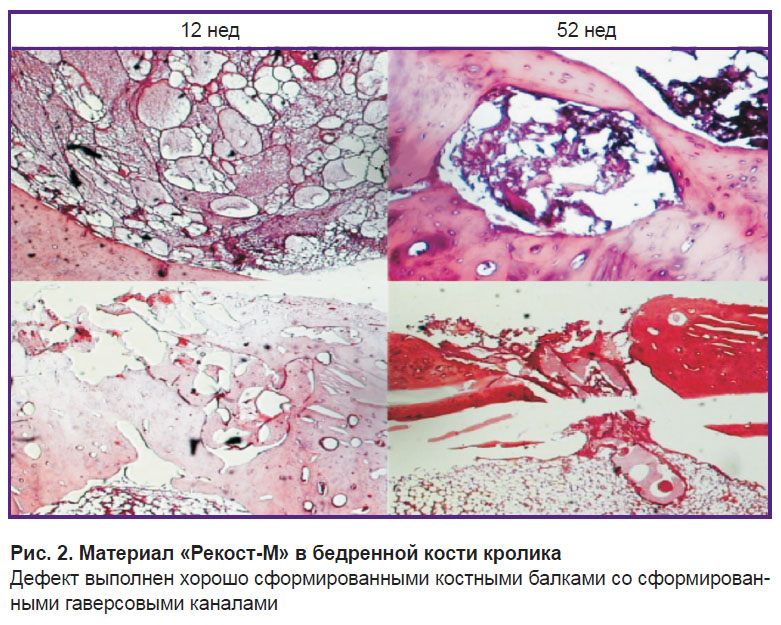
Через 12 нед после имплантации из эксперимента было выведено 7 животных. На представленных микрофотографиях гистологических препаратов (рис. 2) отчетливо видно:
имплантированный материал не подвергся инкапсуляции и отторжению — нет образования фиброзной капсулы;
по границе контакта «кость–материал» появились новые остеобласты.
|
Рис. 2. Материал «Рекост-М» в бедренной кости кролика Дефект выполнен хорошо сформированными костными балками со сформированными гаверсовыми каналами |
Таким образом, испытания на животных показали, что у всех использованных образцов костнозамещающего материала отсутствуют патологические реакции при оссальной (внутрикостной) имплантации — это также подтверждает биосовместимость и доказывает остеокондуктивность материала.
Совместно с ООО «ГИТО-Инновация» (Н. Новгород) [9–11] из материала «Рекост-М» начата разработка 3D-имплантатов для замещения костных дефектов черепа, длинных трубчатых костей. Для визуализации дефекта (типа и размеров, расположения и особенностей) каждому пациенту выполняется предварительная КТ в режиме костной реконструкции. Полученные данные нейровизуализации передаются изготовителю индивидуального имплантата.
Процесс изготовления 3D-имплантата происходит в несколько стадий. Сначала создается виртуальный макет имплантата путем обработки результатов КТ костей черепа с дополнительным 3D-моделированием для оптимизации финишного размещения имплантата и последующего непосредственного изготовления макета на 3D-принтере. Далее на основе полученного на 3D-принтере макета изготавливается форма для производства имплантата. После этого проводится подготовка и заливка материала (в данном случае — полимерного костнозамещающего материала для реконструктивно-восстановительной хирургии «Рекост-М») в полученную форму с последующим его отверждением за счет протекания химических реакций уретанообразования. По истечении 24 ч проводится извлечение полученного имплантата из формы. Выполняются финишная обработка имплантата в соответствии с начальными требованиями заказчика (учитываются требования к поверхности, наличию отверстий и так далее), этиленоксидная стерилизация и упаковка.
Клинические исследования костнозамещающего материала «Рекост-М» и имплантатов из него, выполненных по 3D-технологии, были проведены в Республиканской больнице им. В.А. Баранова (Петрозаводск, Республика Карелия), Больнице скорой медицинской помощи (Набережные Челны), на кафедре нервных болезней и нейрохирургии Ростовского государственного медицинского университета.
В отделении нейрохирургии Республиканской больницы им. В.А. Баранова в период с января 2016 г. по июнь 2017 г. выполняли краниопластику с использованием индивидуального биоимплантата «Рекост-М». Всего прооперировано 9 человек, из них 6 больных с диагнозом «посттравматический послеоперационный дефект черепа», 2 больных — с опухолевым поражением костей черепа (лейкомиосаркома и остеома костей черепа) и 1 больной — с состоянием после декомпрессивной гемикраниотомии. Размеры дефекта: у 7 больных — обширный, у 2 — большой. Локализация дефекта: у 6 больных — лобно-теменно-височная область, у 1 больного — лобно-орбитальная, у 1 — теменная, у 1 — лобная. У 1 пациента с дефектом в лобно-теменно-височной области отмечено энцефалоцеле. Каждому больному выполнялась предварительная компьютерная томография с толщиной среза 1,25 мм в режиме костной реконструкции для расчета размеров дефекта черепа.
Все пациенты с посттравматическими дефектами были оперированы в промежуточный период, двоим пациентам с опухолями свода черепа выполнена первичная краниопластика. Фиксацию имплантата осуществляли металлическими краниофиксами. Всем пациентам был установлен дренаж с активной вакуум-аспирацией, который удалялся на 2-е сутки.
Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Республиканской больницы им. В.А. Баранова. От каждого пациента получено информированное согласие.
Приводим клинические примеры использования 3D-имплантатов из материала «Рекост-М».
Пациентка Ф., 39 лет, Петрозаводск.
Диагноз: «послеоперационный дефект свода черепа».
Анамнез: страдает аневризматической болезнью головного мозга. Оперирована 14.08.2014 г. по поводу разорвавшейся аневризмы слева, 18.08.2014 г. выполнялась обширная декомпрессивная краниотомия в связи с отеком мозга. После операции возникла сообщающаяся гидроцефалия, по поводу чего 30.09.2014 г. выполнено люмбо-перитонеальное шунтирование. После операции сохранялся выраженный неврологический дефицит: правосторонний глубокий гемипарез — до плегии в руке, афазия, нарушение зрения. 24.04.2015 г. в нейрохирургическом отделении пациентке выполнено вентрикуло-перитонеальное шунтирование в правой точке Кохера. 27.04.2015 г. — ревизия шунта.
Спустя год после операции по поводу разрыва аневризмы — плановая госпитализация для краниопластики. Пациентка оперирована в отделении нейрохирургии; выполнены менинголиз, энцефалолиз, опорожнение кист головного мозга. Проведена пластика дефекта черепа индивидуально изготовленным протезом из материала «Рекост-М» (рис. 3).
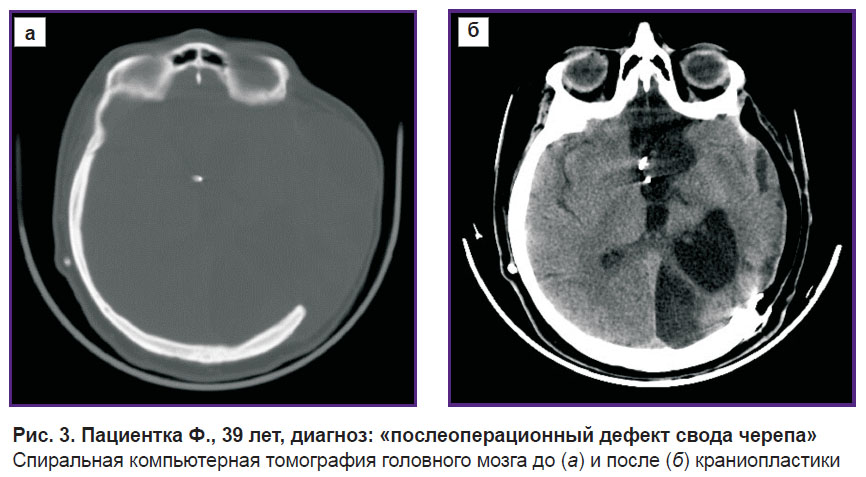 |
Рис. 3. Пациентка Ф., 39 лет, диагноз: «послеоперационный дефект свода черепа» Спиральная компьютерная томография головного мозга до (а) и после (б) краниопластики |
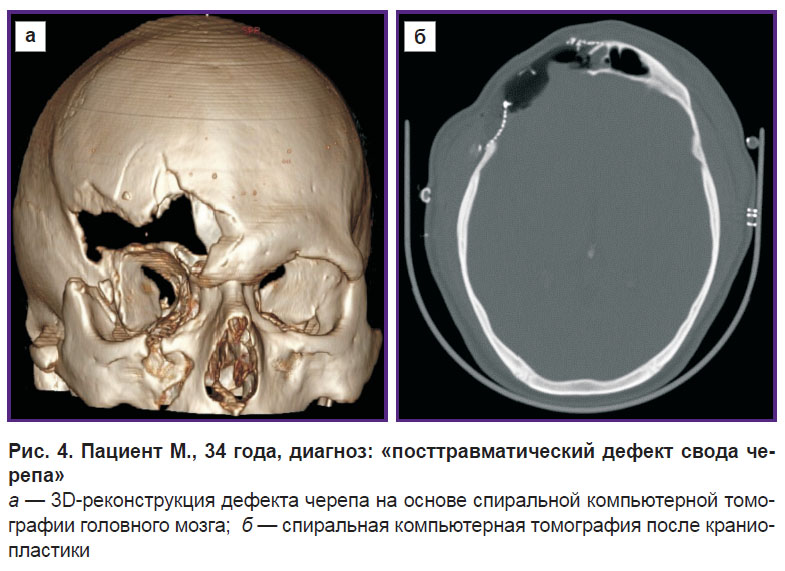
Пациент М., 34 года, Петрозаводск.
Диагноз: «посттравматический дефект свода черепа».
Анамнез: травма 18.03.2016 г. в результате ДТП — прямой удар о недвижущийся предмет. Была потеря сознания. Находился на лечении в районной больнице с диагнозом: «острая черепно-мозговая травма, ушиб головного мозга; открытый экспрессионный перелом лобной кости». Выполнено оперативное лечение по срочным показаниям: удаление отломков, первичная хирургическая обработка. Послеоперационный период — без особенностей.
Повторная госпитализация для пластики дефекта черепа проведена 22.06.2016 г. Выполнена краниопластика дефекта черепа индивидуальной краниопластиной «Рекост-М» (рис. 4).
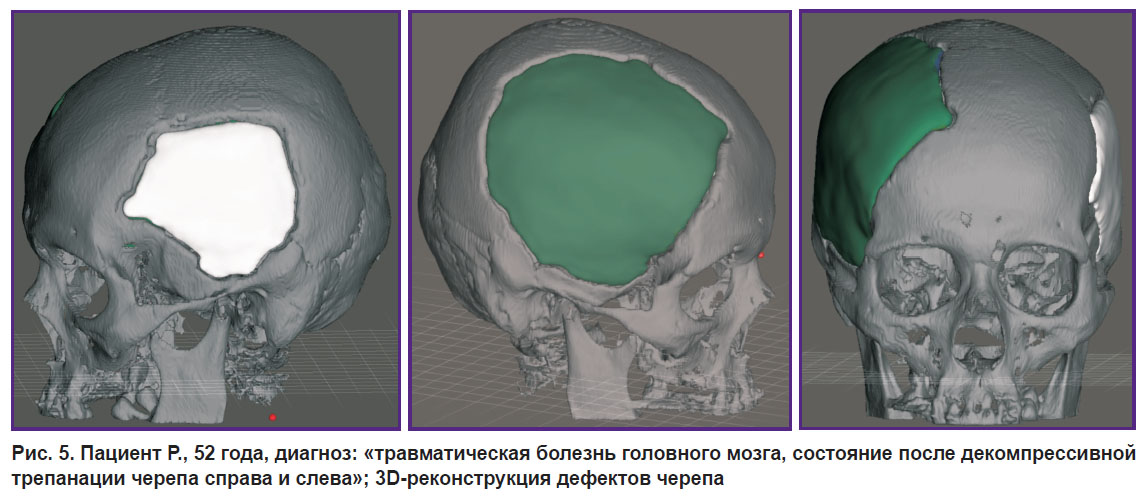
Пациент Р., 52 года, Набережные Челны.
Диагноз: «травматическая болезнь головного мозга. Поздний восстановительный период тяжелого ушиба головного мозга (октябрь 2013 г.). Состояние после декомпрессивной трепанации справа с удалением острой субдуральной гематомы и трепанации слева с удалением острой эпидуральной гематомы».
Анамнез: в октябре 2013 г. в результате ДТП (сбит машиной) пациент получил тяжелую черепно-мозговую травму — ушиб головного мозга тяжелой степени. Острая субдуральная гематома справа. Острая эпидуральная гематома слева. Дислокация срединных структур мозга влево на 10 мм. Отек головного мозга.
Выполнена декомпрессивная трепанация черепа справа с удалением острой субдуральной гематомы, трепанация слева с удалением острой эпидуральной гематомы. Состояние пациента — хороший регресс общемозговой и очаговой неврологической симптоматики. Выход из комы — на 2-е сутки. Регресс грубого левостороннего гемипареза до легкого за 22 дня госпитализации.
Оперативное вмешательство: 14.03.2017 г. выполнена краниопластика с двух сторон полимерным костнозамещающим материалом «Рекост-М» с использованием 3D-моделирования. Продолжительность операции — 90 мин. Кровопотеря — 150 мл. Осложнений нет. Протезы после менинголиза фиксированы костными швами. Подкожное пространство дренировано поливинилхлоридными дренажами на 24 ч.
Послеоперационный период протекал гладко, без осложнений. Пациент выписан на 8-е сутки (рис. 5).
|
Рис. 5. Пациент Р., 52 года, диагноз: «травматическая болезнь головного мозга, состояние после декомпрессивной трепанации черепа справа и слева»; 3D-реконструкция дефектов черепа |
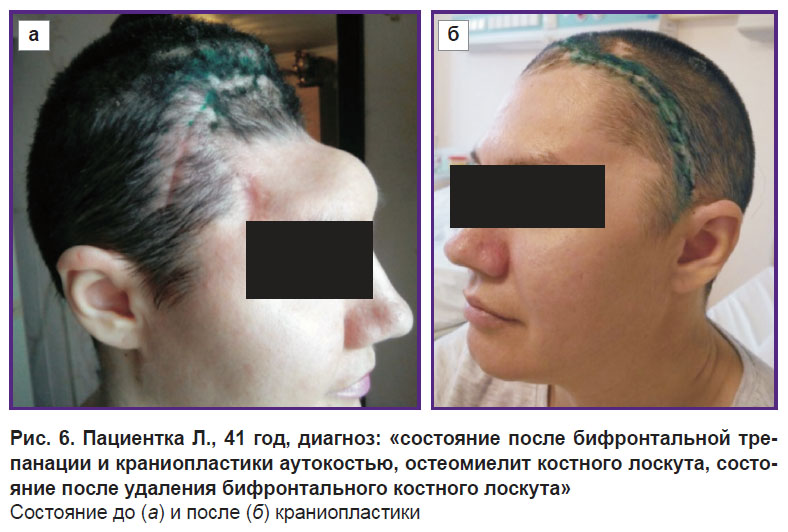
Пациентка Л., 41 год, Набережные Челны.
Диагноз: «поздний восстановительный период нетравматического субарахноидального кровоизлияния. Аневризматическая болезнь головного мозга. Состояние после открытого клипирования аневризмы передней соединительной артерии 05.02.2016 г. Состояние после декомпрессивной бифронтальной трепанации черепа 06.02.2016 г. Состояние после краниопластики аутокостью 05.10.2016 г. Остеомиелит костного лоскута, состояние после удаления бифронтального костного лоскута 11.01.2017 г.».
Анамнез: 05.02.2016 г. пациентка оперирована по поводу разрыва мешотчатой аневризмы передней соединительной артерии. 06.02.2016 г. в связи с некупируемой внутричерепной гипертензией и развитием отека головного мозга пациентке была выполнена бифронтальная декомпрессивная трепанация (костный лоскут сохранен подкожно в передней стенке живота). Послеоперационный период протекал с хорошим регрессом неврологического дефицита. В октябре 2016 г. была выполнена краниопластика аутокостью. В январе 2017 г. в связи с развившимся остеомиелитом костного лоскута выполнено его удаление.
Оперативное вмешательство: 25.08.2017 г. выполнена краниопластика полимерным костнозамещающим материалом «Рекост-М» с использованием 3D-моделирования. Продолжительность операции — 70 мин. Кровопотеря — 100 мл. Осложнений нет. Периоперационная антибиотикопрофилактика — 1 г цефазолина. Протез после менинголиза фиксирован 8 костными швами. Подкожное пространство дренировано поливинилхлоридным дренажом на 24 ч.
Послеоперационный период протекал гладко, без осложнений. Пациентка выписана на 7-е сутки (рис. 6).
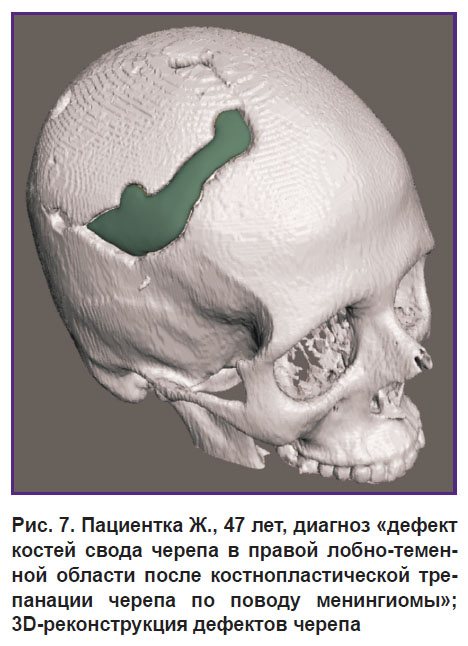
Пациентка Ж., 47 лет, Ростов-на-Дону.
Диагноз: «состояние после костнопластической трепанации черепа в правой лобно-теменной области по поводу менингиомы, дефект костей свода черепа в правой лобно-теменной области».
Анамнез: 13.05.2015 г. пациентка оперирована по поводу менингиомы правой лобно-теменной области с внутрикостным ростом. Выполнена костно-пластическая трепанация черепа в правой лобно-теменной области, дополненная резекционной краниотомией. Постоянно получала противосудорожную терапию. Приступов не отмечалось. Наблюдалась у пульмонолога по месту жительства по поводу бронхиальной астмы. Беспокоит наличие дефекта костей свода черепа в правой лобно-теменной области размерами 7×3×3 см.
С целью уточнения размеров дефекта костей свода черепа выполнена спиральная компьютерная томография 15.10.2017 г. с последующим 3D-моделированием и изготовлением имплантата из биополимера «Рекост-М» для последующей краниопластики.
Оперативное вмешательство: 22.11.2017 г. больная оперирована, выполнена аллокраниопластика с применением 3D-моделирования для закрытия дефекта костей свода черепа. По старому послеоперационному рубцу выполнен подковообразный разрез. Кожно-апоневротический лоскут отсепарирован и отвернут. Распатером обработаны края костного дефекта, разделены спайки твердой мозговой оболочки с краем кости. Трансплантатом из материала «Рекост-М», изготовленным с применением метода 3D-моделирования, полностью конгруэнтно закрыт костный дефект. Трансплантат фиксирован четырьмя краниофиксами. Выполнен гемостаз в ране. Кожно-апоневротический лоскут уложен на место. Рана ушита отдельными узловыми швами.
Выписана 02.12.2017 г. с выздоровлением (рис. 7).
|
Рис. 7. Пациентка Ж., 47 лет, диагноз «дефект костей свода черепа в правой лобно-теменной области после костнопластической трепанации черепа по поводу менингиомы»; 3D-реконструкция дефектов черепа |
Заключение
Замещение посттрепанационных дефектов черепа имплантатами из костнозамещающего материала «Рекост-М» зарекомендовало себя как надежный метод краниопластики. Использование 3D-технологии позволяет моделировать индивидуальные имплантаты любой сложности.
Финансирование исследования. Работа проведена на собственные средства авторов.
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Литература
- Педаченко Е.Г., Кущаев С.В. Современные костные цементы для пункциональной вертебропластики. Український нейрохірургічний журнал 2001; 4: 24–31.
- Гинзбург Е.Р., Старых Е.С. Применение консервированных брефотрансплантатов в хирургии дефектов костей свода черепа. В кн.: Материалы V съезда нейрохирургов России. Уфа; 2009; с. 383.
- Бельченко В.А., Притыко А.Г. и др. Костные аутотрансплантаты со свода черепа в хирургии врожденных и приобретенных деформаций черепно-лицевой области. В кн.: Материалы V съезда нейрохирургов России. Уфа; 2009; с. 381.
- Леонов С., Кузнецов Д., Евсеев М. Опыт использования перфорированной титановой сетки «ротормед» при пластике дефектов черепа. В кн.: Материалы V съезда нейрохирургов России. Уфа; 2009; с. 391.
- Геворков А.В., Давыдов Е.А. Аутокраниопластика с применением демпферных фиксаторов из никелида титана с термомеханической памятью формы. В кн.: Материалы V съезда нейрохирургов России. Уфа; 2009; с. 382.
- Липатов Ю.С., Керча Ю.Ю., Сергеева Л.М. Структура и свойства полиуретанов. К: Наукова думка; 1970.
- Композиционные материалы на основе полиуретанов. Под ред. Бюист Дж.М. М: Химия; 1982.
- Колмогоров Ю.Н., Успенский И.В., Слиняков А.Ю., Новиков А.Е. Костнозамещающий материал. Патент РФ RU 2518753. 2014.
- Горбатов Р.О., Нифтуллаев Р.М., Новиков А.Е. Прецизионные персонифицированные имплантаты для замещения костных дефектов при лечении пациентов с остеоонкологией. Современные проблемы науки и образования 2016; 6: 247.
- Клеменова И.А., Новиков А.В., Горбатов Р.О., Новиков А.Е. Индивидуальные имплантаты из костнозамещающего материала для лечения онкологической патологии костной ткани. Международный журнал прикладных и фундаментальных исследований 2017; 9: 30–33.
- Карякин Н.Н., Горбатов Р.О., Новиков А.Е., Нифтуллаев Р.М. Хирургическое лечение пациентов с опухолями длинных трубчатых костей верхних конечностей с использованием индивидуальных имплантатов из костнозамещающего материала, созданных по технологиям 3D-печати. Гений ортопедии 2017; 23(3): 323–330.