Морфологические изменения при кератоконусе: интерпретация результатов конфокальной микроскопии роговицы
Цель исследования — предложить интерпретацию результатов конфокальной микроскопии на основе их сравнения с морфологической картиной роговицы и в соответствии с принципами построения конфокальных изображений.
Материалы и методы. В течение 10 лет (2005–2015 гг.) проводили мониторинг и динамическое наблюдение за 660 пациентами с кератоконусом I–IV стадии (1268 глаз). Отдельно была сформирована группа из 160 пациентов с субклинической стадией кератоконуса (268 глаз). Роговичные диски, удаленные при операции сквозной пересадки роговицы, послужили материалом для изготовления парафиновых срезов с целью изучения морфологических изменений и сопоставления их с результатами конфокальной микроскопии, проведенной до оперативного вмешательства. Окраска срезов — гематоксилином и эозином. Для конфокальной микроскопии роговицы использовали конфокальный микроскоп ConfoScan 4 (Nidek Technologies Srl, Япония).
Результаты и обсуждение. С помощью конфокальной микроскопии роговицы выявлены наиболее специфичные признаки субклинического кератоконуса. Предложена концепция интерпретации данных признаков с точки зрения законов оптики и принципов построения конфокального изображения. Оптический феномен увеличения светоотражения ядрами кератоцитов может быть следствием увеличения светорассеяния в окружающих тканях. Феномен видимой (иглообразной) деформации ядер кератоцитов может являться следствием нарушения пространственной ориентации коллагеновых пластин. Предложен вариант интерпретации светового феномена образования микрострий в строме роговицы при развитом кератоконусе, который подтвержден с помощью гистологического исследования роговиц. В области боуменовой мембраны регистрировали дефекты роговицы, процессы фиброцеллюлярной пролиферации и пролиферации эпителия. Данные подтверждены с помощью анализа гистологических срезов роговиц. При конфокальной микроскопии обнаружены возможные варианты закрытия дефектов десцеметовой мембраны.
Заключение. Результаты проведенных исследований позволяют оценить информативность метода конфокальной микроскопии роговицы, предложить определенную трактовку полученных данных и подтвердить ее с помощью анализа гистологических срезов.
Введение
Оценка морфофункционального статуса роговицы необходима для достижения успешных результатов оптической и хирургической коррекции различных рефракционных нарушений, а также для оценки тяжести патологического процесса, эффективности лечения и определения тактики ведения больного. В настоящее время существуют информативные неинвазивные методы исследования, позволяющие визуализировать получаемый результат, что расширяет как диагностические возможности, так и возможности мониторинга.
Одним из методов, используемых в настоящее время для исследования роговицы, является конфокальная микроскопия [1]. Она представляет собой вариант оптической микроскопии, позволяющий достигать бóльших увеличений и получать значительно более контрастные изображения исследуемого объекта по сравнению с изображениями микроскопов классической схемы. Это достигается использованием апертуры, размещенной в плоскости проекции, которая ограничивает поток фонового рассеянного света. Таким образом, повышение контраста изображения связано с тем, что осветитель не создает освещенности поля зрения по всей глубине получаемого изображения, а фокусирует свет преимущественно в плоскости фокуса. Наибольшее количество сходящихся лучей концентрируется в единой фокальной точке. Использование данной схемы предполагает строгое соблюдение равных размеров апертуры осветителя и апертуры микроскопа.
В современном биологическом лазерном сканирующем конфокальном микроскопе в каждый момент времени регистрируется изображение одной точки объекта, а полноценное изображение строится путем сканирования образца или перестройки оптической системы [2]. Впервые конфокальная схема микроскопа, обеспечивающая высокий контраст изображений и возможность исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, была предложена М. Минским (США) в 1961 г. [3]. На основе упрощенной оптической схемы, позволяющей в полевом монохроматическом освещении получать простую оптическую проекцию объектов, создан конфокальный микроскоп для прижизненной микроскопии роговицы ConfoScan 4 (Nidek Technologies Srl, Япония). Данный прибор производит послойное сканирование роговицы, размер исследуемой зоны — 440×330 мкм. Проведение исследования возможно как в центральной зоне, так и в парацентральных участках.
В настоящее время данная методика достаточно широко используется для диагностики и мониторинга кератоконуса и других видов дистрофий и заболеваний роговицы. Оценка состояния тканей роговицы, клеточных элементов при данном виде микроскопии возможна при получении определенной микроскопической картины, причем изображение является результатом различной степени светоотражения и светорассеяния структурными элементами клеток и межклеточного матрикса [4, 5].
Несмотря на некоторые ограничения в экспозиции объектов по глубине, средняя яркость точек изображения в значительной мере определяется характером и интенсивностью рэлеевского светорассеяния на оптических неоднородностях тканей роговицы. Появление оптических неоднородностей, размер которых превосходит половину длины волны света, приводит к дифракции света, увеличению светорассеяния и средней яркости точек. Необходимо учитывать, что на среднюю яркость текущего кадра оказывает влияние рассеяние света как в поверхностных, так и в подлежащих слоях роговицы относительно наблюдаемой плоскости. Именно это накладывает ограничения на применение конфокального микроскопа для построения денситометрических кривых.
Наблюдаемая микроскопическая картина формируется в результате определенного сочетания структурных изменений в тканях роговицы. Однако специфичность конфокальной микроскопии как метода диагностики этих изменений относительно невысока. Это связано с тем, что различные патологические процессы могут приводить к однотипному совокупному изменению преломления, светоотражения и светорассеяния форменными элементами тканей роговицы.
В настоящее время накоплен большой объем информации о результатах конфокальной микроскопии роговицы при различных видах патологии, но нередко основой их трактовки являются предположения, уточнить и подтвердить которые не представляется возможным, так как исследование прижизненное и неинвазивное.
Однако объяснить некоторые основные оптические феномены может позволить анализ получаемого изображения с использованием законов оптики и принципов построения конфокального изображения. Частично результат может быть подтвержден данными гистологических методов (исследование роговичных дисков, полученных при сквозной пересадке роговицы).
Наибольшие затруднения при диагностике кератоконуса возникают в начальной субклинической стадии, когда клинические проявления отсутствуют. В этом случае данные конфокальной микроскопии могут быть дополнительным, а в ряде случаев — решающим аргументом в пользу такого диагноза. Однако начальные изменения при кератоконусе могут быть и недостаточно специфичными [6].
Цель исследования — предложить интерпретацию результатов конфокальной микроскопии на основе их сравнения с морфологической картиной роговицы и в соответствии с принципами построения конфокальных изображений.
Материал и методы
В течение 10 лет (2005–2015 гг.) проводили мониторинг и динамическое наблюдение за 660 пациентами с кератоконусом I–IV стадии (1268 глаз). Отдельно была сформирована группа из 160 пациентов с субклинической стадией кератоконуса (268 глаз). Кератоконус I стадии был диагностирован на 320 глазах, II стадии — на 340, III стадии — на 206, IV стадии — на 134 глазах.
Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Научно-исследовательского института глазных болезней. От каждого пациента получено информированное согласие.
На 64 глазах у пациентов с кератоконусом III–IV стадии была проведена операция сквозной пересадки роговицы. Роговичные диски, удаленные при данной операции, послужили материалом для изготовления парафиновых срезов, окрашенных гематоксилином и эозином. Гистологические препараты исследовали на светооптическом микроскопе Leiсa DM2500 (Leiсa Microsystems, Германия) при увеличении 125–400. Морфологические изменения сопоставляли с результатами конфокальной микроскопии, проведенной до оперативного вмешательства.
Для конфокальной микроскопии роговицы использовали конфокальный микроскоп ConfoScan 4.
Результаты и обсуждение
При субклинической стадии кератоконуса эпителий, как правило, не изменен. В ряде случаев можно наблюдать начальные признаки эпителиопатии в виде нечеткости границ, нарушения межклеточных контактов и изменения формы эпителиоцитов. В области мейбомиевой мембраны также не выявляется каких-либо изменений.
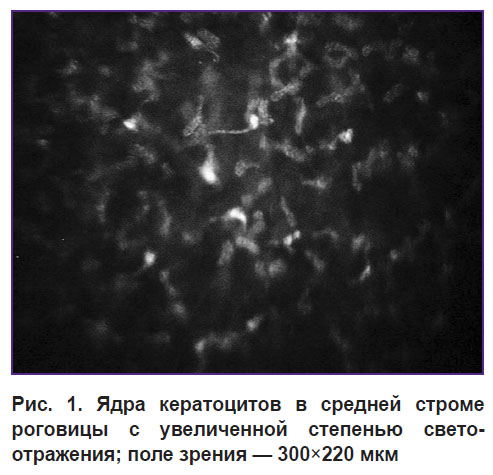
Один из ранних признаков структурных нарушений в строме роговицы — появление ядер кератоцитов с повышенной степенью рефлективности (рис. 1). В зарубежной литературе встречаются объяснения данного феномена. Увеличение яркости ядер кератоцитов трактуется как результат повышения уровня метаболизма клеток. Такие кератоциты называют активированными, «стрессовыми» клетками, деятельность которых направлена на поддержание внутреннего гомеостаза роговицы [1].
|
Рис. 1. Ядра кератоцитов в средней строме роговицы с увеличенной степенью светоотражения; поле зрения — 300x220 мкм |
Данный оптический феномен трактуется как ответ на состояние гипоксии, воспалительные и рубцовые процессы, в том числе может быть и одним из ранних признаков кератоконуса: появление ярких ядер кератоцитов — это ответ на какой-либо стресс [6]. Однако с точки зрения оптики данное утверждение является некорректным. Для увеличения светоотражения оптическая плотность ядра клетки должна увеличиться, что является нелогичным, так как уплотнение хроматина ядра клетки характерно для процессов, возникающих при ее апоптозе, когда клетка гибнет и уровень метаболизма снижается [7]. Более того, наблюдаемое зачастую многократное увеличение яркости «отражения» от поверхности ядерной мембраны было бы невозможно без существенного изменения химического состава ядра или цитоплазмы, которое, вне всяких сомнений, не допускается физиологической устойчивостью клетки.
Изменение степени светоотражения клеточными элементами стромы можно объяснить изменениями, возникающими в окружающих клетку структурах, что может быть связано с распределением гликозоамингликанов, нарушением водного баланса, ориентации коллагеновых пластин стромы. Происходящие изменения ведут к снижению прозрачности, оптической однородности ткани и в итоге — к увеличению светорассеяния.
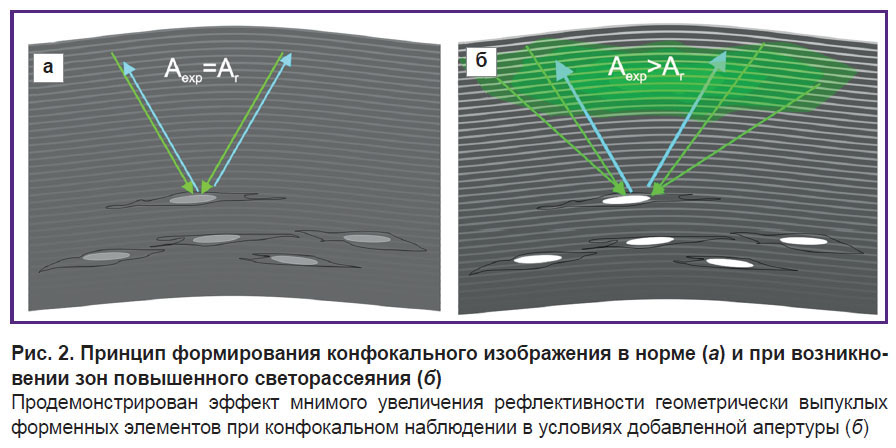
Основной принцип конфокальной микроскопии — соответствие размеров апертуры осветителя и апертуры микроскопа, что обеспечивает ход лучей осветителя и лучей, отраженных от объекта под одним углом (рис. 2, а).
Возникновение в строме роговицы зон повышенного светорассеяния, предлежащих по отношению к наблюдаемому объекту, приводит к увеличению апертуры осветителя (т.е. к увеличению угла, под которым сходятся лучи к объекту), что ведет к нарушению принципа конфокального наблюдения и мнимому увеличению яркости отражения от поверхности всех выпуклых форменных элементов стромы. При данной ситуации помимо лучей из осветителя, которые обеспечивают определенную яркость выпуклых поверхностей, на объект падают лучи с расширенной зоны, что усиливает эффект их отражения (рис. 2, б).
Одним из ранних признаков возникающих морфологических нарушений в строме роговицы, выявляемых при конфокальной микроскопии, является увеличение эффекта светоотражения от слоя эндотелия в области десцеметовой мембраны. Данный оптический феномен встречается в 53% случаев при субклинической стадии кератоконуса (рис. 3, а, показано стрелкой).

|
Рис. 3. Увеличение эффекта светоотражения от слоя эндотелия в области десцеметовой мембраны (стрелки): а — поперечный срез; б — прямая проекция; поле зрения — 300x220 мкм |
Увеличение степени светоотражения от слоя эндотелия также может быть результатом увеличения светорассеяния в предлежащих слоях стромы.
Необходимо указать еще на один признак, который встречается при субклиническом кератоконусе, — характерную вертикальную исчерченность стромы с соответствующей ориентацией ядер кератоцитов, что является предвестником появления микрострий и наиболее вероятно связано с перераспределением линий натяжения в строме. Данный феномен при субклиническом кератоконусе наблюдается в 30% случаев и является более характерным для кератоконуса, приближающегося к клинической стадии (рис. 4, а).

|
Рис. 4. Вертикальная ориентация ядер кератоцитов (а), иглообразная форма ядер кератоцитов в задней строме (б); поле зрения — 300x220 мкм |
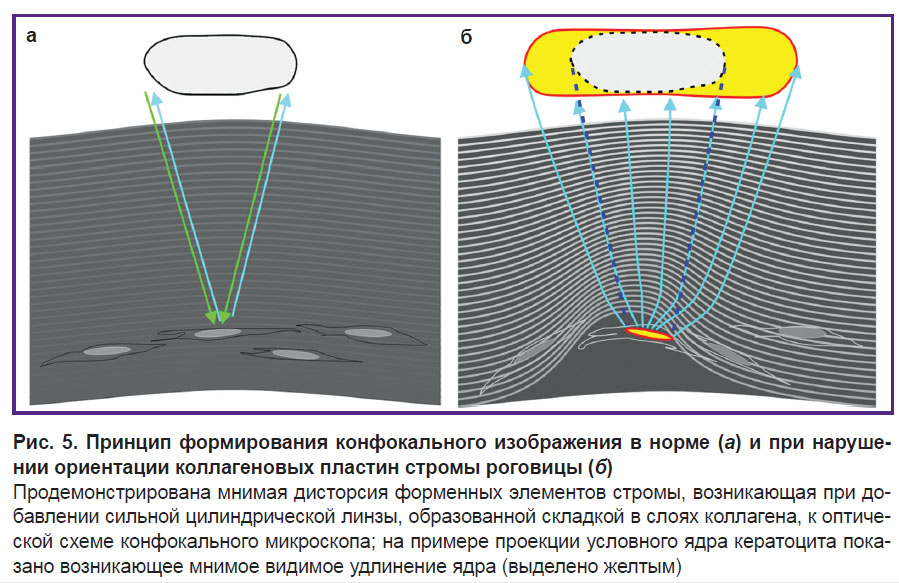
Достаточно специфичным признаком субклинического кератоконуса служит оптический феномен, встречающийся, по нашим данным, в 57% случаев — появление иглообразых образований в задних слоях стромы (рис. 4, б). В зарубежной литературе об их происхождении имеются осторожные предположения, что это могут быть видоизмененные ядра кератоцитов [1]. На наш взгляд, феномен видимой деформации ядер кератоцитов может иметь оптическую природу и являться следствием нарастания патологических изменений в строме роговицы, которые в свою очередь приводят к изменению пространственной ориентации коллагеновых пластин и образованию волнообразных складок. Складки стромы по мере увеличения геометрической амплитуды начинают проявлять свойства цилиндрической линзы, что приводит к мнимому растяжению изображений объектов за счет отклонения отраженных лучей на крыльях складки (рис. 5).
Данные изменения регистрируются в задних слоях стромы, но по мере прогрессирования патологического процесса могут обнаруживаться и в средних слоях. В развитых стадиях кератоконуса, как правило, данный признак отсутствует. Динамика морфологических нарушений свидетельствует о том, что патологический процесс при кератоконусе начинает развиваться с задних слоев стромы, постепенно распространяясь к средним ее слоям. Исчезновение иглообразных образований в развитых стадиях заболевания можно объяснить грубыми структурными нарушениями, что при конфокальной микроскопии маскирует данный эффект.
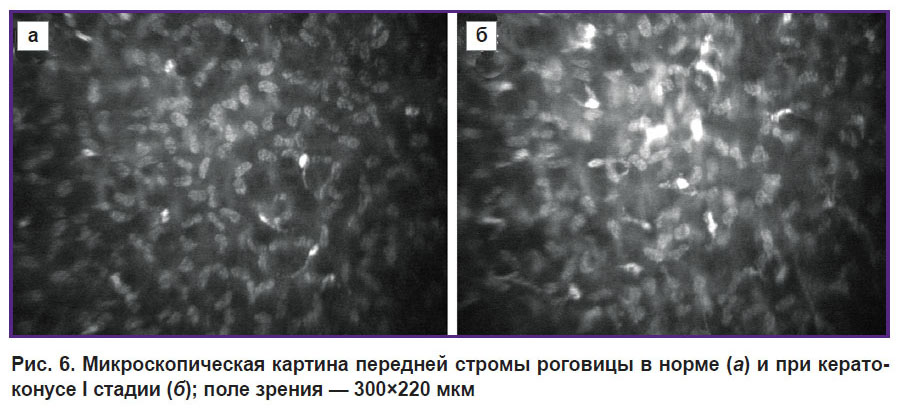
Начальные изменения в слоях передней стромы роговицы при кератоконусе I стадии в ряде случаев можно заметить при биомикроскопии в области формирующейся вершины эктазии. Можно наблюдать сероватый участок с неравномерным световым рефлексом — данный признак описывают как симптом «разрежения стромы», «фейерверка» и др. [8–10]. Однако при конфокальной микроскопии не удается выявить признаков разрежения в передних слоях стромы, напротив, оптическая плотность ткани и клеточных элементов возрастает, что ведет к увеличению светоотражения. В строме формируются микрозоны повышенной оптической плотности, увеличивается отражательная способность ядер кератоцитов, что служит причиной нарушения оптической однородности и увеличения эффекта светорассеяния (рис. 6).
|
Рис. 6. Микроскопическая картина передней стромы роговицы в норме (а) и при кератоконусе I стадии (б); поле зрения — 300x220 мкм |
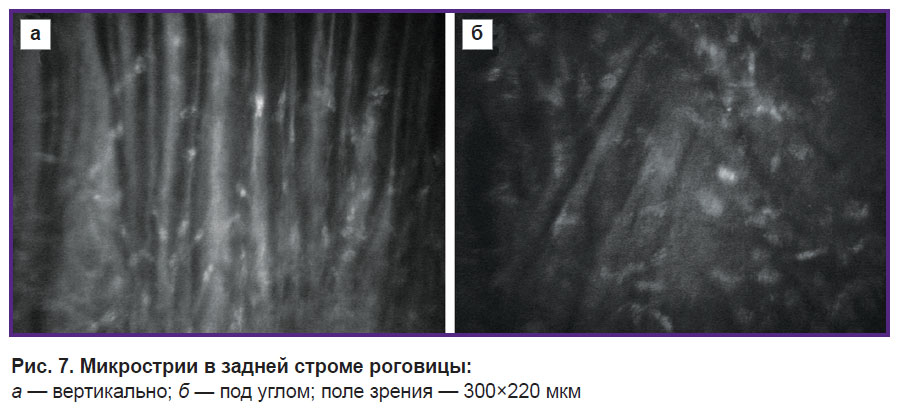
Одним из наиболее типичных и специфичных проявлений патологического процесса в строме роговицы, выявляемых при конфокальной микроскопии (I–II стадия кератоконуса), является появление чередующихся черно-белых полос, так называемых микрострий. Ориентация полос, как правило, вертикальная, однако в ряде случаев микрострии могут располагаться и поперечно, и под углом (рис. 7). На начальной стадии образования при биомикроскопии они не видны, однако когда формирование складок приводит к достаточному световому контрасту, их можно наблюдать в виде так называемых линий кератоконуса. Линии кератоконуса в ряде случаев трактуются как «стрессовые линии», «линии напряжения» либо как признак растяжения стромы, результат разъединения и расхождения коллагеновых пластин [8–10]. L. Mastropasqua, M. Nubile[1] при описании конфокальной микроскопической картины при кератоконусе высказывают предположение, что микрострии являются проявлением альтерации и деформации коллагеновых пластин и могут означать образование микроскладок либо микротрещин экстрацеллюлярного матрикса.
|
Рис. 7. Микрострии в задней строме роговицы: а — вертикально; б — под углом; поле зрения — 300x220 мкм |
На наш взгляд, появление при конфокальной микроскопии роговицы микрострий и впоследствии линий кератоконуса, видимых при биомикроскопии, является следствием дальнейшего развития патологического процесса и увеличением амплитуды складок стромы роговицы. По мере увеличения геометрической амплитуды складок стромы образуется абсолютная цилиндрическая линза, что полностью исключает формирование конфокальных изображений объектов, располагающихся за ней, в более глубоких слоях. На гребне складки (при ее определенном протяжении) возможно отражение лучей, создающих светлую полосу. На крыльях складки будет создаваться эффект темной полосы, так как отраженные лучи света на крыльях отклоняются и не попадают в апертуру объектива микроскопа (рис. 8).
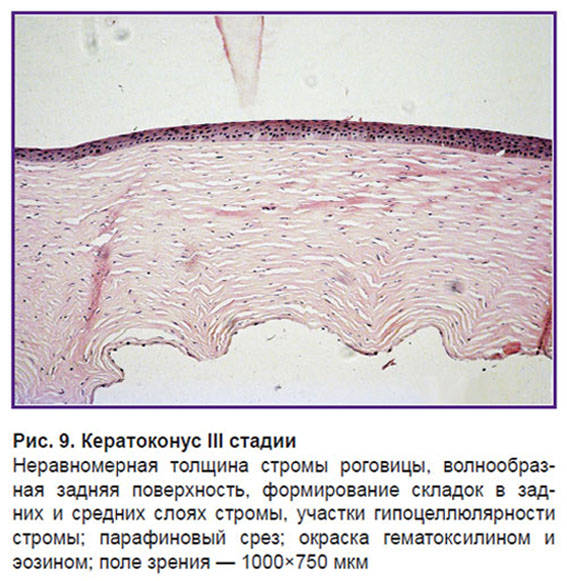
Данное положение можно подтвердить результатами гистологических методов исследования. На гистологических срезах роговичных дисков, полученных при сквозной пересадке роговицы, можно видеть сформированные складки стромы, распространяющиеся от задних слоев к средним. Амплитуда складок максимальна в задних слоях. Это также подтверждает наше предположение, что структурные нарушения при кератоконусе наиболее выражены в задних отделах стромы с постепенным их распространением на ее средние и передние слои (рис. 9). С данной позиции легко объясним симптом исчезновения линий кератоконуса, наблюдаемых при биомикроскопии, при легкой компрессии на поверхность роговицы. В этом случае происходит сглаживание складок, уменьшение их амплитуды, что приводит к исчезновению данного оптического феномена.
По мере прогрессирования кератоконуса нарастают патологические изменения в эпителиальных слоях и в области боуменовой мембраны. В ряде случаев при конфокальной микроскопии эти дефекты удается регистрировать (рис. 10, а).
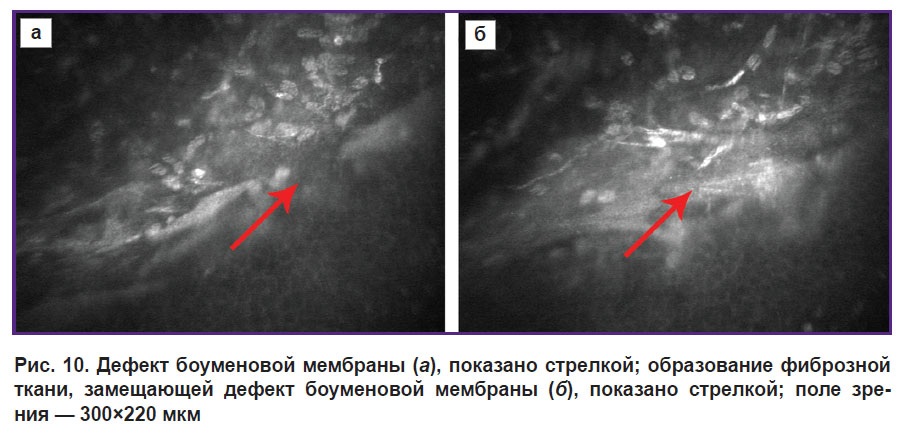
|
Рис. 10. Дефект боуменовой мембраны (а), показано стрелкой; образование фиброзной ткани, замещающей дефект боуменовой мембраны (б), показано стрелкой; поле зрения — 300x220 мкм |
При возникновении дефектов боуменовой мембраны можно наблюдать активацию тканевых адаптационно-приспособительных защитных механизмов, которые реализуются в двух направлениях. Со стороны стромы дефект закрывается в результате фиброцеллюлярной пролиферации и образования фиброзной ткани (рис. 10, б), что в последующем приводит к появлению высокорефлективных непрозрачных зон, регистрируемых при конфокальной микроскопии в области боуменовой мембраны при развитых стадиях кератоконуса.
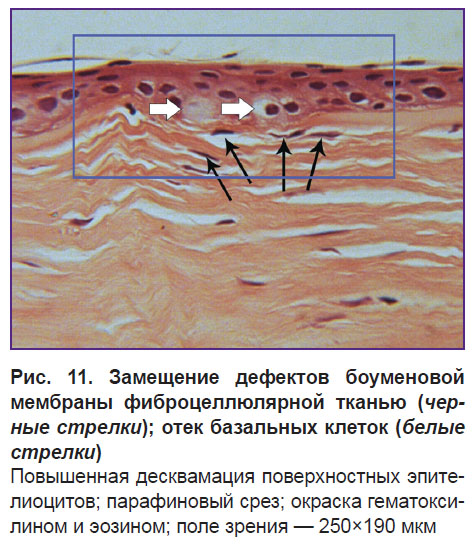
Со стороны эпителия в области дефектов боуменовой мембраны наблюдаются процессы пролиферации с признаками отека клеток и нарушением морфологии эпителиальных слоев, что можно продемонстрировать с помощью гистологического среза роговицы (рис. 11). На гистологическом срезе видны отечные клетки базального слоя эпителия, веретеновидные фибробластоподобные клетки фиброцеллюлярной ткани, замещающей дефекты боуменовой мембраны. На поверхности роговицы наблюдаются плоские клетки на разных стадиях десквамации.
Исследования с целью анализа гистопатологических изменений при кератоконусе проводились многими учеными. В частности, E. Sykakis с соавт. в 2012 г. [11] при описании морфологических нарушений при кератоконусе отметили положительную корреляцию между количеством дефектов боуменовой мембраны и толщиной эпителиального слоя роговицы. В результате пролиферации эпителия в области дефектов боуменовой мембраны могут образовываться эпителиальные «пробки», закрывающие дефект со стороны эпителия.
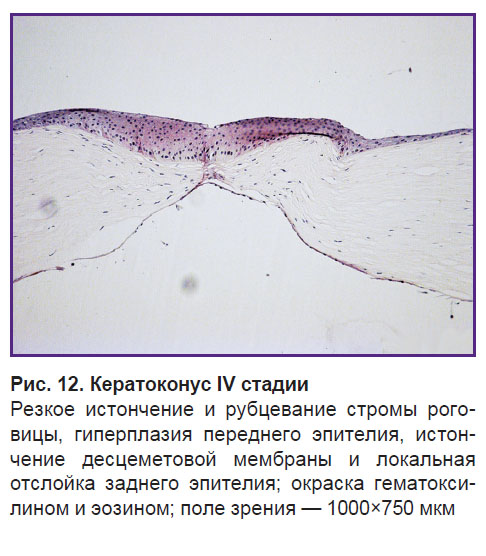
Гистологический срез, полученный при исследовании роговицы пациента с кератоконусом IV стадии, наглядно демонстрирует адаптационно-приспособительные защитные возможности роговицы, включающиеся в ответ на поражение (рис. 12). В зоне резкого истончения нормальная строма роговицы отсутствует, она замещена фиброзной тканью (формирование рубцовой ткани). Со стороны эпителия дефект закрыт утолщенным слоем эпителия, за счет его выраженной пролиферации сглажен дефект передней поверхности роговицы. Фиксируются истончение, отслойка и микроразрывы десцеметовой мембраны. В зоне истончения и рубцевания боуменовая мембрана отсутствует, отмечается гиперплазия переднего эпителия с нарушением рядности и дифференцировки эпителиоцитов.
Частыми находками в ходе исследования гистологических срезов роговиц при кератоконусе III–IV стадии являются патологические изменения десцеметовой мембраны, фиксируются ее разрывы, истончение, отслойка. Однако, как показали наши исследования, далеко не всегда следствием разрыва служит развитие острого кератоконуса. При обследовании с помощью конфокальной микроскопии пациентов с отсутствием в анамнезе состояний, которые оцениваются как острый кератоконус, можно выявить закрытые дефекты десцеметовой мембраны. Эти данные свидетельствуют о том, что при небольшом дефекте защитные тканевые механизмы успевают мобилизоваться и закрыть дефект. Со стороны стромы образуется плотная фиброзная бесструктурная ткань, которая со стороны эндотелия может быть покрыта частично за счет миграции эндотелиальных клеток, а также мелкими, возможно трансформированными фибробластоподобными клетками (рис. 13).
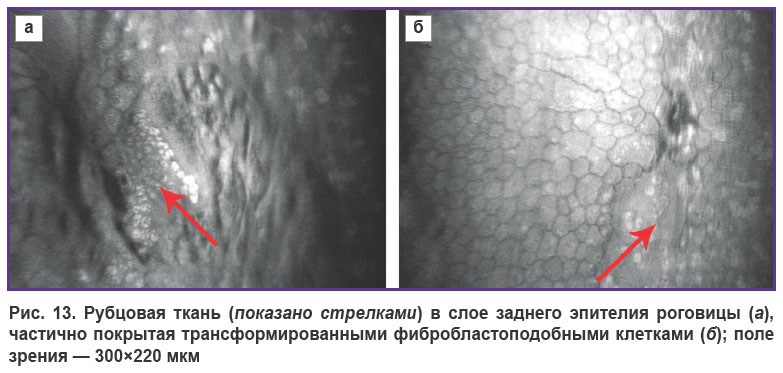 |
Рис. 13. Рубцовая ткань в слое заднего эпителия роговицы, частично покрытая трансформированными фибробластоподобными клетками (показано стрелками); поле зрения — 300x220 мкм |
Заключение
Очевидно, что правильное понимание изменений, происходящих на тканевом уровне при развитии заболевания, является ключом для расшифровки его патогенеза. Впервые с учетом физических основ распространения света в биологических тканях была пересмотрена трактовка изображений роговицы, получаемых методом прижизненной конфокальной микроскопии. На примере морфологических изменений стромы, возникающих при развитии кератоконуса, показаны оптические причины искажений яркости и геометрии форменных элементов ткани, которые ранее не расценивались как артефакты метода наблюдения. Результаты проведенных исследований позволяют оценить информативность метода конфокальной микроскопии роговицы, предложить определенную трактовку полученных данных и подтвердить ее с помощью анализа гистологических срезов.
Финансирование исследования. Исследование выполнено в рамках НИР (№ гос. регистрации 0511-2014-0031).
Конфликт интересов. У авторов нет конфликта интересов.
Литература
- Mastropasqua L., Nubile M. Confocal microscopy of the cornea. USA: SLACK Incorporated; 2002.
- Handbook of biological confocal microscopy. Pawley J.B. (editor). Springer US; 2006, https://doi.org/10.1007/978-0-387-45524-2 .
- Minsky M. Microscopy apparatus. US patent 3013467A. 1961.
- Щелоков Р.В., Яцышен В.В. Эллипсометрический метод в диагностике сред со сложной молекулярной структурой (роговица глаза). В кн.: X Международная школа-семинар «Электродинамика и техника СВЧ, КВЧ и оптических частот». M; 2002; т. 10(X); 2(34): 246.
- Тучин В.В. Исследование биотканей методами светорассеяния. Успехи физических наук 1997; 167(5): 517–539.
- Егорова Г.Б., Рогова А.Я., Митичкина Т.С. Диагностические возможности конфокальной микроскопии при субклинической стадии эктазий роговицы. Вестник офтальмологии 2012; 128(6): 25–29.
- Лушников Е.А., Абросимов А.Ю., Габай В.Л., Саенко А.С., Доросевич А.Е. Гибель клетки (апоптоз). М: Медицина; 2001.
- Keratoconus and keratoectasia: prevention, diagnosis and treatment. Wang M. (editor). USA: SLACK Incorporated; 2010.
- Киваев А.А., Бабич Г.А., Абугова Т.Д. Динамика биомикроскопических изменений роговицы при кератоконусе. Офтальмологический журнал 1979; 34(4): 217–218.
- Каспарова Е.А. Диагностика и лечение раннего кератоконуса. Глаз 2001; 2: 35–40.
- Sykakis E., Carley F., Irion L., Denton J., Hillarby M.C. An in depth analysis of histopathological characteristics found in keratoconus. Pathology 2012; 44(3): 234–239, https://doi.org/10.1097/pat.0b013e3283511b42.