Клиническое применение прогестинов и механизмы их действия: настоящее и будущее (обзор)
Изложены современные представления о механизмах действия ядерных, мембранных и митохондриальных рецепторов прогестерона. Изучены основные аспекты фармакологического действия прогестинов. Приведены данные о клиническом применении гестагенов по нозологическим группам. Особое внимание уделено прогестерону, мегестрола ацетату, медроксипрогестерона ацетату в связи с расширением спектра их действия. Рассмотрены возможности применения гестагенов как нейропротекторов, иммунномодуляторов и химиосенсибилизаторов.
Введение
Прогестерон является натуральным эндогенным половым стероидным гормоном, секретирующимся яичниками. Он взаимодействует со своими специфическими рецепторами в репродуктивном тракте, молочной железе и центральной нервной системе. Прогестерон и прогестины используют уже десятки лет в контрацепции, для сохранения беременности при угрозе выкидыша, в качестве симптоматической терапии постменопаузы, при вторичной аменорее, аномальных маточных кровотечениях [1, 2]. В последние 30 лет прогестины стали применять при эндометриозе и в лечении гормоночувствительных опухолей, а в последние 15 лет — в процедурах ВРТ (вспомогательных репродуктивных технологий) [3]. Клинически подтверждена эффективность некоторых гестагенов при кахексии и анорексии у раковых больных и больных СПИДом [4]. Благодаря обнаружению ранее неизвестных мишеней действия прогестинов — мембранассоциированных рецепторов прогестерона; белков-транспортеров ксенобиотиков, митохондриальной поры; белков контрольных точек сигнальных путей — наметились новые аспекты клинического применения прогестерона и его синтетических аналогов.
Механизм действия прогестинов (гестагенов)
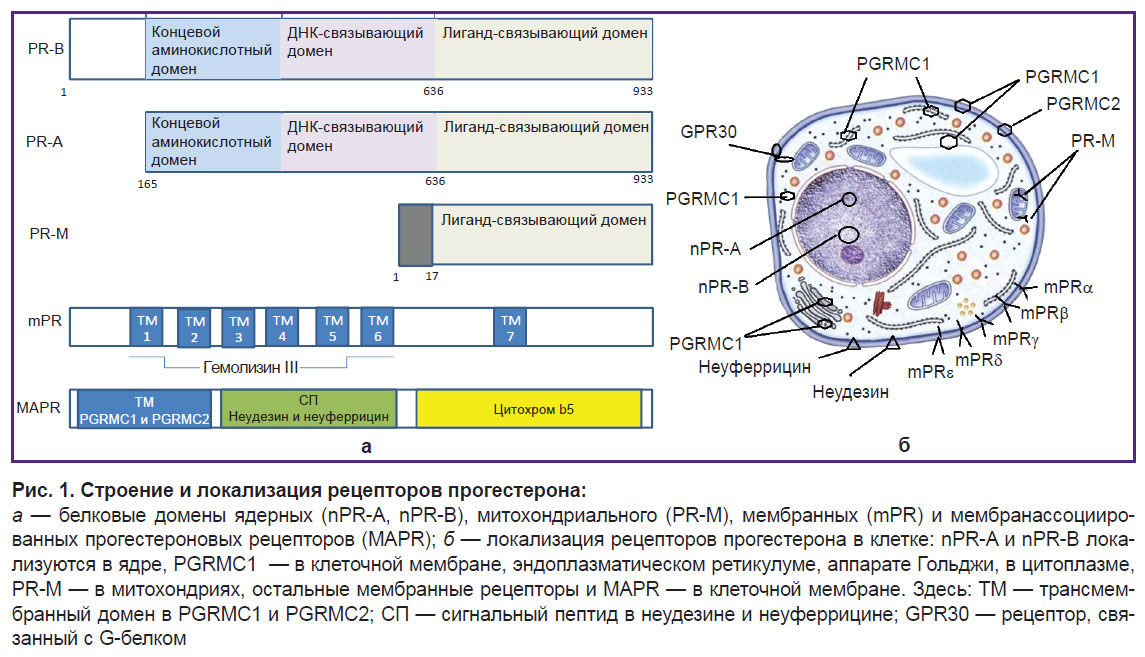
Механизм действия прогестинов реализуется через ядерные, мембранные и митохондриальные рецепторы прогестерона (рис. 1).
Ядерные рецепторы (nPR — nuclear progesterone receptors) представлены изоформами A и B (nPR-A и nPR-B) — продуктами транскрипции одного гена, возникающими в результате действия разных промоторов. При связывании гестагенов с ядерными рецепторами — транскрипционными факторами — наблюдаются геномные эффекты, развивающиеся в течение нескольких часов и суток, что приводит к характерным физиологическим и морфологическим изменениями в органах-мишенях — классическому гестагенному действию [5].
Прогестерон также вызывает быструю (минуты, часы) стимуляцию клеточных сигнальных каскадов через мембранные рецепторы (mPR — membrane progesterone receptors) и мембранассоциированные прогестероновые рецепторы (MAPR — membrane-associated progesterone receptors), представляющие собой два разных типа мембранных рецепторов [6]. Мембранные рецепторы первого типа — рецепторы adipoQ (PAQR): mPRα (PAQR7), mPRβ (PAQR8), mPRγ (PAQR5) — ассоциированы с ингибирующими G-белками, они снижают внутриклеточную концентрацию цАМФ; mPRδ (PAQR6) и mPRε (PAQR9), напротив, увеличивают ее [7]. mPRα экспрессируется преимущественно в репродуктивных органах человека, mPRβ — в ЦНС, mPRγ — в почках и кишечнике. Последние идентифицированные рецепторы mPRδ и mPRε пока мало изучены, но уже очевидны их нейропротекторная функция и локализация в ЦНС. Так, на биоптатах мозга внезапно умерших мужчин и женщин 16–65 лет показано, что mPRδ и mPRε представлены во всех структурах мозга; на клеточных моделях с высоким сродством они связывают нейростероиды дегидроэпиандростерона, прегнанолона, прегненолона, аллопрегнанолона и реализуют их антиапоптотическое действие [8].
Мембранные рецепторы второго типа — члены семейства b5-подобных гем/стероид-связывающих белков: мембранный компонент 1-го и 2-го рецепторов прогестерона (PGRMC1 и PGRMC2); неудезин (neudesin neurotrophic factor — NENF) и неуферрицин (CYP5D2), расположенные трансмембранно [9]. Они представлены в структурах переднего мозга, где прогестерон осуществляет нейроэндокринную регуляцию и другие негеномные эффекты: мембранный транспорт, стероидогенез, гомеостаз железа и транспорт гема за счет регуляции экспрессии гепсидина и активности феррохелатазы, транспорт липидов, миграцию нервных аксонов, синаптическую функцию и антиапоптотическое действие. Наиболее хорошо изучена роль PGRMC1 как многофункционального белка с гем-связывающим сайтом, обеспечивающего перенос белков-партнеров (рецепторов эстрадиола, факторов роста, цитохромов) из внутриклеточных депо к месту встречи со специфическим лигандом [5]. Локализация PGRMC1 может быть цитоплазматической, ядерной/нуклеолярной, митохондриальной, в эндоплазматическом ретикулуме, в цитоплазматических везикулах или внеклеточная (рис. 1, а). PGRMC1 участвует в процессах клеточного цикла на контрольной точке G1 во время митоза, а повышенная экспрессия PGRMC1 ассоциирована с плохим прогнозом во многих типах рака [10]. PGRMC2 структурно схож с PGRMC1, хотя существуют различия в N-терминальном трансмембранном домене. PGRMC2 изучен недостаточно, но известно, что он также участвует в процессах клеточного цикла и ингибирует миграцию клеток при опухолевой инвазии [9]. Неудезин обладает нейротрофической активностью, реализующейся путем связывания с гемом, которая затем опосредуется митоген-активируемым белком (MAP) и фосфатидилинозитол-3-киназой (PI3K). Неуферрицин (цитохромный домен b5) был идентифицирован путем поиска на основе гомологии с CYB5-подобным гем/стероид-связывающим доменом неудезина. Редкое состояние человека с дефицитом цитохрома b5 обусловливает нарушение сексуального развития и появление признаков гермафродитизма [11].
Самый последний открытый неядерный рецептор прогестерона — митохондриальный (PR-M — mitochondrial progesterone receptor). Он является усеченной версией nPR и локализуется в митохондриях (рис. 1, б) [12]. Через него осуществляется прямая лиганд-зависимая регуляция функций митохондрий; увеличивается выработка клеточной энергии, когда это необходимо — например, при беременности. Изучение роли митохондриального рецептора в различных клеточных процессах только начинается. Существует множество предположений о его функциях — увеличении пролиферации и жизнеспособности лобулярно-альвеолярных клеток молочной железы и клеток миометрия, повышении синтеза миофибрилл в миокарде и миометрии. Также можно говорить о роли, которую он играет в увеличении скорости клеточного метаболизма за счет индукции выработки АТФ митохондриями [6]. Прогестерон-зависимое увеличение базальной температуры тела традиционно связывали с его центральным влиянием на гипоталамус, однако идентификация PR-M ставит этот факт под сомнение.
Считается, что неклассические mPR и MAPR сначала эволюционировали у древних билатерий, а классические ядерные прогестероновые рецепторы появились позднее — у позвоночных [13].
Фармакологическое действие гестагенов
Основными фармакологическими эффектами прогестерона, реализуемыми преимущественно ядерными рецепторами, являются следующие: секреторная трансформация эндометрия; образование густой и вязкой цервикальной слизи; увеличение базальной температуры; снижение активности гладкой мускулатуры матки и половых путей (токолитический эффект); активация роста секреторного отдела ацинусов молочных желез и индукция лактации; стимуляция протеинлипазы; увеличение запасов жира; повышение уровня базального и индуцированного инсулина, а также скорости утилизации глюкозы; накопление в печени гликогена; выработка альдостерона; гипоазотемия и азотурия; увеличение (в малых дозах) или подавление (в больших дозах) продукции гонадотропных гормонов гипофиза. Фармакологические эффекты прогестинов, аналогов прогестерона, обычно оценивают с помощью ряда доклинических исследований на животных, а именно: определение сродства к рецепторам прогестерона; изучение гестагенной активности с помощью теста на трансформацию эндометрия, теста на сохранение беременности и теста ингибирования овуляции; определение андрогенной активности путем измерения веса предстательной железы или мышцы levator ani; измерение антиандрогенной активности или оценка феминизирующей активности у самцов крыс; анализ глюкокортикоидных и антиминералокортикоидных свойств [14].
Наиболее важную структурно-функциональную роль в механизме действия того или иного гестагена играют заместители при углеродных атомах C3 и C17 циклопентанпергидрофенантренового кольца — ядра стероида. Известно, что даже небольшие структурные отличия в молекулах стероидов могут вызывать значительные различия в их клинических эффектах на органы-мишени и на риск развития сердечно-сосудистых заболеваний. Так, натуральный прогестерон и некоторые его производные, например дроспиренон, обладают мощным антиминералокортикоидным действием и благотворно действуют на артериальное давление; диеногест не оказывает какого-либо андрогенного эффекта и, следовательно, отрицательно не влияет на липидный и углеводный обмен и непосредственно на эндотелиальные клетки. В исследовании на мышах, получавших кормовой рацион с высоким содержанием жира и дроспиренон, не наблюдалось увеличения массы тела и массы жировой ткани, не менялся уровень толерантности к глюкозе за счет антагонизма дроспиренона к минералокортикоидным рецепторам, контролирующим функцию адипоцитов [15]. Гестагены, у которых отсутствует кето-группа при углеродном атоме С3 (производные мепрегенола — Ацетомепрегенол, гестобутаноил), не способны связываться с андрогенными и минералокортикоидными рецепторами, поэтому они не оказывают побочных минералокортикоидного, андрогенного, верилизирующего действия [16, 17].
Клиническое применение гестагенов
Существующие на российском фармацевтическом рынке лекарственные формы гестагенов и их показания к применению представлены в таблице.
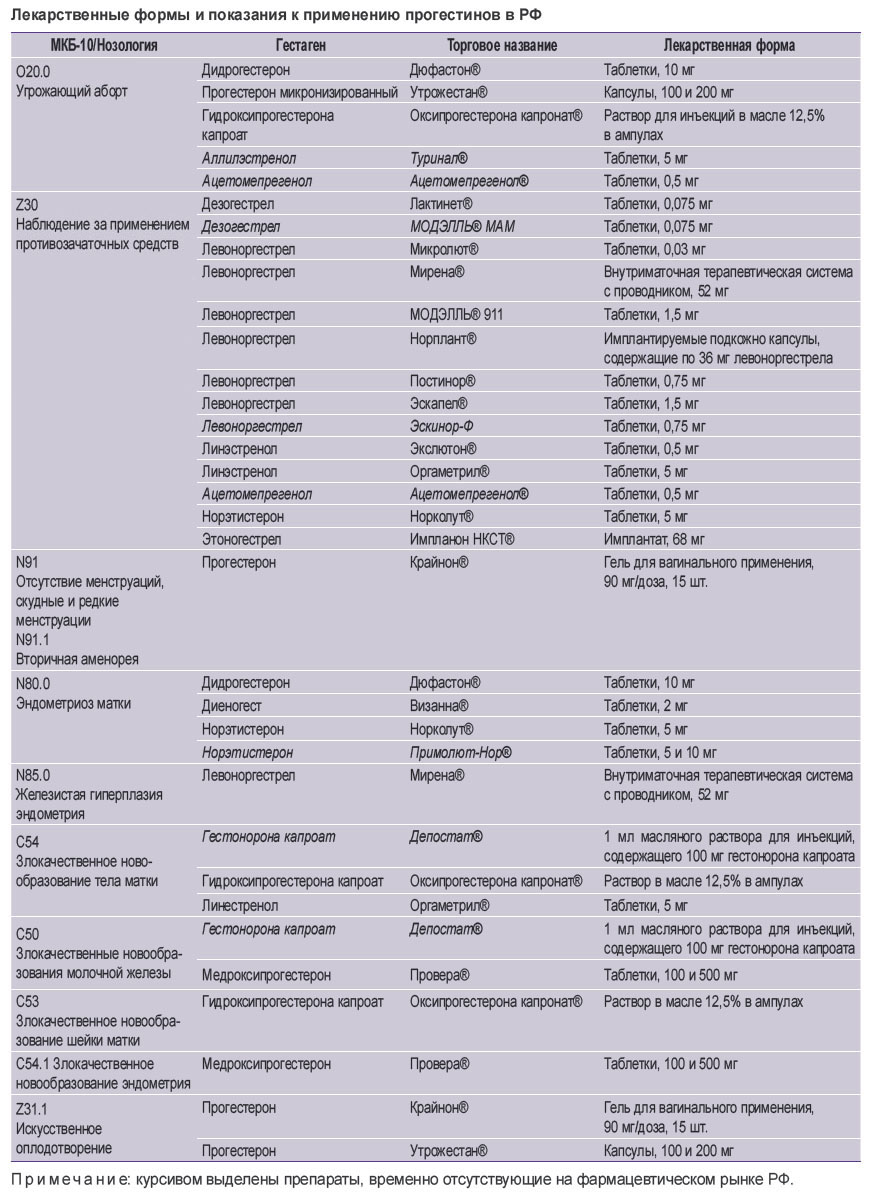 |
Лекарственные формы и показания к применению прогестинов в РФ |
Гестагены успешно используют для контрацепции, сохранения беременности, при вторичной аменорее. Они являются первой линией терапии гиперплазии и рака эндометрия [18–20]. Гестагены применяют в гормональной заместительной терапии (ГЗТ) для предотвращения остеопороза и в процедурах ВРТ [21].
Новым аспектом клинического применения гестагенов является лечение кахексии и анорексии мегестрола ацетатом. Он способствует увеличению массы тела, повышению аппетита, но механизм этого эффекта еще точно не установлен [22]. Влияние мегестрола ацетата на анорексию и увеличение массы тела может быть связано с ингибированием продукции провоспалительных цитокинов (IL-1, IL-6, различных TNF) и стимуляцией нейропептидом Y гипоталамуса [23]. В 1993 г. FDA (Food and Drug Administration) одобрила его применение для лечения анорексии, кахексии или необъяснимой потери веса у пациентов с синдромом приобретенного иммунодефицита (СПИДа). Преимущество этого гестана заключается в отсутствии общих токсических, мутагенных и канцерогенных свойств. Благодаря этому лечение рака эндометрия препаратом Мегейс на основе мегестрола ацетата позволяет молодым пациенткам сохранять репродуктивную функцию [24].
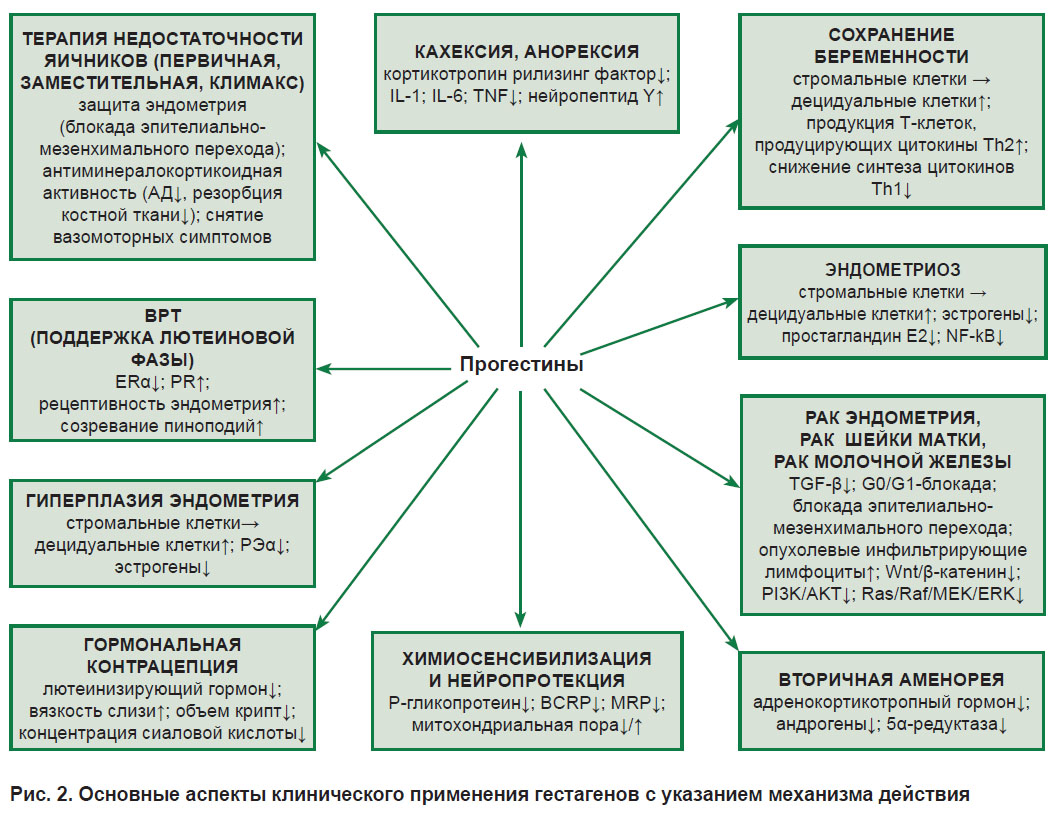
Основные аспекты клинического применения прогестинов и механизм их действия представлены на рис. 2.
|
Рис. 2. Основные аспекты клинического применения гестагенов с указанием механизма действия |
Гестагены в контрацепции и для сохранения беременности
Прогестерон играет важнейшую роль в наступлении и развитии беременности («гормон беременности») за счет различных механизмов: модуляции иммунного ответа матери и подавления воспалительного ответа; снижения сократимости матки (адекватные концентрации прогестерона в миометрии могут противодействовать стимулирующей активности простагландина, а также окситоцину); улучшения кровообращения в маточно-плацентарной системе и поддержки лютеиновой фазы (прогестерон способствует проникновению экстравиллярных трофобластов в децидуальные клетки путем ингибирования апоптоза этих трофобластов [25].
В 50–80-е гг. прошлого века основным показанием для назначения прогестинов было сохранение беременности. «Золотым стандартом» в настоящее время считается применение дидрогестерона (Дюфастон) и прогестерона (Утрожестан), эффективность которых доказана многими клиническими исследованиями [26–30].
Затем на фармацевтическом рынке появились контрацептивные препараты на основе гестагенов. Наибольшее разнообразие торговых наименований и лекарственных форм создано именно для этих целей. Миллионы женщин используют комбинированные оральные контрацептивы (КОК), поскольку они высокоэффективны для предотвращения беременности. Однако некоторым женщинам КОК могут не подходить из-за связанных с их применением рисков развития сердечно-сосудистых патологий. Кроме того, они способны вызывать побочные эффекты из-за присутствия в их составе эстрогенов: головную боль, тошноту, увеличение веса, напряжение в груди и другие. В отличие от более широко используемых КОК, существуют таблетки, содержащие только прогестаген, которые принимают на постоянной основе (мини-пили), а также устройства — спирали и пластыри, вырабатывающие небольшое количество гестагена ежедневно. Препараты, содержащие только прогестаген (прогестиновые оральные контрацептивы — ПОК), являются приемлемым вариантом для женщин, которым противопоказаны эстрогены. Среди многообразия мини-пили на фармацевтическом рынке США представлены ПОК, содержащие норэтиндрон, тогда как таблетки с левоноргестрелом или дезогестрелом доступны и на международном фармацевтическом рынке [31]. В РФ лидером продаж среди мини-пили является препарат Лактинет на основе дезогестрела.
Механизмы контрацептивного действия прогестинов следующие [32]:
1. Ингибирующее влияние на секрецию гонадотропных гормонов гипофиза (особенно лютеинизирующего гормона) и, как следствие, торможение овуляции (зависит от дозы гестагена в таблетке).
2. Повышение вязкости цервикальной слизи. Прогестагены уменьшают объем крипт, сгущают цервикальную слизь, снижают содержание сиаловой кислоты в слизи и активность сперматозоидов, сужают цервикальный канал, тем самым препятствуя проникновению сперматозоидов и некоторых микроорганизмов в цервикальный канал, матку и маточные трубы.
3. Специфическое действие на эндометрий. Прогестагены подавляют митотическую активность эндометрия, вызывая его преждевременную секреторную трансформацию. При их длительном использовании в условиях ановуляции они вызывают гипотрофию и атрофию эндометрия, что препятствует имплантации оплодотвореной яйцеклетки.
4. Снижение сократительной активности маточных труб путем снижения сократимости и порога возбудимости гладкомышечных клеток их стенок.
Одной из последних разработок стал длительно действующий (3 года) подкожный рентгеноконтрастный гормональный контрацептив с этоногестрелом — Импланон НКСТ [33, 34]. Он отличается быстрым началом действия и быстрым восстановлением фертильности после отмены, отсутствием минералкортикоидной активности. Этот препарат прост в применении, его эффективность не зависит от правильности использования, что очень важно, так как часто незапланированная беременность возникает из-за нарушения соблюдения инструкции по применению контрацептивных средств [35, 36].
В последние годы наметилась тенденция к росту числа женщин, сделавших свой выбор в пользу LARC-методов контрацепции (long-acting reversible contraception) — обратимых методов длительного действия [37, 38].
Эндометриоз
Успех лечения заболевания зависит от индивидуально подобранной медикаментозной терапии на основании молекулярно-генетической характеризации эндометриоидной ткани пациента [39]. Основные молекулярные механизмы действия гестагенов на патогенетические звенья эндометриоза заключаются в следующем: 1) блокируют гипоталамо-гипофизарно-яичниковую ось синтеза эстрогенов; 2) конкурентно связываются с рецепторами эстрогена, оказывая антиэстрогенное действие; 3) ингибируют синтез простагландина Е2; 4) ингибируют фермент ароматазу (CYP19); 5) активируют фермент HSD17B2; 6) вызывают прямое ингибирование внутриядерного фактора каппа В (NF-kB), играющего ключевую роль в процессах воспаления и неоангиогенеза; 7) оказывают непосредственное влияние на эндометриоидные очаги, вызывая дифференциацию стромальных клеток (децидуализацию) и секреторную трансформацию эпителиальных клеток эндометрия, что в конечном счете приводит к атрофии эндометрия.
В настоящее время только три гестагена рекомендованы для лечения эндометриоза — медроксипрогестерона ацетат (МПА), диеногест и дидрогестерон. Из них в России используют только диеногест для лечения эндометриоза по прямым показаниям, в других странах применяют и МПА, и дидрогестерон [16, 40, 41].
На стадии клинических исследований находится новая отечественная разработка — гестаген гестобутаноил в виде таблеток, не уступающий по эффективности зарубежному диеногесту. На экспериментальных моделях эндометриоза выявлено наличие у него двух метаболитов, один из которых — мегестрола ацетат, длительно циркулирующий в крови. Такое свойство препарата может обеспечить пролонгированность его гестагенного действия [17, 42–46].
Гиперплазия эндометрия
Гиперплазия эндометрия (ГЭ) определяется некоторыми авторами как морфологическое и биологическое изменение эндометрия в результате длительной стимуляции эстрогенами на фоне прогестероновой недостаточности [47]. ГЭ — это предраковое состояние эндометрия. Цитологическая атипия c экспрессией таких маркеров, как пируваткиназа М2, β-катехин, а также наличие участков MELF (microcystic, elongated, fragmented glands) [48–50] представляются наиболее важными факторами перерождения гиперплазии в карциному. Главной целью лечения женщин с ГЭ является не только сокращение частоты и интенсивности аномального маточного кровотечения, но и предотвращение перерождения эндометрия в опухоль. Механизм защитного действия прогестинов на эндометрий заключается в том, что они переводят эндометрий из фазы пролиферации в фазу секреции, вызывают так называемую секреторную трансформацию эндометрия. Второй механизм — антиэстрогенный, т.е. снижение митотического действия эстрогенов на эндометрий (см. рис. 2).
В России и за рубежом в качестве первой линии медикаментозной терапии рекомендован левоноргестрел в виде внутриматочной системы Мирена [51]. Левоноргестрел не уменьшает объем яичников и овариальный резерв, а также по сравнению с КОК незначительно понижает концентрацию антимюллерова гормона [52], что позволяет сохранять репродуктивную функцию молодым женщинам с ГЭ.
Так как важнейшей стратегией в лечении ГЭ является контроль потенциала малигнизации эндометрия, необходимо регулярное проведение иммуногистохимического исследования, в частности, определение таких маркеров, как PTEN, p53, β-катехин, Bcl-2, COX-2, p27, p21, MLH-1, -2 и -6, сурвивин, p16, а также экспрессии эстрогеновых и прогестероновых рецепторов (ER-α, ER-β, nPR-A, nPR-B) [53].
Рак эндометрия и рак шейки матки
Рак эндометрия (РЭ) является самым распространенным видом новообразования в гинекологии, с каждым годом он выявляется все чаще [54]. Протективным, профилактическим фактором, снижающим риск развития РЭ, считается использование КОК, причем остаточный защитный эффект сохраняется до 30 лет после прекращения приема препарата [55].
В качестве первой линии медикаментозной терапии РЭ используют классические цитостатики — доксорубицин, цисплатин, паклитаксел и другие, в качестве гормонотерапии — МПА, мегестрола ацетат, тамоксифен [56]. Лечение прогестинами достаточно эффективно: частота ответа составляет от 11 до 56% в зависимости от типа РЭ (наибольшая эффективность достигается при типе I РЭ — эндометриоидном). Таргетная терапия РЭ не дает хороших результатов: как свидетельствует анализ проведенных клинических исследований, частота ответов не превышает 33% с применением различных препаратов [54].
Данные клинических исследований неоднократно подтверждали эффективность МПА в терапии РЭ, особенно в качестве неоадъювантной терапии [57–59]. МПА активирует эстрогеновый стресс, блокирует передачу сигнала с эстрогенового рецептора за счет связывания с nPR-B и увеличивает экспрессию энхансерного белка CHOP, что может быть одним из молекулярных механизмов, лежащих в основе противоопухолевого действия MPA при РЭ. В клетках, содержащих nPR-B (nPR-B+), длинная некодирующая РНК (long noncoding RNAs — lncRNAs) Inc-CETP-3 вовлечена в этот процесс. Недавно были идентифицированы дифференциально экспрессируемые мРНК и lncRNAs, участвующие в сигнальных каскадах канцерогенеза, которые могут стать мишенью для противоопухолевых препаратов и, в частности, гестагенов [60].
Оптимальным режимом применения гестагенов при РЭ является ежедневный пероральный прием 200–400 мг МПА (Провера) или 160 мг мегестрола ацетата (Мегейс). Эффект прогестинотерапии начинает проявляться не ранее чем через 8–12 нед после начала приема препарата [61].
Применение гестагенов при раке молочной железы и раке шейки матки (РШМ) ограничено — накоплено недостаточно сведений об их влиянии на эти типы рака. Промежуточные результаты крупного (1000 пациенток) клинического исследования «Primary Progesterone Therapy for Operable Breast Cancer («Первичная терапия прогестероном при операбельном раке молочной железы») свидетельствуют, что терапия прогестероном значительно увеличивает безрецидивную продолжительность жизни пациенток с поражением лимфатических узлов, но не влияет на этот параметр у пациенток с первичным раком молочной железы без поражения лимфатических узлов [62].
Несмотря на то, что гидроксипрогестерона капроат имеет показания для лечения РШМ, согласно МКБ-10 C53 «Злокачественное новообразование шейки матки», в настоящее время в РФ гормональная терапия не входит в практические рекомендации по лечению этого заболевания [63]. Не используют также гормональную терапию и европейские сообщества онкологов [64]. И только при железистых формах РШМ рекомендуется 0,25% раствор оксипрогестерона капроната (17-ОПК) по индивидуальной схеме.
Механизм цитотоксического действия прогестерона (и его аналогов) заключается в индукции митохондриального апоптоза и блокировке перехода клеточного цикла от фазы G1 к S [65]. В прямом цитотоксическом действии прогестерона доказана роль регуляции экспрессии и активности рецепторатранзиторного катионного канала TRPM7 (transient receptor potential melastatin-subfamily member 7), который осуществляет запуск ацидотоксического некроза в клетках РШМ. Прогестерон подавляет экспрессию TRPM7, тем самым переключая ацидотоксический некроз опухолевых клеток на апоптоз [66]. В ряде исследований на клетках HeLa продемонстрировано цитотоксическое действие не только прогестерона, но и его синтетических производных, причем цитотоксический эффект наблюдается как при стимуляции эстрадиолом, так и без стимуляции [67, 68].
Перспективы применения гестагенов при РЭ связаны с совершенствованием режимов приема с учетом индивидуального статуса пациентки, а также с добавлением в схемы лечения других препаратов, в частности метформина. Противоопухолевый механизм действия метформина точно не известен, но он, очевидно, связан с сигнальным путем mTOR. Метформин — это бигуанид, широко используемый в лечении сахарного диабета 2-го типа. Анализ нескольких недавних эпидемиологических исследований [19, 69, 70] показал, что метформин снижает риск развития рака и смертность от него при гиперплазии и карциноме эндометрия у больных диабетом.
Так как частота возникновения РЭ у молодых пациенток часто коррелирует с ожирением, резистентностью к инсулину и нарушением метаболизма глюкозы (84, 83 и 78% соответственно), эти провоцирующие факторы являются многообещающей мишенью для лечения и профилактики данного заболевания метформином [71–73].
Гормонозаместительная терапия
Роль гестагенов в ГЗТ заключается преимущественно в защите эндометрия от опухолевого перерождения, антиминералкортикоидном действии, предотвращении остеопороза, снятии психоэмоциональных и вазомоторных симптомов [74].
Экспертом в области клинических исследований прогестерона при ГЗТ является профессор Jerilynn C. Prior из университета Британской Колумбии (Ванкувер, Канада). Она обнаружила, что прогестерон в составе ГЗТ эффективно снижает вазомоторные симптомы у женщин в перименопаузе, предотвращает остеопороз, способствуют нормализации сна, устранению чувства тревоги [75]. Показано положительное действие прогестерона на физиологические функции, психоэмоциональное состояние и продолжительность жизни даже у трансгендерных женщин [76].
Также прогестины эффективны в лечении вторичной аменореи: препаратом выбора является вагинальный прогестерон — гель Крайнон [77].
Вспомогательные репродуктивные технологии
В современной медицине ВРТ используют все чаще. Протоколы экстракорпорального оплодотворения (ЭКО), искусственной инсеминации, криопереноса эмбрионов постоянно совершенствуются, о чем свидетельствует целый ряд инициированных и завершенных клинических исследований [78, 79].
Большинство циклов ВРТ сопровождается формированием недостаточности лютеиновой фазы цикла, особенно при проведении стимуляции суперовуляции или программы криопереноса эмбрионов, что требует гестагенной терапии, поэтому препараты гестагенов широко применяют у женщин с бесплодием при использовании ВРТ [80]. Прогестерон снижает уровень ER-α, увеличивает экспрессию рецепторов прогестерона, повышая тем самым чувствительность эндометрия к прогестерону и рецептивность слизистой оболочки матки. В противоположность пролиферативному эффекту эстрогена действие прогестерона способствует дифференцировке ткани эндометрия с инактивацией эстрадиола через стромальные прогестероновые рецепторы, появлению и созреванию пиноподий, обеспечивает подготовку эндометрия к имплантации эмбриона [81]. Прогестины увеличивают не только рецептивность эндометрия, но и его толщину, что является важным фактором, обеспечивающим успешную имплантацию эмбриона [82, 83].
Таким образом, ВРТ — относительно новая нозологическая группа для клинического применения гестагенов и их эффективность для повышения рождаемости не вызывает сомнений.
Неклассические фармакологические эффекты прогестинов — платформа для новых клинических испытаний
Перспективы клинического применения гестагенов обусловлены обнаружением новых мишеней действия прогестерона на иммунную, сердечно-сосудистую систему, ЦНС, а также специфическим, уникальным действием на метаболизм лекарственных средств, включающим как системы цитохромов, так и ферменты и белки лекарственной устойчивости, такие как Р-гликопротеин, BCRP-белок, MRP-белки и другие.
Иммуномодулирующее действие прогестинов прежде всего связано с подавлением избыточного иммунного ответа: ингибированием активации и пролиферации лимфоцитов в ответ на митогенные и иммунные стимулы, что играет важную роль в сохранении плода, так как цитокин-опосредованные иммунологические реакции являются причиной 40–60% всех случаев идиопатических повторных спонтанных выкидышей.
В последние годы выявлено, что материнская иммунная толерантность к плоду является ключевым фактором, способствующим его развитию. Успешно прогрессирующая беременность сопровождается подавлением активности Т-хелперов 1-го типа (Th1) и усилением активности Th2. Так, у женщин со спонтанным повторным выкидышем отмечено повышение уровня Th1-цитокинов, IL-2 и интерферона-γ и понижение уровня Th2-цитокинов и IL-10 [84].
Специфическое ингибирование прогестероном экспрессии цитокинов и хемокинов IL-6, IL-8, CCL2, CXCL1, CXCL2 в эндотелиальных клетках свидетельствует о том, что прогестины являются противовоспалительными агентами в эндотелии с потенциалом подавления транспорта иммунных клеток в ткани [85]. Противовоспалительный эффект прогестерона подтвержден в исследовании J.W. VanLandingham с соавт.: прогестерон стимулирует экспрессию мембранного белка CD55 в мозге крыс — мощного ингибитора конвертаз системы комплемента, в результате чего тормозится воспалительный каскад [86].
Специфическое регулирование прогестероном синтеза цитокинов может оказаться решающим в борьбе с цитокиновым штормом при сепсисе и вирусных заболеваниях, таких как COVID-19. Одной из основных причин гибели пациентов, инфицированных коронавирусом SARS-CoV-2, является развитие избыточного иммунного ответа — цитокинового шторма, который приводит к тяжелым повреждениям жизненно важных органов. Фармакологическая коррекция цитокинового шторма при тяжелых формах COVID-19 позволит сохранить жизни инфицированных и добиться стабилизации и улучшения состояния пациентов.
Среди препаратов, предлагаемых для фармакологической коррекции цитокинового шторма при заражении SARS-CoV-2, называют глюкокортикоиды, известные своей выраженной противовоспалительной активностью. Однако одновременно их сильное иммунодепрессивное действие может ограничивать возможности применения глюкокортикоидов [87]. Другие используемые для этой цели препараты (противомалярийное средство гидроксихлорихинон и противоопухолевый цитостатик этопозид) также имеют серьезные побочные токсические эффекты [88, 89].
В связи с этим представляется целесообразным оценить возможность производных гестагенов (они хорошо переносятся и действуют как избирательные иммуномодуляторы) для иммунной коррекции цитокинового шторма. Показано, что некоторые производные прогестерона обладают выраженной противовоспалительной и иммуномодулирующей активностью благодаря уникальному действию, связанному с блокированием протонной помпы митохондрий, регуляцией внутриклеточного рН, активности лизосомальных ферментов, toll-подобных рецепторов иммунных клеток и других [90–92].
Нейропротекторное действие прогестинов. Прогестерон также синтезируется в нейронах и глиальных клетках и является нейростероидом. Метаболиты прогестерона — 5α-дигидропрогестерон и 3α,5α-тетрагидропрогестерон (аллопрегнанолон) — оказывают нейропротекторное действие при черепно-мозговых травмах; травмах спинного мозга; при ишемических повреждениях головного и спинного мозга; при нейродегенеративных болезнях, включая атеросклероз сосудов головного мозга, болезни Паркинсона и Альцгеймера. Прогестерон снижает отек мозга, воспаление, прооксидантную активность метаболитов, восстанавливает мембранный потенциал митохондрий, регулирует белки гемостаза и способствует выживанию новообразованных нейронов, участвуют в созревании и миелировании нейронов. Аллопрегнанолон является позитивным аллостерическим модулятором GABAA-рецепторов (рецепторов гамма-аминомасляной кислоты, представляющих из себя каналы ионов хлора). В результате на многие функции в мозге прогестерон и аллопрегнанолон действуют синергично через прогестиновые и GABAA-рецепторы [93].
В ЦНС человека обнаружены все пять типов мембранных рецепторов с некоторыми различиями в уровне их экспрессии и распределении, а также MAPR — PGRMC1, PGRMC2, неудезин и неуферрицин. Их функции до конца не определены, но есть сведения, что они участвуют в синтезе и переносе гема, подавлении индуцированной клеточной гибели и процессов апоптоза в клетках [9].
Другими важными функциями прогестерона в ЦНС являются модуляция активности нейронов, секретирующих гонадотропин-рилизинг фактор, регуляция секреции лютеинизирующего гормона, а также регуляция обмена моноаминов — дофамина и серотонина [94].
Влияние гестагенов на канцерогенез связано с пролиферацией, апоптозом и эпителиально-мезенхимальным переходом в опухолевых клетках РЭ, рака молочной железы, РШМ. Основные механизмы противоопухолевого действия гестагенов обусловлены снижением прогестероновых рецепторов nPR-A и эстрогеновых ER-β, индукцией апоптоза за счет стимуляции продукции активных форм кислорода в высоких дозах [95]. Мегестрола ацетат и МПА в высоких дозах также оказывают прямое рецептор-опосредованное цитотоксическое действие на опухолевые клетки, в низких дозах — снижают секрецию и образование эстрогенов, уменьшают выработку гормонов роста, увеличивают продукцию факторов некроза опухоли. Индукция прогестероном компонентов системы Fas/FasL повышает чувствительность клеток-мишеней к апоптотическим сигналам. Прогестерон может выступать в роли регулятора альтернативного сплайсинга гена рецептора фактора роста TGF-β. Кроме того, прогестины регулируют активность ферментов клеток-мишеней, задействованных в процессах проведения сигнала гибели клеток, модулируя ответ клетки на апоптотический сигнал [96].
Прогестерон и его синтетические аналоги могут запускать митохондриальный путь апоптоза. Падение мембранного потенциала митохондрий приводит к образованию активных форм кислорода и высвобождению апоптогенных факторов (выход цитохорома С и активация каспаз), служащих сигналом для активации финальной (эффекторной) стадии апоптоза. Существующие модели митохондриальной реализации программы апоптоза учитывают действие семейства регуляторных белков Bcl-2, которые самостоятельно или с помощью других белков митохондрий (переносчиков аденилового нуклеотида ANT, потенциал-зависимых анионных каналов VDAC) нарушают гомеостаз митохондрий [95]. Установлено наличие у стероидных гормонов, в частности у прогестерона, внегеномных эффектов, затрагивающих направленные на реализацию апоптоза процессы в митохондриях за счет влияния на ионные потоки Ca2+ и К+, с одной стороны, и экспрессию митохондриальных факторов апоптоза (семейство Bcl-2) — с другой [97]. Последние полученные нами данные свидетельствуют о существовании мембранных рецепторов прогестерона, локализация которых, в том числе на мембране митохондрий, может определять влияние гестагенов на транскрипцию митохондриальных генов и метаболические процессы в митохондриях [98].
Прогестерон участвует в регуляции четырех основных сигнальных путей канцерогенеза: PI3K/AKT, Ras/Raf/MEK/ERK, WNT/β-катенина и VEGF. Путь PI3K/AKT активирует эпителиально-мезенхимальный переход (ЭМХ), опосредованный трансформирующим фактором роста бета (TGF-β). Прогестерон блокирует ЭМХ, в том числе благодаря ингибирующему действию на TGF-β. In vitro прогестерон блокирует передачу сигналов TGF-β через 72 ч после обработки клеток рака эндометрия Ishikawa, а также эффективно подавляет жизнеспособность и инвазию раковых клеток эндометрия при повышенной экспрессии Е-кадгерина [99].
Помимо блокады ЭМХ, прогестерон стимулирует иммунную защиту, повышая продукцию опухолевых инфильтрирующих лимфоцитов (TIL — tumour infiltrating lymphocyte) [100]. Кроме того, в противоопухолевом эффекте прогестерона играет роль его регуляторное действие на так называемую длинную некодирующую РНК — NEAT1/microRNA-146b-5p, которая опосредует Wnt/β-катенин сигнальный путь [101]. Показано, что после инкубации с 20 мкМ прогестерона в клетках рака эндометрия Ishikawa значительно снижается уровень экспрессии генов NEAT1, miR-146b-5p, LEF1, c-myc и MMP9 сигнального пути Wnt/β-катенина и клеточный цикл клеток тормозится в фазе G0/G1 [101].
Другой аспект возможного клинического применения гестагенов в онкологии — использование их в качестве химиосенсибилизаторов опухолевых клеток, т.е. соединений, повышающих чувствительность опухолевых клеток к химиотерапии. Как известно, существенным ограничением эффективности противоопухолевой терапии является возникновение устойчивости опухолевых клеток к применяемым препаратам — феномен множественной лекарственной устойчивости (МЛУ) [102]. МЛУ обусловлена гиперэкспрессией Р-гликопротеина, МРП-белков (MRP — multydrug resistance proteins), BCRP-белка (breast cancer resistance protein) и других трансмембранных транспортеров.
За последние четыре десятилетия синтезированы ингибиторы Р-гликопротеина 1–4-го поколений, однако все эти соединения в клинических испытаниях показали недостаточную эффективность и высокую токсичность [103, 104].
Эффективным модулятором МЛУ является прогестерон, так как большинство вышеуказанных белков-транспортеров имеют специфический сайт связывания прогестерона [102]. Известно, что прогестерон регулирует как экспрессию мРНК Р-гликопротеина, так и уровень его белка [105] и снижает BCRP-опосредованную МЛУ путем подавления экспрессии BCRP в клетках рака молочной железы, угнетая транскрипцию за счет связывания с прогестероновым промоутером в гене, кодирующим BCRP [106]. В нашей работе было показано, что помимо собственной цитостатической активности на опухолевые клетки гестагены МПА, прогестерон, гестаген гестобутаноил проявляют химиосенсибилизирующую активность, увеличивая цитотоксическое действие цисплатина и этопозида на 20–50%, и, следовательно, могут применяться совместно с цитостатиками на первых этапах химиотерапии [102].
Так как одним из факторов развития МЛУ является активация сигнального пути Wnt/β-катенина [107–109], ингибирующее влияние прогестерона на данный сигнальный путь также может быть перспективным аспектом клинического применения прогестинов как химиосенсибилизаторов.
Заключение
Клиническое применение гестагенов затрагивает несколько областей — акушерство и гинекологию, онкологию, их используют в процедурах ВРТ, при кахексии и анорексии у раковых больных и больных СПИДом.
Открытие мембранных, митохондриальных, а также мембранассоциированных рецепторов прогестерона, а также углубленное изучение механизмов их действия в сигнальных путях способствуют получению новых знаний о реализации фармакологических эффектов прогестинов. С учетом новых сведений о регуляции прогестероном МЛУ открывается возможность применения прогестинов как химиосенсибилизаторов в противоопухолевой терапии и в качестве кардио-, нейро- и гепатопротекторов. Данные о регуляции прогестероном иммунной системы (иммунодепрессивное действие) могут способствовать расширению показаний для назначения прогестинов, в частности для борьбы с вирусными и аутоиммунными заболеваниями.
Роль прогестерона в организме трудно переоценить, так как данный половой гормон способствует нормальному развитию беременности — важнейшему физиологическому процессу в биологии.
Финансирование исследования. Работа поддержана грантом Российского фонда фундаментальных исследований №19-015-00195.
Конфликт интересов отсутствует.
Литература
- Casado-Espada N.M., de Alarcón R., de la Iglesia-Larrad J.I., Bote-Bonaechea B., Montejo Á.L. Hormonal contraceptives, female sexual dysfunction, and managing strategies: a review. J Clin Med 2019; 8(6): 908, https://doi.org/10.3390/jcm8060908.
- Piette P. The history of natural progesterone, the never-ending story. Climacteric 2018; 21(4), https://doi.org/10.1080/13697137.2018.1462792.
- Carp H.J.A. Progestogens in luteal support. Horm Mol Biol Clin Investig 2020; 21(4): 380–384, https://doi.org/10.1515/hmbci-2019-0067.
- Garcia J.M., Shamliyan T.A. Off-label megestrol in patients with anorexia-cachexia syndrome associated with malignancy and its treatments. Am J Med 2018; 131(6): 623–629.e1, https://doi.org/10.1016/j.amjmed.2017.12.028.
- Карева Е.Н., Булгакова В.А., Гуторова Д.С., Олейникова О.М., Кононова И.Н., Горбунов А.А., Бреусенко В.Г., Фисенко В.П. Мембранный рецептор прогестерона PGRMC1 — потенциальная мишень лекарственных средств. Экспериментальная и клиническая фармакология 2020; 83(6): 19–29, https://doi.org/10.30906/0869-2092-2020-83-6-19-29.
- Pedroza D.A., Subramani R., Lakshmanaswamy R. Classical and non-classical progesterone signaling in breast cancers. Cancers (Basel) 2020; 12(9): 2440, https://doi.org/10.3390/cancers12092440.
- Petersen S.L., Intlekofer K.A., Moura-Conlon P.J., Brewer D.N., Del Pino Sans J., Lopez J.A. Novel progesterone receptors: neural localization and possible functions. Front Neurosci 2013; 7: 164, https://doi.org/10.3389/fnins.2013.00164.
- Pang Y., Dong J., Thomas P. Characterization, neurosteroid binding and brain distribution of human membrane progesterone receptors δ and ε (mPRδ and mPRε) and mPRδ involvement in neurosteroid inhibition of apoptosis. Endocrinology 2013; 154(1): 283–295, https://doi.org/10.1210/en.2012-1772.
- Ryu C.S., Klein K., Zanger U.M. Membrane associated progesterone receptors: promiscuous proteins with pleiotropic functions — focus on interactions with cytochromes P450. Front Pharmacol 2017; 8: 159, https://doi.org/10.3389/fphar.2017.00159.
- Thejer B.M., Adhikary P.P., Kaur A., Teakel S.L., Van Oosterum A., Seth I., Pajic M., Hannan K.M., Pavy M., Poh P., Jazayeri J.A., Zaw T., Pascovici D., Ludescher M., Pawlak M., Cassano J.C., Turnbull L., Jazayeri M., James A.C., Coorey C.P., Roberts T.L., Kinder S.J., Hannan R.D., Patrick E., Molloy M.P., New E.J., Fehm T.N., Neubauer H., Goldys E.M., Weston L.A., Cahill M.A. PGRMC1 phosphorylation affects cell shape, motility, glycolysis, mitochondrial form and function, and tumor growth. BMC Mol and Cell Biol 2020; 21(1): 24, https://doi.org/10.1186/s12860-020-00256-3.
- Idkowiak J., Randell T., Dhir V., Patel P., Shackleton C.H., Taylor N.F., Krone N., Arlt W. A missense mutation in the human cytochrome b5 gene causes 46,XY disorder of sex development due to true isolated 17,20 lyase deficiency. J Clin Endocrinol Metab 2012; 97(3): E465–E475, https://doi.org/10.1210/jc.2011-2413.
- Price T., Dai Q. The role of a mitochondrial progesterone receptor (PR-M) in progesterone action. Semin Reprod Med 2015; 33(3): 185–194, https://doi.org/10.1055/s-0035-1552583.
- Ren J., Chung-Davidson Y.W., Jia L., Li W. Genomic sequence analyses of classical and non-classical lamprey progesterone receptor genes and the inference of homologous gene evolution in metazoans. BMC Evol Biol 2019; 19(1): 136, https://doi.org/10.1186/s12862-019-1463-7.
- Africander D., Verhoog N., Hapgood J.P. Molecular mechanisms of steroid receptor-mediated actions by synthetic progestins used in HRT and contraception. Steroids 2011, 76(7): 636–652, https://doi.org/10.1016/j.steroids.2011.03.001.
- Сметник А.А. Контрацепция с дроспиреноном: влияние на массу тела и некоторые показатели метаболизма липидов. Медицинский совет 2016; 12: 95–97, https://doi.org/10.21518/2079-701x-2016-12-95-97.
- Федотчева Т.А., Шимановский Н.Л. Роль гестагенов в лечении эндометриоза. Проблемы эндокринологии 2018; 64(1): 54–61, https://doi.org/10.14341/probl201864154-61.
- Stepanova E.S., Makarenkova L.M., Chistyakov V.V., Fedotcheva T.A., Parshin V.A., Shimanovsky N.L. Metabolism of gestobutanoil, a novel drug of progestin group. Sovremennye tehnologii v medicine 2019; 11(3): 48–54, https://doi.org/10.17691/stm2019.11.3.06.
- Trojano G., Olivieri C., Tinelli R., Damiani G.R., Pellegrino A., Cicinelli E. Conservative treatment in early stage endometrial cancer: a review. Acta Biomed 2019; 90(4): 405–410, https://doi.org/10.23750/abm.v90i4.7800.
- Mitsuhashi A., Kawasaki Y., Hori M., Fujiwara T., Hanaoka H., Shozu M. Medroxyprogesterone acetate plus metformin for fertility-sparing treatment of atypical endometrial hyperplasia and endometrial carcinoma: trial protocol for a prospective, randomised, open, blinded-endpoint design, dose-response trial (FELICIA trial). BMJ Open 2020; 10(2): e035416, https://doi.org/10.1136/bmjopen-2019-035416.
- Mitsuhashi A., Habu Y., Kobayashi T., Kawarai Y., Ishikawa H., Usui H., Shozu M. Long-term outcomes of progestin plus metformin as a fertility-sparing treatment for atypical endometrial hyperplasia and endometrial cancer patients. J Gynecol Oncol 2019; 30(6): e90, https://doi.org/10.3802/jgo.2019.30.e90.
- Stepan J.J., Hruskova H., Kverka M. Update on menopausal hormone therapy for fracture prevention. Curr Osteoporos Rep 2019; 17(6): 465–473, https://doi.org/10.1007/s11914-019-00549-3.
- Ruiz-García V., López-Briz E., Carbonell-Sanchis R., Bort-Martí S., Gonzálvez-Perales J.L. Megestrol acetate for cachexia-anorexia syndrome. A systematic review. J Cachexia Sarcopenia Muscle 2018; 9(3): 444–452, https://doi.org/10.1002/jcsm.12292.
- Tuca A., Jimenez-Fonseca P., Gascón P. Clinical evaluation and optimal management of cancer cachexia. Crit Rev Oncol Hematol 2013; 88(3): 625–636, https://doi.org/10.1016/j.critrevonc.2013.07.015.
- Yang H.C., Liu J.C., Liu F.S. Fertility-preserving treatment of stage IA, well-differentiated endometrial carcinoma in young women with hysteroscopic resection and high-dose progesterone therapy. Taiwan J Obstet Gynecol 2019; 58(1): 90–93, https://doi.org/10.1016/j.tjog.2018.11.017.
- Di Renzo G.C., Giardina I., Clerici G., Brillo E., Gerli S. Progesterone in normal and pathological pregnancy. Horm Mol Biol Clin Investig 2016; 27(1): 35–48, https://doi.org/10.1515/hmbci-2016-0038.
- Wang X., Luo Q., Bai W. Efficacy of progesterone on threatened miscarriage: difference in drug types. J Obstet Gynaecol Res 2019; 45(4): 794–802, https://doi.org/10.1111/jog.13909.
- Abdelhakim A.M., Abd-ElGawad M., Hussein R.S., Abbas A.M. Vaginal versus intramuscular progesterone for luteal phase support in assisted reproductive techniques: a systematic review and meta-analysis of randomized controlled trials. Gynecol Endocrinol 2020; 36(5): 389–397, https://doi.org/10.1080/09513590.2020.1727879.
- Coomarasamy A., Devall A.J., Brosens J.J., Quenby S., Stephenson M.D., Sierra S., Christiansen O.B., Small R., Brewin J., Roberts T.E., Dhillon-Smith R., Harb H., Noordali H., Papadopoulou A., Eapen A., Prior M., Di Renzo G.C., Hinshaw K., Mol B.W., Lumsden M.A., Khalaf Y., Shennan A., Goddijn M., van Wely M., Al-Memar M., Bennett P., Bourne T., Rai R., Regan L., Gallos I.D. Micronized vaginal progesterone to prevent miscarriage: a critical evaluation of randomized evidence. Am J Obstet Gynecol 2020; 223(2): 167–176, https://doi.org/10.1016/j.ajog.2019.12.006.
- Lee H.J., Park T.C., Kim J.H., Norwitz E., Lee B. The influence of oral dydrogesterone and vaginal progesterone on threatened abortion: a systematic review and meta-analysis. Biomed Res Int 2017; 2017: 3616875, https://doi.org/10.1155/2017/3616875.
- Coomarasamy A., Devall A.J., Cheed V., Harb H., Middleton L.J., Gallos I.D., Williams H., Eapen A.K., Roberts T., Ogwulu C.C., Goranitis I., Daniels J.P., Ahmed A., Bender-Atik R., Bhatia K., Bottomley C., Brewin J., Choudhary M., Crosfill F., Deb S., Duncan W.C., Ewer A., Hinshaw K., Holland T., Izzat F., Johns J., Kriedt K., Lumsden M.A., Manda P., Norman J.E., Nunes N., Overton C.E., Quenby S., Rao S., Ross J., Shahid A., Underwood M., Vaithilingam N., Watkins L., Wykes C., Horne A., Jurkovic D. A randomized trial of progesterone in women with bleeding in early pregnancy. N Engl J Med 2019; 380(19): 1815–1824, https://doi.org/10.1056/nejmoa1813730.
- Egarter C. Progestogen-only pills: which progestogen would be ideal. Horm Mol Biol Clin Investig 2020, https://doi.org/10.1515/hmbci-2019-0042.
- Шимановский Н.Л., Свистунов А.А., Наполов Ю.К. Новые достижения в гормональной контрацепции. М; 2013.
- Chen M.J., Hsia J.K., Creinin M.D. Etonogestrel implant use in women primarily choosing a combined oral contraceptive pill: a proof-of-concept trial. Contraception 2018; 97(6): 533–537, https://doi.org/10.1016/j.contraception.2018.02.009.
- Floyd J.L., Beasley A.D., Swaim L.S., Turrentine M.A., Nijjar J.B. Association of immediate postpartum etonogestrel implant insertion and venous thromboembolism. Obstet Gynecol 2020; 135(6): 1275–1280, https://doi.org/10.1097/aog.0000000000003760.
- Louw-du Toit R., Hapgood J.P., Africander D. A direct comparison of the transcriptional activities of progestins used in contraception and menopausal hormone therapy via the mineralocorticoid receptor. Biochem Biophys Res Commun 2020; 526(2): 466–471, https://doi.org/10.1016/j.bbrc.2020.03.100.
- Secura G.M., Allsworth J.E., Madden T., Mullersman J.L., Peipert J.F. The Contraceptive CHOICE Project: reducing barriers to long-acting reversible contraception. Am J Obstet Gynecol 2010; 203(2): 115.e1–115.e1157, https://doi.org/10.1016/j.ajog.2010.04.017.
- Bahar Y.Z., Gold M.A. Providing long-acting reversible contraception to adolescents: a review. Clin Obstet Gynecol 2020; 63(3): 561–573, https://doi.org/10.1097/grf.0000000000000541.
- Festin M.P.R. Overview of modern contraception. Best Pract Res Clin Obstet Gynaecol 2020; 66: 4–14, https://doi.org/10.1016/j.bpobgyn.2020.03.004.
- Savilova A.M., Yushina M.N., Rudimova Y.V., Khabas G.N., Chuprynin V.D., Sukhikh G.T. Characteristics of multipotent mesenchymal stromal cells isolated from human endometrium and endometriosis lesions. Bull Exp Biol Med 2016; 161(4): 610–615, https://doi.org/10.1007/s10517-016-3469-0.
- Guo H., Li J., Shen X., Cong Y., Wang Y., Wu L., Li B., Gao H., Ma M., Zhang W., Mao X., Fu Y., Lyu Q., Chai W., Kuang Y. Efficacy of different progestins in women with advanced endometriosis undergoing controlled ovarian hyperstimulation for in vitro fertilization — a single-center non-inferiority randomized controlled trial. Front Endocrinol (Lausanne) 2020; 11: 129, https://doi.org/10.3389/fendo.2020.00129.
- Dianat S., Fox E., Ahrens K.A., Upadhyay U.D., Zlidar V.M., Gallo M.F., Stidd R.L., Moskosky S., Dehlendorf C. Side effects and health benefits of depot medroxyprogesterone acetate: a systematic review. Obstet Gynecol 2019; 133(2): 332–341, https://doi.org/10.1097/aog.0000000000003089.
- Шимановский Н.Л., Федотчева Т.А., Семейкин А.В., Паршин В.А., Шеина Н.И., Скрябина Э.Г. Пероральная форма гестаген-содержащей композиции для лечения женщин с состояниями гестагенной недостаточности и способ ее получения. Патент РФ 2684917. 2019.
- Шеина Н.И., Паршин В.А., Федотчева Т.А., Шимановский Н.Л. Влияние нового лекарственного средства стероидной структуры гестобутаноил для гормональной заместительной терапии гестагенной недостаточности на развитие плода и потомства в эксперименте на крысах. Токсикологический вестник 2019; 2: 28–36, https://doi.org/10.36946/0869-7922-2019-2-28-36.
- Шеина Н.И., Паршин В.А., Колесникова В.В., Мялина Л.И., Сазонова Л.П., Федотчева Т.А., Шимановский Н.Л. Оценка генеративной функции самок крыс при внутрижелудочном введении таблетированного стероида Гестобутаноила с гестагенной активностью. Химико-фармацевтический журнал 2020; 54(5): 11–15, https://doi.org/10.30906/0023-1134-2020-54-5-11-15.
- Шеина Н.И., Паршин В.А., Рыбаков Ю.Л., Гукасов В.М., Костяева М.Г., Семейкин А.В., Самойликов Р.В., Федотчева Т.А., Шимановский Н.Л. Оценка токсичности нового гестагена Гестобутаноила в эксперименте на крысах и мышах. Экспериментальная и клиническая фармакология 2018; 81(11): 18–25, https://doi.org/10.30906/0869-2092-2018-81-11-18-25.
- Петросян М.А., Балашова Н.Н., Полянских Л.С., Базиян Е.В., Траль Т.Г., Фасахутдинова Л.Х., Разыграев А.В., Сапронов Н.С. Влияние аналогов прогестерона на эндометриоидные гетеротопии в экспериментальной модели эндометриоза. Экспериментальная и клиническая фармакология 2018; 81(7): 14–19, https://doi.org/10.30906/0869-2092-2018-81-7-14-19.
- Lee S.Y., Kim M.K., Park H., Yoon B.S., Seong S.J., Kang J.H., Jun H.S., Park C.T. The effectiveness of levonorgestrel releasing intrauterine system in the treatment of endometrial hyperplasia in Korean women. J Gynecol Oncol 2010; 21(2): 102–105, https://doi.org/10.3802/jgo.2010.21.2.102.
- Lai Y.J., Chou Y.C., Lin Y.J., Yu M.H., Ou Y.C., Chu P.W., Wu C.C., Wang Y.C., Chao T.K. Pyruvate kinase M2 expression: a potential metabolic biomarker to differentiate endometrial precancer and cancer that is associated with poor outcomes in endometrial carcinoma. Int J Environ Res Public Health 2019; 16(23): 4589, https://doi.org/10.3390/ijerph16234589.
- Travaglino A., Raffone A., Saccone G., Mascolo M., D’Alessandro P., Arduino B., Mollo A., Insabato L., Zullo F. Nuclear expression of β-catenin in endometrial hyperplasia as marker of premalignancy. APMIS 2019; 127(11): 699–709, https://doi.org/10.1111/apm.12988.
- Zaino R.J. Unusual patterns of endometrial carcinoma including MELF and its relation to epithelial mesenchymal transition. Int J Gynecol Pathol 2014; 33(4): 357–364, https://doi.org/10.1097/pgp.0000000000000137.
- Gallos I.D., Alazzam M., Clark T. Endometrial hyperplasia, management of (green-top guideline No. 67). Royal College of Obstetricians and Gynaecologists; 2016; URL: https://www.rcog.org.uk/en/guidelines- research-services/guidelines/gtg67/.
- Landersoe S.K., Forman J.L., Birch Petersen K., Larsen E.C., Nøhr B., Hvidman H.W., Nielsen H.S., Nyboe Andersen A. Ovarian reserve markers in women using various hormonal contraceptives. Eur J Contracept Reprod Health Care 2020; 25(1): 65–71, https://doi.org/10.1080/13625187.2019.1702158.
- Коренная В.В., Масс Е.Е., Колода Ю.А., Полетова Т.Н. Гиперпластические процессы эндометрия: новый взгляд на проблему. Эффективная фармакотерапия 2018; 3: 34–39.
- Morice P., Leary A., Creutzberg C., Abu-Rustum N., Darai E. Endometrial cancer. Lancet 2016; 387(10023): 1094–1108, https://doi.org/10.1016/s0140-6736(15)00130-0.
- Gompel A. Progesterone, progestins and the endometrium in perimenopause and in menopausal hormone therapy. Climacteric 2018; 21(4): 321–325, https://doi.org/10.1080/13697137.2018.1446932.
- Нечушкина В.М., Деньгина Н.В., Коломиец Л.А., Кравец О.А., Морхов К.Ю., Новикова Е.Г., Тюляндина А.С., Ульрих Е.А., Феденко А.А., Хохлова С.В. Практические рекомендации по лекарственному лечению рака тела матки и сарком матки. Злокачественные опухоли 2017; 7(3-S2): 168–180.
- Tamauchi S., Kajiyama H., Utsumi F., Suzuki S., Niimi K., Sakata J., Mizuno M., Shibata K., Kikkawa F. Efficacy of medroxyprogesterone acetate treatment and retreatment for atypical endometrial hyperplasia and endometrial cancer. J Obstet Gynaecol Res 2018; 44(1): 151–156, https://doi.org/10.1111/jog.13473.
- Yamagami W., Susumu N., Makabe T., Sakai K., Nomura H., Kataoka F., Hirasawa A., Banno K., Aoki D. Is repeated high-dose medroxyprogesterone acetate (MPA) therapy permissible for patients with early stage endometrial cancer or atypical endometrial hyperplasia who desire preserving fertility? J Gynecol Oncol 2018; 29(2): e21, https://doi.org/10.3802/jgo.2018.29.e21.
- Kim J.J., Kurita T., Bulun S.E. Progesterone action in endometrial cancer, endometriosis, uterine fibroids, and breast cancer. Endocr Rev 2013; 34(1): 130–162, https://doi.org/10.1210/er.2012-1043.
- Cao W., Gao W., Zheng P., Sun X., Wang L. Medroxyprogesterone acetate causes the alterations of endoplasmic reticulum related mRNAs and lncRNAs in endometrial cancer cells. BMC Med Genomics 2019; 12(1): 163, https://doi.org/10.1186/s12920-019-0601-9.
- Урманчеева А.Ф. Лекарственная терапия рака эндометрия. Практическая онкология 2004; 5(1): 41–51.
- Badwe R., Hawaldar R., Parmar V., Nadkarni M., Shet T., Desai S., Gupta S., Jalali R., Vanmali V., Dikshit R., Mittra I. Single-injection depot progesterone before surgery and survival in women with operable breast cancer: a randomized controlled trial. J Clin Oncol 2011; 29(21): 2845–2851, https://doi.org/10.1200/jco.2010.33.0738.
- Хохлова С.В., Деньгина Н.В., Коломиец Л.А., Кравец О.А., Морхов К.Ю., Нечушкина В.М., Новикова Е.Г., Тюляндина А.С., Урманчеева А.Ф. Практические рекомендации по лекарственному лечению рака шейки матки. Злокачественные опухоли 2017; 7(3-S2): 158–167.
- Ульрих Е.А., Берлев И.В., Урманчеева А.Ф., Вербитская Е.А., Микая Н.А., Михайлов А.В., Ильин А.Б., Гамзатова З.Н., Янкееич Ю.В., Артемьева А.С., Королькова Е.Н. Персонализация в лечении рака шейки матки во время беременности. Вопросы онкологии 2015; 61(3): 486–493.
- Liu Y., Tian L.B., Yang H.Y., Zhang H.P. Effects of estradiol and progesterone on the growth of HeLa cervical cancer cells. Eur Rev Med Pharmacol Sci 2017; 21(17): 3959–3965.
- Numata T., Sato-Numata K., Okada Y. TRPM7 is involved in acid-induced necrotic cell death in a manner sensitive to progesterone in human cervical cancer cells. Physiol Rep 2019; 7(13): e14157, https://doi.org/10.14814/phy2.14157.
- Федотчева Т.А., Свешникова Е.Д., Шеина Н.И., Соколов М.Н., Кудрявцев К.В., Федотчева Н.И., Шимановский Н.Л. Cинтез и цитостатическая активность новых производных 17-ацетата мепрегенола в отношении культуры опухолевых клеток HeLa. Химико-фармацевтический журнал 2020; 54(2): 17–23, https://doi.org/10.30906/0023-1134-2020-54-2-17-23.
- Семейкин А.В., Федотчева Т.А., Тихонов Д.А., Карева Е.Н., Шимановский Н.Л., Левина И.С., Куликова Л.Е., Заварзин И.В. Синтез и цитостатическая активность ряда прегна-d’-пентаранов на культуре клеток HeLa. Химико-фармацевтический журнал 2014; 48(6): 9–13.
- Yang B.Y., Gulinazi Y., Du Y., Ning C.C., Cheng Y.L., Shan W.W., Luo X.Z., Zhang H.W., Zhu Q., Ma F.H., Liu J., Sun L., Yu M., Guan J., Chen X.J. Metformin plus megestrol acetate compared with megestrol acetate alone as fertility-sparing treatment in patients with atypical endometrial hyperplasia and well-differentiated endometrial cancer: a randomised controlled trial. BJOG 2020; 127(7): 848–857, https://doi.org/10.1111/1471-0528.16108.
- Petchsila K., Prueksaritanond N., Insin P., Yanaranop M., Chotikawichean N. Effect of metformin for decreasing proliferative marker in women with endometrial cancer: a randomized double-blind placebo-controlled trial. Asian Pac J Cancer Prev 2020; 21(3): 733–741, https://doi.org/10.31557/APJCP.2020.21.3.733.
- Zhao Y., Sun H., Feng M., Zhao J., Zhao X., Wan Q., Cai D. Metformin is associated with reduced cell proliferation in human endometrial cancer by inbibiting PI3K/AKT/mTOR signaling. Gynecol Endocrinol 2018; 34(5): 428–432, https://doi.org/10.1080/09513590.2017.1409714.
- Lheureux S., Oza A.M. Endometrial cancer-targeted therapies myth or reality? Review of current targeted treatments. Eur J Cancer 2016; 59: 99–108, https://doi.org/10.1016/j.ejca.2016.02.016.
- Lee D.Y., Lee T.S. Associations between metabolic syndrome and gynecologic cancer. Obstet Gynecol Sci 2020; 63(3): 215–224, https://doi.org/10.5468/ogs.2020.63.3.215.
- Horwitz K.B., Sartorius C.A. 90 years of progesterone: progesterone and progesterone receptors in breast cancer: past, present, future. J Mol Endocrinol 2020; 65(1): T49–T63, https://doi.org/10.1530/jme-20-0104.
- Prior J.C. Progesterone for treatment of symptomatic menopausal women. Climacteric 2018; 21(4): 358–365, https://doi.org/10.1080/13697137.2018.1472567.
- Prior J.C. Progesterone is important for transgender women’s therapy-applying evidence for the benefits of progesterone in ciswomen. J Clin Endocrinol Metab 2019; 104(4): 1181–1186, https://doi.org/10.1210/jc.2018-01777.
- Warren M.P., Biller B.M., Shangold M.M. A new clinical option for hormone replacement therapy in women with secondary amenorrhea: effects of cyclic administration of progesterone from the sustained-release vaginal gel Crinone (4% and 8%) on endometrial morphologic features and withdrawal bleeding. Am J Obstet Gynecol 1999; 180(1): 42–48, https://doi.org/10.1016/s0002-9378(99)70147-x.
- Farquhar C., Rombauts L., Kremer J.A., Lethaby A., Ayeleke R.O. Oral contraceptive pill, progestogen or oestrogen pretreatment for ovarian stimulation protocols for women undergoing assisted reproductive techniques. Cochrane Database Syst Rev 2017; 5(5): CD006109, https://doi.org/10.1002/14651858.cd006109.pub3.
- Zolton J.R., Lindner P.G., Terry N., DeCherney A.H., Hill M.J. Gonadotropins versus oral ovarian stimulation agents for unexplained infertility: a systematic review and meta-analysis. Fertil Steril 2020; 113(2): 417–425.e1, https://doi.org/10.1016/j.fertnstert.2019.09.042.
- Сыркашева А.Г., Петросян Я.А., Долгушина Н.В. Гестагены в программах вспомогательных репродуктивных технологий. Гинекология 2019; 21(2): 76–79, https://doi.org/10.26442/20795696.2019.2.190238.
- Булгакова В.П., Боровиков И.О. Применение препаратов микронизированного натурального прогестерона при подготовке к проведению вспомогательных репродуктивных технологий у пациенток с маточным фактором бесплодия. Проблемы репродукции 2018; 24(6): 67–75, https://doi.org/10.17116/repro20182406167.
- Храмцова А.Ю., Башмакова Н.В. Cовременный взгляд на проблему «тонкого» эндомерия: пути решения в программах врт (обзор литературы). Проблемы репродукции 2019; 25(4): 69–76, https://doi.org/10.17116/repro20192504169.
- Методические рекомендации по определению специфической фармакологической активности стероидных гормонов и их антагонистов. В кн.: Руководство по проведению доклинических исследований лекарственных средств. Под ред. Миронова А.Н. M: Гриф и К; 2012; с. 702–711.
- Arab H., Alharbi A.J., Oraif A., Sagr E., Al Madani H., Abduljabbar H., Bajouh O.S., Faden Y., Sabr Y. The role of progestogens in threatened and idiopathic recurrent miscarriage. Int J Womens Health 2019; 11: 589–596, https://doi.org/10.2147/ijwh.s224159.
- Goddard L.M., Ton A.N., Org T., Mikkola H.K.A., Iruela-Arispe M.L. Selective suppression of endothelial cytokine production by progesterone receptor. Vascul Pharmacol 2013; 59(1–2): 36–43, https://doi.org/10.1016/j.vph.2013.06.001.
- VanLandingham J.W., Cekic M., Cutler S., Hoffman S.W., Stein D.G. Neurosteroids reduce inflammation after TBI through CD55 induction. Neurosci Lett 2007; 425(2): 94–98, https://doi.org/10.1016/j.neulet.2007.08.045.
- Qin Y.Y., Zhou Y.H., Lu Y.Q., Sun F., Yang S., Harypursat V., Chen Y.K. Effectiveness of glucocorticoid therapy in patients with severe coronavirus disease 2019: protocol of a randomized controlled trial. Chin Med J (Engl) 2020; 133(9): 1080–1086, https://doi.org/10.1097/CM9.0000000000000791.
- Erickson T.B., Chai P.R., Boyer E.W. Chloroquine, hydroxychloroquine and COVID-19. Toxicol Commun 2020; 4(1): 40–42, https://doi.org/10.1080/24734306.2020.1757967.
- Zhao W., Cong Y., Li H.M., Li S., Shen Y., Qi Q., Zhang Y., Li Y.Z., Tang Y.J. Challenges and potential for improving the druggability of podophyllotoxin-derived drugs in cancer chemotherapy. Nat Prod Rep 2020, https://doi.org/10.1039/d0np00041h.
- Огурцов С.И., Духанин А.С., Левина И.С., Шимановский Н.Л. Влияние синтетических гестагенов из группы азотсодержащих пентаранов на активность тирозинаминотрансферазы печени крыс. Экспериментальная и клиническая фармакология 2015; 78(5): 47–48.
- Fedotcheva T.A., Kruglov A.G., Teplova V.V., Fedotcheva N.I., Rzheznikov V.M., Shimanovskii N.L. Effect of steroid hormones on production of reactive oxygen species in mitochondria. Biophysics 2012; 57(6): 792–795, https://doi.org/10.1134/s0006350912060061.
- Liga A.B., Ukhina T.V., Shimanovski N.L. Activity lysosomal enzymes in rat skin fibroblasts after treatment with progesterone and new gestagen ABMP. Bull Exp Biol Med 2008; 145(1): 44–46, https://doi.org/10.1007/s10517-008-0013-x.
- Щелкунова Т.А., Морозов И.А. Молекулярные основы и тканевая специфичность действия прогестинов. Молекулярная биология 2015; 49(5): 728, https://doi.org/10.7868/s0026898415050158.
- Порохин А.П., Кудрин В.С., Клодт П.М., Наркевич В.Б., Матюшин А.И., Роговский В.С., Ржезников В.М., Шимановский Н.Л. Влияние синтетического гестагена бутерола на обмен моноаминов в головном мозге крыс. Вестник РГМУ 2011; 2: 72–74.
- Федотчева Т.А., Теплова В.В., Федотчева Н.И. Активация кальций-зависимой циклоспорин-чувствительной митохондриальной поры доксорубицином в комплексе с ионами железа. Биологические мембраны: журнал мембранной и клеточной биологии 2018; 35(1): 79–84, https://doi.org/10.7868/s0233475518010097.
- Сергеев П.В., Атрошкин К.А., Семейкин А.В., Шимановский Н.Л., Федотчева Т.А., Секирина М.А. Регуляция гестагенами пролиферативной активности клеток-мишеней. Вестник Российского онкологического научного центра им. Н.Н. Блохина РАМН 2008; 19(1): 22–28.
- Fedotcheva N.I., Teplova V.V., Fedotcheva T.A., Rzheznikov V.M., Shimanovskii N.L. Effect of progesterone and its synthetic analogues on the activity of mitochondrial permeability transition pore in isolated rat liver mitochondria. Biochem Pharmacol 2009; 78(8): 1060–1068, https://doi.org/10.1016/j.bcp.2009.05.028.
- Федотчева Т.А., Одинцова Е.В., Шимановский Н.Л. Молекулярные механизмы цитостатического и химиосенсибилизирующего действия гестагенов. Вестник Российской академии медицинских наук 2010; 9: 42–50.
- Chiu H.C., Li C.J., Yiang G.T., Tsai A.P., Wu M.Y. Epithelial to mesenchymal transition and cell biology of molecular regulation in endometrial carcinogenesis. J Clin Med 2019; 8(4): 439, https://doi.org/10.3390/jcm8040439.
- van der Horst P.H., Wang Y., Vandenput I., Kühne L.C., Ewing P.C., van Ijcken W.F., van der Zee M., Amant F., Burger C.W., Blok L.J. Progesterone inhibits epithelial-to-mesenchymal transition in endometrial cancer. PLoS One 2012; 7(1): e30840, https://doi.org/10.1371/journal.pone.0030840.
- Huang X., Zhong R., He X., Deng Q., Peng X., Li J., Luo X. Investigations on the mechanism of progesterone in inhibiting endometrial cancer cell cycle and viability via regulation of long noncoding RNA NEAT1/microRNA-146b-5p mediated Wnt/β-catenin signaling. IUBMB Life 2019; 71(2): 223–234, https://doi.org/10.1002/iub.1959.
- Федотчева Т.А., Одинцова Е.В., Банин В.В., Шимановский Н.Л. Фармакологическое значение сопряженной регуляции системы множественной лекарственной устойчивости и митохондриальной поры гестагенами. Вестник Российского онкологического научного центра им. Н.Н. Блохина РАМН 2011; 22(4): 12–16.
- Dong J., Qin Z., Zhang W.D., Cheng G., Yehuda A.G., Ashby C.R. Jr., Chen Z.S., Cheng X.D., Qin J.J. Medicinal chemistry strategies to discover P-glycoprotein inhibitors: an update. Drug Resist Updat 2020; 49: 100681, https://doi.org/10.1016/j.drup.2020.100681.
- Bukowski K., Kciuk M., Kontek R. Mechanisms of multidrug resistance in cancer chemotherapy. Int J Mol Sci 2020; 21(9): 3233, https://doi.org/10.3390/ijms21093233.
- Brayboy L.M., Knapik L.O., Long S., Westrick M., Wessel G.M. Ovarian hormones modulate multidrug resistance transporters in the ovary. Contracept Reprod Med 2018; 3: 26, https://doi.org/10.1186/s40834-018-0076-7.
- Wu X., Zhang X., Sun L., Zhang H., Li L., Wang X., Li W., Su P., Hu J., Gao P., Zhou G. Progesterone negatively regulates BCRP in progesterone receptor-positive human breast cancer cells. Cell Physiol Biochem 2013; 32(2): 344–354, https://doi.org/10.1159/000354442.
- Yuan S., Tao F., Zhang X., Zhang Y., Sun X., Wu D. Role of Wnt/β-catenin signaling in the chemoresistance modulation of colorectal cancer. Biomed Res Int 2020; 2020: 9390878, https://doi.org/10.1155/2020/9390878.
- Mehdinejadiani S., Amidi F., Mehdizadeh M., Barati M., Pazhohan A., Alyasin A., Mehdinejadiani K., Sobhani A. Effects of letrozole and clomiphene citrate on Wnt signaling pathway in endometrium of polycystic ovarian syndrome and healthy women. Biol Reprod 2019; 100(3): 641–648, https://doi.org/10.1093/biolre/ioy187.
- Medina M.A., Oza G., Sharma A., Arriaga L.G., Hernández Hernández J.M., Rotello V.M., Ramirez J.T. Triple-negative breast cancer: a review of conventional and advanced therapeutic strategies. Int J Environ Res Public Health 2020; 17(6): 2078, https://doi.org/10.3390/ijerph17062078.