Матричные РНК генов FCGR3A и FCGR3B как мониторинговые маркеры течения светлоклеточного рака почки (пилотное исследование)
Цель исследования — оценить возможности мРНК генов, кодирующих белки CD16a (FCGR3A) и CD16b (FCGR3B) в образцах опухоли больных раком почки, охарактеризовать течение опухолевого процесса во взаимосвязи с клинико-морфологическими факторами.
Материалы и методы. В работе использовали 125 образцов опухоли пациентов с гистологически подтвержденным диагнозом рака почки T1–4N0–1M0–1. Для выделения нуклеиновых кислот применяли метод Chomczynski, Sacchi. Уровни мРНК генов определяли с помощью полимеразной цепной реакции с обратной транскрипцией и рассчитывали по формуле ΔΔCt с учетом эффективности реакции.
Результаты. мРНК гена FCGR3A выявлена во всех исследованных образцах опухолевой ткани, напротив, мРНК гена FCGR3В встречалась только в 92,0% случаев (115/125). В опухолях, классифицированных как рТ1, содержание мРНК гена FCGR3А было статистически значимо ниже, чем в образцах опухолей размером рТ3. Отмечено статистически значимое повышение содержания мРНК обоих генов по мере увеличения степени злокачественности новообразования, а также в случаях появления отдаленных метастазов. Наличие опухолевого тромба в системе нижней полой вены сопровождалось статистически значимым повышением содержания мРНК гена FCGR3А.
Заключение. Выявленные взаимосвязи повышения количества мРНК гена FCGR3А и в некоторых случаях — мРНК гена FCGR3В с рядом клинико-морфологических факторов в образцах опухолевой ткани у больных светлоклеточным раком почки позволяют рассматривать уровень мРНК этих генов в качестве новых мониторинговых биомаркеров.
Введение
Почечно-клеточный рак составляет 80–85% от новообразований почки и 2–3% — от всех злокачественных новообразований [1]. Несмотря на успехи в диагностике, хирургическом и лекарственном его лечении, клинический исход остается неудовлетворительным [2]. Одной из причин этого является отсутствие биомаркеров, позволяющих контролировать течение заболевания и индивидуализировать лечение [3].
В процессе опухолевого роста важная роль принадлежит иммунной системе организма, контролирующей развитие новообразования и распространение метастазов [4]. В иммунном ответе на опухоль участвуют натуральные киллеры (NK-клетки), нейтрофилы, моноциты/макрофаги. В мониторинговых целях может использоваться оценка экспрессии генов FCGR3A и FCGR3B, кодирующих белки CD16a и CD16b. Экспрессия белка CD16a характерна для натуральных киллеров. Дополнительно CD16a обнаруживается на мембране моноцитов, тканеспецифичных макрофагов, ãä T-лимфоцитов и дендритных клеток [5, 6]. Белок CD16b является молекулярным маркером нейтрофилов [7]. Кроме того, CD16b на низком уровне экспрессируется на базофилах и выявляется на эозинофилах после индукции IFN-ã [2].
Оценка экспрессии мембранных молекул CD16 используется для определения популяционного состава клеток периферической крови и их функционального состояния при онкологических заболеваниях. Имеется весьма ограниченная информация о взаимосвязи между уровнями мРНК генов, кодирующих CD16a (FCGR3A) и CD16b (FCGR3B) в опухоли, и клинико-морфологическими факторами, определяющими течение рака, в том числе рака почки. Однако детального изучения экспрессии генов FCGR3A и FCGR3B на транскрипционном уровне не проводилось.
Цель исследования — оценить возможности мРНК генов, кодирующих белки CD16a (FCGR3A) и CD16b (FCGR3B) в образцах опухолей больных раком почки, охарактеризовать течение опухолевого процесса во взаимосвязи с клинико-морфологическими факторами.
Материалы и методы
В работе использовали 125 образцов опухолей пациентов с гистологически подтвержденным диагнозом рака почки T1–4N0–1M0–1. Образцы опухолевой ткани были получены в ходе выполнения оперативного вмешательства — нефрэктомии или резекции почки. Среди обследованных было 63,2% мужчин (79/125) и 36,8% женщин (46/125), средний возраст больных — 60,2 года. У 44,0% участников исследования (55/125) новообразование почки соответствовало T1, у 6,4% (8/125) — T2, у 49,6% (62/125) — T3. Cтепень злокачественности опухоли по Fuhrman: GI — 16,8% (21/125) пациентов; GII — 17,6% (22/125); GIII — 57,6% (72/125); GIV — 8% (10/125). Поражение регионарных лимфоузлов выявлено в 17,6% случаев (22/125), наличие отдаленных метастазов — в 40,3% (31/125): в надпочечники — 22,6% (7/31); легкие — 29,0% (9/31); кости — 25,8% (8/31); печень — 22,6% (7/31). Наличие опухолевого тромба в системе нижней полой вены отмечено в 25,6% наблюдений (32/125).
Объемы диагностики и лечения больных раком почки соответствовали рекомендуемым алгоритмам по диагностике и лечению злокачественных новообразований, утвержденным Минздравом России. Исследование проведено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Приволжского окружного медицинского центра ФМБА России. От каждого пациента получено информированное согласие.
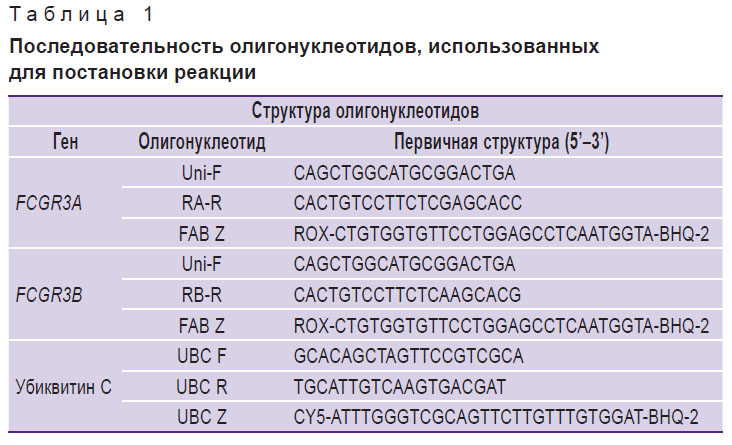
Для выделения нуклеиновых кислот применяли метод Chomczynski, Sacchi [8]. Комплементарную ДНК синтезировали с использованием обратной транскриптазы M-MLV («Силекс», Россия) согласно рекомендации производителя. Определение относительного уровня мРНК генов FCGR3A и FCGR3B проводили с применением полимеразной цепной реакции (ПЦР) в реальном масштабе времени, с использованием амплификаторов CFX96 Touch (Bio-Rad, США) в течение 1 ч 15 мин по следующей программе: 94,0°С — 2 мин (42 цикла ПЦР по 20 с); 60,0°С — 20 с; 72,0°С — 20 с. Реакционная смесь содержала: 4,1 мкл Н2О (бидистиллят); 1,5 мкл 10х буфера; 1,2 мкл MgCl2; 1,2 мкл дезоксинуклеозидтрифосфатов (dNTP); 0,2 мкл HotTaq-полимеразы («Силекс») и по 1,8 мкл каждого из олигонуклеотидов («Синтол», Россия), последовательность которых представлена в табл. 1.
|
Таблица 1. Последовательность олигонуклеотидов, использованных для постановки реакции |
Уровни мРНК рассчитывали по формуле ΔΔCt с учетом эффективности реакции [9]. Нормировку их осуществляли относительно уровня мРНК убиквитина С (UBC).
Статистическую обработку результатов проводили с помощью программ Statistica v. 8.0. Проверку гипотезы о соответствии распределения полученных вариантов нормальному распределению осуществляли с помощью критерия Шапиро–Уилка. Для определения количественных показателей подсчитывали медиану (Ме), квартили Q1 (25%) и Q3 (75%). Для сравнения двух независимых групп по количественным признакам применяли двусторонний критерий Манна–Уитни, для сравнения трех и более независимых групп — критерий Краскела–Уоллиса. Различия между группами считали статистически значимыми при р<0,05.
Результаты и обсуждение
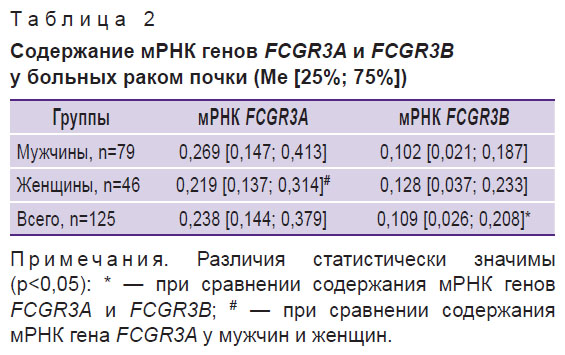
Проведенные исследования показали, что мРНК гена FCGR3A выявляется во всех исследованных образцах опухолевой ткани. Напротив, мРНК гена FCGR3В встречалась только в 92,0% случаев (115/125). Содержание мРНК гена FCGR3A в опухоли было в 2,2 раза выше (р<0,05), чем FCGR3В (табл. 2).
|
Таблица 2. Содержание мРНК генов FCGR3A и FCGR3В у больных раком почки (Me [25%; 75%]) |
Таким образом, развитие рака почки сопровождалось преимущественной активацией экспрессии гена FCGR3A, что может свидетельствовать о высокой степени инфильтрации опухоли, в первую очередь NK-клетками.
Уровень мРНК гена FCGR3A в образцах опухоли мужчин был выше, чем у женщин, в 1,2 раза (р>0,05) (см. табл. 2). Гендерные различия иммунологических показателей приводятся и в литературе, например у больных колоректальным раком [10, 11]. Содержание мРНК гена FCGR3В в обеих группах статистически значимо не различалось.
У больных с опухолями, классифицированными как рТ1, содержание мРНК гена FCGR3А было статистически значимо ниже (p<0,05), чем в образцах пациентов, имевших опухоли размером рТ3, — в 1,5 раза (табл. 3). Отличий в уровнях мРНК гена FCGR3В у лиц, имеющих различные размеры первичного очага, не обнаружено (р>0,05). Следует отметить существование статистически значимых различий количества мРНК этих генов в образцах опухолей, классифицируемых как рТ2, где уровень мРНК гена FCGR3А превышал содержание мРНК гена FCGR3В в 10 раз (р<0,05). В образцах опухолей, относящихся к рТ1 и рТ3, содержание тестированных мРНК генов FCGR3А и FCGR3В не различалось (р>0,05), а уровень мРНК гена FCGR3А был выше содержания мРНК гена FCGR3В только в 2,2 и 2,0 раза соответственно.

|
Таблица 3. Содержание мРНК генов FCGR3A и FCGR3В у больных раком почки в зависимости от размера первичного очага и степени злокачественности опухоли (Me [25%; 75%]) |
Обращает на себя внимание разнонаправленный характер изменений уровней мРНК этих генов в данных группах (см. табл. 3). По-видимому, содержание мРНК гена FCGR3А является более чувствительным маркером роста первичной опухоли, чем количество мРНК гена FCGR3В. В литературе имеются сведения о возможной вовлеченности FCGR3A в регуляцию хронического воспаления в опухолях больных колоректальным раком [10]. Нельзя исключить подобные механизмы участия FCGR3A в патогенезе рака почки.
В исследовании проведена оценка содержания мРНК генов FCGR3А и FCGR3В в опухолях с разной степенью злокачественности (GЗ). При GII уровень мРНК гена FCGR3А возрастал в 1,5 раза (р<0,05) по сравнению с его значением в образцах больных с опухолями GI, при GIII — в 2,6 (р<0,05), при GIV — в 2,9 раза (р<0,05) соответственно (см. табл. 3). Количество мРНК гена FCGR3В в образцах опухолей GIV увеличивалось в 4,4 раза (р<0,05) по сравнению с ее содержанием в образцах новообразований GI.
Полученные результаты свидетельствуют, что изменения исследуемых мРНК носят однонаправленный характер, связанный с ростом содержания как мРНК гена FCGR3А, так и мРНК гена FCGR3В по мере увеличения степени злокачественности опухоли. Выявленные различия содержания мРНК этих генов у больных с опухолями разной степени злокачественности указывают, что по мере увеличения злокачественности новообразования нарастает напряженность иммунного ответа, что не оптимально для торможения опухолевого роста. Предположительно это связано с участием самой опухоли в процессах экспрессии мембранных белков на поверхности иммунокомпетентных клеток [12]. Кроме того, вполне вероятно, что по мере роста размеров первичного новообразования или повышения его степени злокачественности происходит нарастание степени выраженности воспалительных процессов в окружающих тканях, которое сопровождается привлечением в опухоль различных лейкоцитарных клеток, в том числе нейтрофилов, NK-клеток и макрофагов.
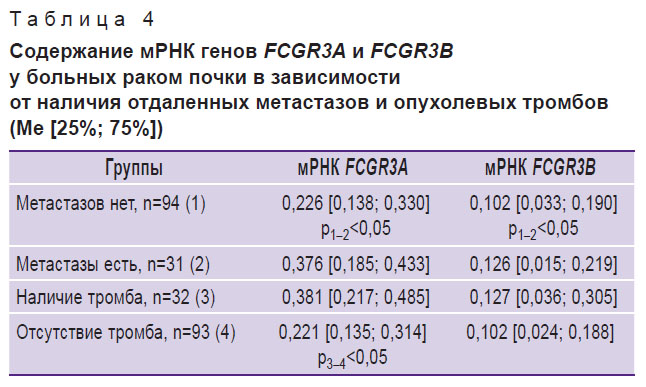
Наличие или отсутствие метастазов в регионарных лимфоузлах не сопровождалось статистически значимыми различиями количества мРНК генов FCGR3А и FCGR3В в образцах опухолевой ткани у пациентов (р>0,05). Напротив, при появлении отдаленных метастазов уровень мРНК гена FCGR3А был в 1,7 (р<0,05), а содержание мРНК гена FCGR3В — в 1,2 раза выше (р<0,05), чем у лиц, не имевших вторичных очагов поражения (табл. 4).
|
Таблица 4. Содержание мРНК генов FCGR3A и FCGR3В у больных раком почки в зависимости от наличия отдаленных метастазов и опухолевых тромбов (Me [25%; 75%]) |
В случае наличия опухолевого тромба в системе нижней полой вены содержание мРНК гена FCGR3А возрастало по сравнению с показателями лиц, у которых тромб не выявлялся, в 1,7 раза (р<0,05). Количество мРНК гена FCGR3В статистически значимо не различалось в обеих этих группах.
Выявление отдаленных метастазов и/или опухолевых тромбов в системе нижней полой вены относится к неблагоприятным факторам прогноза [13–15]. Можно предположить, что повышенная инфильтрация опухоли нейтрофилами и NK-клетками наблюдается в более прогностически неблагоприятных случаях. Натуральные киллеры играют ключевую роль в защите от злокачественных или вирус-инфицированных клеток [16]. Они могут быть «специфически активированы» через определенные Fc-рецепторы, которые экспрессируются на их клеточной поверхности, в том числе FcãRIIIA, передающие активирующие сигналы внутрь клетки. После активации Fc-рецепторов антителами, связанными с клетками-мишенями, NK-клетки способны лизировать клетки-мишени без прайминга и секретировать цитокины, такие как гамма-интерферон [17, 18]. По-видимому, высокий уровень мРНК гена FCGR3А в этих условиях связан с повышенной экспрессией FcãRIIIa, направленной на активацию NK-клеток, и потому в особо прогностически неблагоприятных ситуациях наблюдается повышение уровня мРНК гена FCGR3В.
Связи между инфильтрацией почечно-клеточной карциномы клетками иммунной системы и клинико-патологическими характеристиками остаются до настоящего времени неясными и активно изучаются. Состав опухоль-инфильтрирующих лейкоцитов весьма гетерогенен. К лейкоцитам, инфильтрирующим опухоль, относят лимфоциты (CD8+ Т-клетки, Th1-клетки, В-лимфоциты), дендритные клетки, опухоль-ассоциированные макрофаги, нейтрофилы, NK-клетки. Относительно реже встречаются Th2- и регуляторные T-клетки, что предполагает преобладание провоспалительного профиля. С помощью масс-спектрометрии относительно недавно показано, что превалирует популяция Т-лимфоцитов, затем следуют опухоль-ассоциированные макрофаги, осуществляющие FcãR-опосредованный фагоцитоз, NK-клетки, В-клетки, дендритные клетки и нейтрофилы [19]. В опухолевом микроокружении наряду с Т-регуляторами находятся инфильтрирующие опухоль супрессорные миелоидные клетки, которые блокируют развитие эффективного иммунного ответа [20].
Еще одним типом иммунных клеток, вносящим вклад в опухолевую иммуносупрессию, являются опухоль-ассоциированные макрофаги [21]. Показано, что отсутствие ответа на ингибиторы тирозинкиназы связано с повышением количества в опухолевых очагах активированных опухоль-ассоциированных макрофагов [19]. Установлено, что опухоль-ассоциированные NK-клетки имеют пониженную экспрессию CD16, но их количество в процентном отношении в 8 раз превышает содержание этих же клеток в крови. При этом известна очень высокая вариабельность количества NK-клеток у разных больных, по-видимому, зависящая от течения опухолевого процесса и влияющая на опухолевое микроокружение [22]. Показано, что степень инфильтрации NK-клетками и экспрессия маркеров (CD16 и цитотоксинов) определяют функциональную способность NK-клеток, инфильтрирующих почечно-клеточную карциному, и могут быть использованы для характеристики подгрупп почечно-клеточного рака [23]. Обнаружены положительные корреляции между содержанием макрофагов, стадией опухоли и степенью злокачественности новообразования. Кроме того, выявлено, что ассоциированные с опухолью нейтрофилы способствуют прогрессированию новообразования через ограничение противоопухолевого иммунитета, воздействуя на местное воспаление, ангиогенез и лимфангиогенез [24]. Полученные нами результаты свидетельствуют о повышении уровня экспрессии генов, кодирующих CD16a в NK-клетках, макрофагах, CD16b — в нейтрофилах и соответствуют представленным в литературных источниках данным.
Заключение
В образцах опухолевой ткани у больных светлоклеточным раком почки происходит преимущественная продукция мРНК гена FCGR3А в сравнении с мРНК гена FCGR3В. Содержание мРНК гена FCGR3А возрастает при наличии клинико-морфологических признаков неблагоприятного прогноза заболевания: повышения степени злокачественности новообразования, появления отдаленных метастазов, опухолевого тромба в системе нижней полой вены.
Содержание мРНК гена FCGR3А в опухолевой ткани больных более подвержено количественным изменениям, связанным с выявлением неблагоприятных прогностических факторов, чем уровень мРНК гена FCGR3В. Однако в случаях опухолей низкой степени дифференцировки или при появлении вторичных очагов поражения продукция мРНК гена FCGR3В возрастает по сравнению с ее значением в более прогностически благоприятных ситуациях.
Уровень экспрессии мРНК гена FCGR3А и в некоторых случаях — мРНК гена FCGR3В в ткани опухоли у больных раком почки позволяет говорить о прогностическом значении этих генов в оценке течения заболевания.
Источники финансирования. Исследование выполнено по инициативе и с использованием средств авторов.
Конфликт интересов. Авторы не имеют конфликта интересов.
Литература
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018; 68(1): 7–30, https://doi.org/10.3322/caac.21442.
- Barata P.C., Rini B.I. Treatment of renal cell carcinoma: current status and future directions. CA Cancer J Clin 2017; 67(6): 507–524, https://doi.org/10.3322/caac.21411.
- Zhang S., Zhang E., Long J., Hu Z., Peng J., Liu L., Tang F., Li L., Ouyang Y., Zeng Z. Immune infiltration in renal cell carcinoma. Cancer Sci 2019; 110(5): 1564–1572, https://doi.org/10.1111/cas.13996.
- Giraldo N.A., Becht E., Vano Y., Sautès-Fridman C., Fridman W.H. The immune response in cancer: from immunology to pathology to immunotherapy. Virchows Arch 2015; 467(2): 127–135, https://doi.org/10.1007/s00428-015-1787-7.
- Gillis C., Gouel-Chèron A., Jönsson F., Bruhns P. Contribution of human FcγRs to disease with evidence from human polymorphisms and transgenic animal studies. Front Immunol 2014; 5: 254, https://doi.org/10.3389/fimmu.2014.00254.
- Wang E., Adams S., Stroncek D.F., Marincola F.M. Human leukocyte antigen and human neutrophil antigen systems. In: Hematology. Silberstein L.E., Anastasi J., Hoffman R., Benz E.J., Heslop H., Weitz J. (editors). Elsevier; 2018: p. 1721–1737, https://doi.org/10.1016/b978-0-323-35762-3.00113-x.
- Bhatnagar N., Ahmad F., Hong H.S., Eberhard J., Lu I.N., Ballmaier M., Schmidt R.E., Jacobs R., Meyer-Olson D. FcγRIII (CD16)-mediated ADCC by NK cells is regulated by monocytes and FcγRII (CD32). Eur J Immunol 2014; 44(11): 3368–3379, https://doi.org/10.1002/eji.201444515.
- Chomczynski P., Sacchi N. The single-step method of RNA isolation by acid guanidinium thiocyanate–phenol–chloroform extraction: twenty-something years on. Nat Protoc 2006; 1(2): 581–585, https://doi.org/10.1038/nprot.2006.83.
- Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method. Methods 2001; 25(4): 402–408, https://doi.org/10.1006/meth.2001.1262.
- Красногорова Н.В., Новиков Д.В., Фомина С.Г., Алясова А.В., Магомедов М.А., Новиков В.В., Караулов А.В. Уровень мРНК CD16a и CD16b как потенциальный иммунологический маркер при колоректальном раке. Бюллетень сибирской медицины 2019; 18(1): 220–227, https://doi.org/10.20538/1682-0363-2019-1-220-227.
- Klein S.L., Flanagan K.L. Sex differences in immune responses. Nat Rev Immunol 2016; 16(10): 626–638, https://doi.org/10.1038/nri.2016.90.
- Головизнин М.В. Вмешательство раковых клеток в процессы созревания и селекции Т-лимфоцитов как фактор опухолевой прогрессии. Иммунология 2001; 6: 4–10.
- Давыдов М.И., Матвеев В.Б., Полоцкий Б.Е., Матвеев Б.П., Носов Д.А. Хирургическое лечение метастазов рака почки в легких. Российский онкологический журнал 2003; 4: 15–18.
- Serena G., Gonzalez J., Gaynor J.J., Salerno T., Verzaro R., Ciancio G. Pulmonary tumor embolization as early manifestation in patients with renal cell carcinoma and tumor thrombus: perioperative management and outcomes. J Card Surg 2019; 34(10): 1018–1023, https://doi.org/10.1111/jocs.14182.
- Manso M., Pacheco-Figueiredo L., Santos-Silva A., Silva J., Silva C., Cruz F. Renal cell carcinoma with venous thrombus: should surgery be offered when metastasis is present at diagnosis? Urol Int 2018; 101(4): 387–390, https://doi.org/10.1159/000493510.
- Vivier E., Tomasello E., Baratin M., Walzer T., Ugolini S. Functions of natural killer cells. Nat Immunol 2008; 9: 503–510, https://doi.org/10.1038/ni1582.
- Campbell K.S., Hasegawa J. Natural killer cell biology: an update and future directions. J Allergy Clin Immunol 2013; 132(3): 536–544, https://doi.org/10.1016/j.jaci.2013.07.006.
- Wang W., Erbe A.K., Hank J.A., Morris Z.S., Sondel P.M. NK cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front Immunol 2015; 6: 368, https://doi.org/10.3389/fimmu.2015.00368.
- Hakimi A.A., Voss M.H., Kuo F., Sanchez A., Liu M., Nixon B.G., Vuong L., Ostrovnaya I., Chen Y.B., Reuter V., Riaz N., Cheng Y., Patel P., Marker M., Reising A., Li M.O., Chan T.A., Motzer R.J. Transcriptomic profiling of the tumor microenvironment reveals distinct subgroups of clear cell renal cell cancer — data from a randomized phase III trial. Cancer Discov 2019; 9(4): 510–525, https://doi.org/10.1158/2159-8290.cd-18-0957.
- Díaz-Montero C.M., Rini B.I., Finke J.H. The immunology of renal cell carcinoma. Nat Rev Nephrol 2020; 16(12): 721–735, https://doi.org/10.1038/s41581-020-0316-3.
- Gabrilovich D.I., Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system. Nat Rev Immunol 2009; 9(3): 162–174, https://doi.org/10.1038/nri2506.
- Guan Y., Chambers C.B., Tabatabai T., Hatley H., Delfino K.R., Robinson K., Alanee S.R., Ran S., Torry D.S., Wilber A. Renal cell tumors convert natural killer cells to a proangiogenic phenotype. Oncotarget 2020; 11(26): 2571–2585, https://doi.org/10.18632/oncotarget.27654.
- Schleypen J.S., Baur N., Kammerer R., Nelson P.J., Rohrmann K., Gröne E.F., Hohenfellner M., Haferkamp A., Pohla H., Schendel D.J., Falk C.S., Noessner E. Cytotoxic markers and frequency predict functional capacity of natural killer cells infiltrating renal cell carcinoma. Clin Cancer Res 2006; 12(3 Pt 1): 718–725, https://doi.org/10.1158/1078-0432.ccr-05-0857.
- Xu W., Jiang X., Guan C., Gu M. The prognostic and predictive value of tumor infiltrating macrophage and neutrophil in patient with clear cell renal cell carcinoma: tumor infiltrating lymphocytes in renal cell carcinoma. Medicine (Baltimore) 2020; 99(46): e23181, https://doi.org/10.1097/md.0000000000023181.










