Скаффолды на основе поли-3-оксибутирата и его сополимеров для инженерии костной ткани (обзор)
Биоразлагаемые и биосовместимые полимеры активно используют в тканевой инженерии для изготовления скаффолдов. Биомедицинские свойства полимерных скаффолдов зависят от физико-химических особенностей и кинетики биодеградации полимерного материала, 3D-микроструктуры и топографии поверхности скаффолдов, наличия минеральных веществ, лекарственных агентов и ростовых факторов, загруженных в скаффолд. Однако помимо этого может проявляться и собственная биологическая активность полимера и продуктов его биодеградации. В обзоре рассмотрены исследования, в которых показано, что скаффолды из поли-3-оксибутирата (ПОБ) и его сополимеров обладают собственной биологической активностью, а именно остеоиндуктивными свойствами. ПОБ способен индуцировать дифференцировку мезенхимальных стволовых клеток в остеогенном направлении in vitro и стимулирует регенерацию костной ткани при моделировании критических и некритических костных дефектов in vivo.
Введение
Тканевая инженерия — мультидисциплинарное научно-технологическое направление, которое объединяет последние достижения в области инженерии, материаловедения, клеточной биологии, биохимии и медицины, предлагая новые подходы для восстановления функций тканей и органов человека. Это принципиально иная парадигма лечения по сравнению с хирургией и трансплантацией. Она основана не на подходах замещения или функциональной компенсации тканей, а на регенерации, при которой организм сам может восстановить поврежденную ткань при наличии соответствующих условий.
Существует ряд клинических состояний, таких как травма, аномалии скелета, инфекция, остеопороз, резекция опухоли, хроническое воспалительное повреждение и некроз, при которых возникают костные дефекты. В настоящее время «золотым стандартом» лечения в большинстве случаев является аутологичная костная пластика. Однако этот традиционный метод имеет существенные недостатки, такие как ограниченная доступность трансплантируемого биоматериала и значительная болезненность донорского участка. Для преодоления этих проблем перспективной альтернативой может стать инженерия костной ткани, которая предполагает совместное использование клеток (прежде всего мезенхимальных стволовых клеток, МСК), скаффолдов и биоактивных молекул. Вместе они позволят обеспечить межклеточную коммуникацию и необходимое взаимодействие клеток и биоматериала, что будет способствовать достижению наилучшего терапевтического эффекта [1–3].
Скаффолды необходимы в качестве временного субстрата для прикрепления и роста клеток и накопления внеклеточного матрикса. Чтобы наилучшим образом имитировать костную ткань, скаффолды, используемые в тканевой инженерии, должны иметь трехмерную (3D) микроструктуру с высокой пористостью и определенным размером пор, необходимую топографию, биосовместимость и приемлемые механические свойства. Необходимо обеспечить циркуляцию межклеточной жидкости, направленное прикрепление, миграцию, пролиферацию и дифференциацию клеток, а также оптимальную интеграцию с окружающей тканью. Для создания таких скаффолдов могут быть использованы различные типы биоматериалов: металлы, керамика, синтетические или натуральные полимеры. В качестве скаффолдов для регенерации костной ткани наиболее предпочтительны биоразлагаемые и биосовместимые полимеры природного или синтетического происхождения.
Существуют различные методы изготовления скаффолдов с желаемой микроструктурой: электроформование, выщелачивание, вспенивание, агрегация частиц, сублимационная сушка, термоиндуцированное фазовое разделение, микролитье, микроволокнистое прядение, быстрое прототипирование (включая 3D-печать) [3–6]. 3D-печать является одним из наиболее интенсивно развивающихся методов, поскольку позволяет получать скаффолды с необходимой формой, микроструктурой и физико-химическими свойствами. Однако далеко не все материалы, особенно биоматериалы природного происхождения (не в виде композитов с полимерами, а в чистом виде), такие как полиоксиалканоаты (ПОА), получаемые бактериальным биосинтезом (прежде всего, гомополимер поли-3-оксибутират (ПОБ) и его сополимеры с другими 3-оксикарбоновыми кислотами); некоторые керамические и силикатные биоматериалы (диоксид циркония, биостекло (например, марки 45S5), монтморилланит, сапонит, гидроксиапатит, β-трикальцийфосфат); алломатериалы и ксеноматериалы, получаемые обработкой тканей животных, трупного и биопсийного материала, — подходят для процессинга в установках для прямого быстрого трехмерного прототипирования. Используемый в них основной физический метод обработки материалов — плавление, спекание и фотоотверждение — либо неприменим вовсе, либо может существенно изменить (испортить) физико-химические и биологические свойства указанных материалов [3, 7].
Активно развивается и метод электроформования для получения волокнистых скаффолдов из различных полимеров и их композитов, в том числе скаффолдов из нановолокон. Основные преимущества этого метода заключаются в том, что получаемые скаффолды обладают биомиметической структурой, сходной с волокнистой структурой кожи, мягкой соединительной ткани, слизистой оболочки, мышечных тканей. Нити формуются из раствора, эмульсии или дисперсии полимеров и их композитов, что является гораздо более мягким методом обработки, чем плавление и спекание. Наконец, эта технология обеспечивает получение скаффолдов с заданным составом, микроструктурой и физико-химическими свойствами [3, 8].
Мезенхимальные стволовые клетки в настоящее время активно внедряются в медицинскую практику как ключевой активный компонент новых клеточных технологий и тканевой инженерии благодаря тому, что эти клетки можно наращивать в нужном объеме, а затем управляемо запускать их дифференцировку в требуемом направлении, а именно в остеогенном, хондрогенном, миогенном, нейрогенном и др. МСК могут быть использованы в клинике в качестве перспективного клеточного терапевтического средства. В отличие от специализированных клеток (фибробластов, остеобластов и хондробластов), использование МСК позволяет замещать малочисленные клетки эндогенного происхождения при дегенеративных или регенеративных процессах и обновлять клетки с высоким пролиферативным потенциалом. Кроме того, МСК вызывают гораздо более адекватную реакцию иммунной системы после их трансплантации in vivo. Исследования на различных животных моделях показали, что МСК могут применяться для восстановления или регенерации поврежденных костей, хрящей, кожи или тканей миокарда [9–11].
Скаффолды из поли-3-оксибутирата и его сополимеров для инженерии костной ткани: исследования на клеточных культурах in vitro
Биоразлагаемые и биосовместимые полимеры, имеющие природное или синтетическое происхождение, — ПОА — считаются одним из наиболее перспективных биоматериалов при создании скаффолдов для регенерации костной ткани [12, 13]. ПОА можно разделить на две группы по химическому строению и способу получения: 1) поли-2-оксиалканоаты, получаемые путем химического синтеза (такие как полилактид — ПЛА, полигликолид — ПГА, их сополимеры — ПМГК, поли-ε-капролактон — ПГЛ); 2) поли-3-оксиалканоаты, получаемые путем бактериального биосинтеза (такие как ПОБ и его сополимеры с другими 3-оксикарбоновыми кислотами: 3-оксивалератом — ПОБВ, 4-оксибутиратом — П34ОБ, 3-оксигексаноатом — ПОБГк и др.). От химического строения напрямую зависят основные физико-химические и биологические свойства ПОА, которые значительно различаются [5, 6]. Однако если химически синтезируемые поли-2-оксиалканоаты широко используются для изготовления медицинских изделий, то поли-3-оксиалканоаты, прежде всего ПОБ и его сополимеры, пока применяются в качестве материалов медицинского назначения в очень ограниченном объеме. При этом потенциал таких полимеров для регенеративной медицины очень высок.
Высокая биосовместимость ПОБ in vitro показана в исследованиях на клеточных культурах, он признан перспективным материалом для тканевой инженерии. Культуры клеток различных типов: остеобластоподобные клетки (клетки линии MG-63 остеосаркомы человека, мышиные клетки линии MC3T3-E1), МСК человека, крысы, кролика, выделенные из костного мозга и жировой ткани, фибробласты человека и мыши (линии 3Т3 и другие), хондроциты кролика, эпителиальные и эндотелиальные клетки человека, нейроны человека, миобласты кролика — при непосредственном контакте с ПОБ при культивировании на полимерных пленках и скаффолдах демонстрировали удовлетворительный уровень клеточной адгезии, жизнеспособности и пролиферации [13]. При этом изучение влияния ПОБ и его сополимеров на рост и дифференцировку МСК имеет особое значение при использовании этих биополимеров в качестве биоматериалов для тканевой инженерии. Скаффолды из ПОБ и ПОБВ обеспечивают высокую скорость пролиферации МСК и остеобластоподобных клеток [14–19] или, напротив, не поддерживают более высокую пролиферацию МСК по сравнению с контролем (например, культуральным пластиком) [20–23], тогда как скаффолды из ПОБГк способствуют ускорению роста клеток [24–26], но также могут вызывать их апоптоз [23]. Высокая биосовместимость ПОБ связана не только с практическим отсутствием химической активности полимера (за исключением его подверженности гидролитической и ферментативной деструкции), но и с тем, что продуктами его биодеградации не являются агрессивные и токсичные вещества в отличие, например, от ПЛА, который разлагается до довольно сильной кислоты — молочной, а сама скорость гидролитической деградации ПОБ довольно низкая. В основном биодеградация ПОБ происходит за счет направленного разрушения им фагоцитирующих клеток (макрофагов, остеокластов) [13].
Показано, что МСК крысы [20, 21, 27, 28], человека [29, 30] и кролика [14], мышиные остеобластоподобные клетки линии MC3T3-E1 S14 [31], человеческие остеобластоподобные клетки линии MG-63 [15] и человеческие индуцированные стволовые клетки [16], выращенные на скаффолдах из ПОБ и его сополимеров ПОБВ и ПОБГк, подвергаются спонтанной дифференцировке в остеогенном направлении в стандартных условиях (в стандартной культуральной среде), а в условиях стимуляции остеогенной дифференцировки (в остеогенной культуральной среде) их дифференцировка еще более выражена, чем при стандартной стимуляции. Остеогенная дифференцировка МСК и остеобластных клеток, выращенных на скаффолдах из ПОБ и его сополимеров, подтверждается изменением морфологии клеток [14, 17, 20, 21, 30], подавлением их размножения [20, 21, 27], увеличением отложения солей кальция и активности щелочной фосфатазы [15, 19, 20, 28, 32], усилением экспрессии маркеров образования новой костной ткани и остеогенной дифференцировки (щелочная фосфатаза, остеопонтин, остеокальцин, коллаген I типа, транскрипционный фактор 2 — Runx2) [16, 20, 28, 29], в то же время есть исследования, в которых остеогенная дифференцировка МСК при культивировании их на скаффолдах из ПОБГк не выявлена [24, 25, 33].
Установлено [19], что покрытие скаффолдов, изготовленных из нанокомпозита Mg2SiO4-CuFe2O4, слоем ПОБ увеличивает жизнеспособность клеток, активность щелочной фосфатазы и минерализацию скаффолда при культивировании на нем остеобластоподобных клеток. Выявлено также [34], что волокнистые скаффолды из сополимера П34ОБ, полученные методом электроформования, способствуют значительно лучшему прикреплению и более быстрому росту МСК, выделенных из костного мозга крыс. На скрэтч-модели (механическое удаление клеток на поверхности скаффолда в виде полосы определенной ширины) также показано, что волокнистые скаффолды из П34ОБ поддерживают миграцию МСК. В остеогенной среде выявлена дифференцировка МСК в остеогенном направлении, что было видно по повышению активности и экспрессии щелочной фосфотазы и увеличению минерализации клетками скаффолда. Дифференцировка МСК в эпидермальном (в кератиноциты) и эндотелиальном (в сосудистые эндотелиальные клетки) направлениях продемонстрирована в соответствующих специальных стимулирующих средах с использованием нановолоконных скаффолдов, полученных методом электроформования, в качестве субстрата для роста клеток [35, 36].
Влияние ПОБ и его сополимеров на рост и дифференцировку МСК связано с физико-химическими свойствами полимерного материала, 3D-микроструктурой и топографией скаффолдов, изготовленных из этого полимера. Обработка поверхности полимера с помощью щелочи, ферментов или плазмы, которая изменяет ее физико-химические свойства (например, за счет повышения гидрофильности, но без изменения микроструктуры), приводит к значительному возрастанию адгезии и пролиферации клеток на поверхности изделий из ПОБ и его сополимеров [21, 32, 37–39]. Высказано предположение, что улучшенная гидрофильность полимерных пленок после обработки ПОБ липазами, щелочью и плазмой позволяет клеткам в суспензии легко прикрепляться к этим пленкам по сравнению с необработанными. Влияние гидрофильности поверхности биоматериала на адгезию клеток было продемонстрировано ранее [40]. Некоторые исследователи использовали ПОБ только в качестве основы для покрытия биоматериалами, влияние которых на рост и дифференцировку МСК и было изучено. Так, коллаген I типа, содержащий или не содержащий хондроитинсульфат, наносили на скаффолд, изготовленный станковым плетением из нитей ПОБ, и изучали остеогенную дифференциацию человеческих МСК, выделенных из костного мозга и растущих на скаффолде [41].
Микроструктура и топография поверхности, на которой растут клетки, могут играть особенно важную роль во влиянии на рост и дифференцировку МСК. Более того, влияние микроструктуры и топографии поверхности может даже снимать воздействие биоактивных молекул на рост или дифференцировку клеток [25, 33, 42]. Биологическая активность полимеров, в частности их влияние на рост и дифференцировку МСК как in vitro, так и in vivo, зависит от микроструктуры изготовленных из них 3D-изделий: топографии поверхности, 3D-микроструктуры, пористости, размера пор и их формы [3, 5, 25, 33]. Различные клетки предпочитают разные поверхности: например, МСК и остеобласты — более шероховатые поверхности с соответствующим размером пор [43, 44], в то время как фибробласты — более гладкую поверхность, а эпителиальные клетки прикрепляются только к самой гладкой поверхности [45]. Шероховатость влияет на прикрепление клеток, поскольку она обеспечивает необходимое пространство для роста МСК или остеобластов либо служит прочным субстратом для прикрепления их филоподий.
По данным [25, 33], cкаффолд с соответствующим размером пор обеспечивает лучшие свойства поверхности для закрепления нитей коллагена II типа и их проникновения во внутренние слои скаффолда, засеянного хондроцитами. Этому могло способствовать взаимодействие белков внеклеточного матрикса с поверхностью материала. Однако изучение пролиферации и дифференцировки МСК, выращенных на электроформованных скаффолдах со случайно и направленно ориентированными волокнами, дало противоречивые результаты: направленные волокна стимулировали остеогенную дифференцировку МСК [33] или же не отмечалось значительной разницы в дифференцировке клеток по сравнению со случайно ориентированными волокнами [29]. Более того, скаффолды с пористой поверхностью могут ингибировать остеогенную дифференцировку МСК, культивируемых в остеогенной среде [25]. Соответствующие свойства поверхности могут также способствовать прикреплению и пролиферации клеток, обеспечивая больше пространства для лучшего обмена газами и питательными веществами или адсорбции сывороточных белков [3, 5]. Будучи биоразлагаемыми полимерами, природные ПОБ и его сополимеры вызывают направленную активацию макрофагов и остеокластов — клеток, которые непосредственно способствуют их биодеградации, а скорость клеточной биодеградации непосредственно связана со способностью макрофагов и остеокластов адгезировать к поверхности полимеров и пролиферировать на ней. Поэтому и в случае исследования клеточной биодеградации ПОБ и его сополимеров микроструктура поверхности играет большую роль [46–49].
Нами было изучено влияние топографии поверхности пленок из ПОБ и его сополимеров в виде пористой структуры в форме сот различного диаметра и с разными геометрическими параметрами, а также в виде столбиков и бороздок [50]. Визуализация разнообразия морфологии клеток в зависимости от топографии подложки являлась ключевой целью этого исследования. Анализ взаимосвязи между формой клеток и подложкой позволил сравнить особенности прикрепления МСК к полученным полимерным пленкам из ПОБ и его сополимера ПОБВ с топографией в виде длинных продольных бороздок. В обоих случаях клетки были вытянуты в продольном направлении: клетки вытягивались вдоль углублений в структуре, прикрепляясь псевдоподиями к соседним выступам. Клетки, прикрепившиеся и растущие на поверхности пленок с топографией столбчатого типа, имели более распростертую форму, чем клетки на гладких пленках без выраженной топографии поверхности, где они не имели направления для ориентации псевдоподий и прикреплялись к углублениям в микроструктуре. МСК на пленках с топографией в виде сот имели различную форму, а их вытянутость и уплощенность были связаны с размером пор. Другие исследования [25, 33] показывают, что наличие пор и их размеры оказывают совершенно разное влияние на различные типы клеток. Кроме того, различные материалы по-разному влияют на прикрепление клеток, несмотря на одинаковый размер пор, и нет очевидной корреляции между размером пор и поведением клеток. Размер пор оказывает значительное влияние лишь на дифференциацию МСК и формирование тканей. Меньшие поры (5 мкм) пленки из ПЛА, которая по физическим характеристикам похожа на ПОБ, позволяют формировать более плотную ткань при образовании хряща, чем большие поры (20 мкм). Наличие пор позволяет клеткам удерживаться на пленке и контролировать площадь формирования ткани, в то время как от плоских поверхностей пленки клетки имеют тенденцию открепляться. В нашем исследовании мы не наблюдали влияния различных сополимеров на поведение клеток, однако установили влияние размеров пор на морфологию МСК [50].
Причиной наблюдаемой способности ПОБ индуцировать остеогенную дифференцировку МСК и остеобластоподобных клеток может быть не только специфическая микроструктура скаффолдов из этого полимера или топография их поверхности, но и собственная биологическая активность продуктов биодеградации этих ПОБ: олигомеров и 3-гидроксибутирата (3-ГБ). Показано, что 3-ГБ в концентрациях от 0,05 до 1,0 мМ способен как ускорять пролиферацию различных клеток [51, 52], так и стимулировать дифференцировку МСК и остеобластоподобных клеток в остеогенном направлении [53]. Выявлено также влияние 3-ГБ на рост и функциональную активность нейронов [54, 55]. Следует при этом отметить, что основной продукт биодеградации ПОБ — 3-ГБ — является обычным метаболитом в организме (так называемое кетоновое тело [56]) и обладает различными видами биологической активности. Влиять на пролиферацию и дифференцировку МСК и остеобластоподобных клеток могут как наночастицы из низкомолекулярного ПОБ, так и водорастворимые олигомеры ПОБ [51, 52, 57–59].
Сополимеризация ПОБ с другими полимерами дает возможность улучшить их механические свойства и гидрофильность. Так, ПОБ может быть химически модифицирован полиуретаном и 2-аминоэтилметакрилатом [60], что приводит к заметному улучшению механических свойств полученных из них скаффолдов. Химическая структура ПОБ, кроме применения химического синтеза для сополимеризации, может быть модифицирована гамма-облучением, что также позволяет изменить механические и биологические свойства ПОБ для их биомедицинского применения [61, 62].
Изготовление композитов из ПОБ и его сополимеров с другими биоматериалами является еще одним перспективным подходом для разработки скаффолдов с улучшенными физико-химическими и биологическими свойствами [63, 64]. Один материал далеко не всегда обладает сочетанием всех требуемых для эксплуатации медицинского изделия свойств. Поэтому в последние годы активно разрабатываются технологии изготовления скаффолдов из смесей и композитов ПОБ и его сополимеров с использованием различных биополимеров и минеральных веществ [65–67]. Разработка композитов частиц из ПОБ с минеральными биоматериалами (гидроксиапатитом [68, 69] или биостеклом [70–72]) для получения скаффолдов позволяет регулировать механические свойства, гидрофильность, скорость биодеградации композитных скаффолдов за счет сочетания физико-химических и биологических свойств каждого материала, а значит, управлять их взаимодействием с клетками. Гидроксиапатит широко используется в качестве заменителя кости благодаря своей биосовместимости и остеоиндуктивности, что приводит к регенерации кости в короткие сроки. Этот материал имеет химическое и структурное сходство с минеральной фазой нативной кости [73, 74]. Однако скаффолды из гидроксиапатита и другие изделия на его основе показали низкий модуль упругости (повышенную хрупкость), что ограничивает применение данного биоматериала для инженерии костной ткани. По этой причине его нельзя использовать для выполнения несущих функций при больших костных дефектах, и он применяется в основном в виде гранул, крошки и других сыпучих форм [73]. Поэтому подход к использованию скаффолдов на основе композитов ПОБ с гидроксиапатитом может быть особенно перспективным [64, 74, 75]. Так, показано, что добавление кератина и гидроксиапатита в форме наностержней в волокна изготовленного из ПОБ методом электроформования скаффолда приводит к значительному повышению их гидрофильности и механической жесткости [76]. Смешивание полимеров с гидроксиапатитом может быть использовано также для разработки систем пролонгированного высвобождения лекарств [77].
Наиболее сложным путем является разработка сложных разнонаправленных композитов из непрерывных волокон [63], в которых армирующая фаза и матрица будут представлены совершенно разными по своим физико-химическим свойствам материалами. Это наиболее биомиметическая структура композитов: спорокарп, древесина, эндокарп, коралл, губка, перламутр, кожа, хрящ, кость — композиты, состоящие из жесткой арматуры, пропитанной гидрогелеподобной матрицей. Композиты именно такой структуры создают наиболее естественную среду для роста клеток внутри них [78].
Полимеры и неорганические вещества, которые используют для изготовления композитов ПОБ, влияют на остеогенные свойства скаффолдов, полученных из них. Так, покрытие скаффолдов из сополимера П34ОБ, изготовленных методом быстрого 3D-прототипирования, полидопамином позволило функционализировать скаффолды ростовыми факторами, такими как BMP-2 [79]. Добавление наноразмерного гидроксиапатита к скаффолдам из композита ПОБ с кератином приводит к улучшению прикрепления остеобластоподобных клеток линии MG-63 и увеличению активности в них щелочной фосфатазы [76]. Покрытие скаффолдов из П34ОБ, полученных методом 3D-печати, полидопамином привело к обретению ими способности усиливать остеогенную дифференцировку МСК в остеогенной среде, что было продемонстрировано повышением активности щелочной фосфатазы, увеличением отложения солей кальция и повышением экспрессии остеокальцина в клетках [79].
Скаффолды из поли-3-оксибутирата и его сополимеров для инженерии костной ткани: исследования на моделях критических и некритических костных дефектов in vivo
Модельные исследования скаффолдов для инженерии костной ткани позволяют оценить свойства материалов на протяжении длительного времени и с учетом различных действующих факторов. При этом можно оценивать ткани не только в непосредственной близости от изделия, но в отдаленных участках организма, что особенно актуально для исследования обломков матриксов, частиц и др. У человека, например, остаточные элементы могут переноситься в такие органы, как печень и селезенка [80]. Однако не стоит забывать, что такие модели представляют собой лишь аппроксимированную картину того, как различные изделия поведут себя в организме на самом деле. При этом у каждой модели есть свои достоинства и недостатки. В настоящее время существует множество моделей для тестирования материалов имплантатов in vivo, начиная от оценки адсорбции белков компонентов крови и заканчивая исследованиями интеграции кости и разложения имплантата.
Для регламентации исследования медицинских материалов и изделий в Российской Федерации действует нормативный документ — ГОСТ ISO 10993-6—2011. В нем, в частности, описываются методы подкожной, внутримышечной и внутрикостной имплантации полимерных биоразлагаемых изделий в организм крысы, кролика, свиньи и др. Для оценки биосовместимости предлагается использовать различные параметры гистологического исследования, такие как воспаление, тканевая реакция, фиброз, некроз и другие [81].
С целью тестирования скаффолдов для ортопедии или челюстно-лицевой хирургии большинство исследователей создают искусственные костные дефекты. В исследованиях регенеративного потенциала скаффолдов на основе ПОБ и его сополимеров, их композитов и других биоматериалов используют два типа моделей таких дефектов: некритические костные дефекты (например, диаметром 1–3 мм у крыс), способные зарастать самостоятельно, и критические костные дефекты (например, с диаметром или линейными размерами более 6 мм у крыс), которые к самостоятельному восстановлению не способны. На лабораторных грызунах (крысах и мышах) такие дефекты обычно наносят на бедренные кости и на кости свода черепа, после чего исследуют регенерацию костной ткани с помощью методов компьютерной томографии, гистологии и иммуногистохимии.
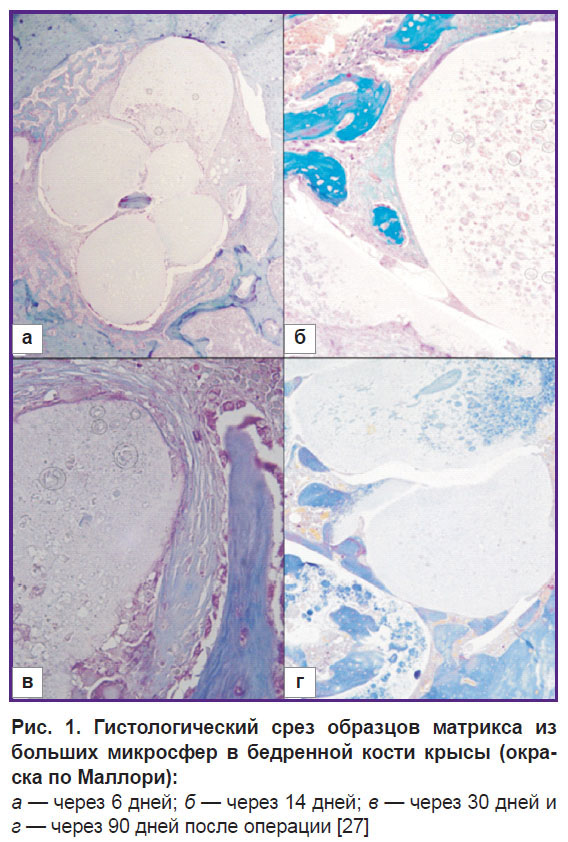
Остеоиндуктивные свойства ПОБ и его сополимеров проявляются не только in vitro, но и in vivo, когда скаффолды из этих полимеров использовались в качестве костнозамещающих биоматериалов и имплантировались в область критических и некритических костных дефектов. Продемонстрировано [13, 20, 82, 83], что скаффолды из ПОБ стимулируют регенерацию костной ткани и образование новой костной ткани (выявлено методами гистологии и иммуногистохимии по экспрессии маркеров развития костной ткани, таких как остеопонтин и коллаген I типа). Нами ранее на некритическом дефекте костной ткани показано [27, 84, 85], что пористые микросферы из ПОБ стимулируют прорастание сосудов в порах микросфер и образование в порах новой ретикуло-фиброзной костной ткани (на 6-й день), островки которой на более поздних сроках (30-й день) начинают сливаться друг с другом и в конечном итоге (через 100 дней) новообразованная пластинчатая кость полностью заполняет микросферы, что сопровождается активной резорбцией и замещением полимерного материала. При этом мы не наблюдали формирования фиброзной капсулы вокруг имплантата из ПОБ, что указывает на полную интеграцию биоматериала с костной тканью (рис. 1).
Другие исследователи на модели некритического костного дефекта также показали, что ПОБ и его сополимеры способствуют регенерации костной ткани. Так, было продемонстрировано, что имплантация скаффолдов из нанокомпозита Mg2SiO4-CuFe2O4, покрытых ПОБ, в бедренную кость крысы на 8 нед привела к улучшению регенерации костной ткани по сравнению с контролем, на что указали результаты микрокомпьютерной томографии, в том числе анализ объемной фракции костной ткани и толщины трабекул [19].
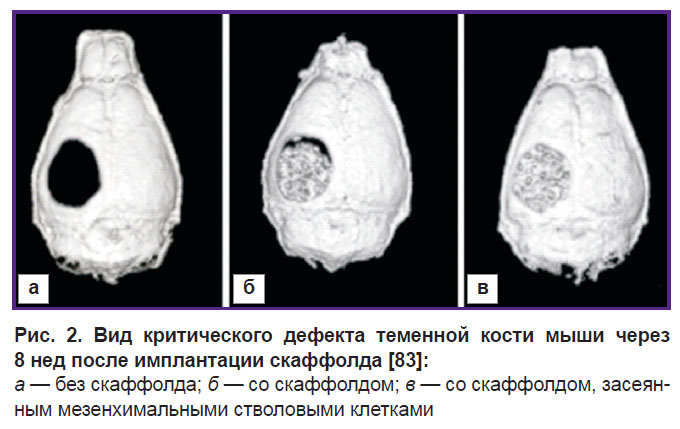
Многим исследователям [82–84] успешно удается восстанавливать костные дефекты с использованием, в частности, МСК, выделяемых из костного мозга, а также полученных из жировой ткани стромальных клеток. Так, были созданы в правой теменной кости взрослых голых (nude) мышей линии BALB/c незаживающие, критического размера (4 мм) дефекты свода черепа с помощью бормашины [83]. Пористый керамический скаффолд на основе композита из 60% гидроксиапатита и 40% β-ортофосфата кальция был помещен в область дефекта непосредственно после его нанесения. В контрольной группе костные дефекты оставались незакрытыми, лишь покрываясь со временем кожей. Мышей в течение 8 нед исследовали с помощью методов микрокомпьютерной томографии и в конце этого срока вывели из эксперимента. Скаффолды предварительно засевали человеческими МСК. В качестве дополнительного контроля части животных был введен скаффолд без клеток. Вид дефектов приведен на рис. 2. Результаты этого исследования показали, что МСК на скаффолде хорошо подходят для лечения таких черепных дефектов у мыши.
Другая группа ученых [82] проводила похожие исследования, однако матрикс у них был загружен хемоаттрактантом — фактором стромальных клеток (SDF-1α). Этот белок заставлял МСК двигаться по градиенту его концентрации, что также приводило к восстановлению дефекта черепа критического размера.
Следует отметить, что российский ГОСТ не рекомендует проводить исследования на костной ткани мелких грызунов, таких как крысы и мыши, ввиду того, что предписанный в нем минимальный размер дефекта (2 мм) трудно поместить на мелких костях [81]. Однако в силу удобства работы на грызунах такие исследования все же проводятся, а кости выбираются наиболее крупные. Именно поэтому так часто встречаются модели именно на черепе крыс и мышей. Крысы в этом плане являются более подходящими, так как их кости значительно крупнее.
Прежде чем привести примеры исследований скаффолдов из ПОБ и его сополимеров на костных дефектах, следует упомянуть интересную работу C. Rentsch с соавт [85]. Они провели бестимусным крысам подкожную имплантацию скаффолда из ПОБ, изготовленного машинным плетением, который был покрыт коллагеном и/или хондроитинсульфатом и засеян МСК. Через 6 нед после имплантации они обнаружили, что в соединительнотканной капсуле вокруг скаффолда происходит активная васкуляризация и повышена экспрессия остеогенных маркеров: коллагена I типа, остеопонтина, остеонектина, остеокальцина и сиалопротеина костей, хотя гетеротопической оссификации не наблюдалось. В другом исследовании немецких ученых [86] с использованием такого же скаффолда на основе ПОБ, засеянного первичными остеобластами, которые выделили из костной ткани челюсти, в сравнении со скаффолдом из композита гидроксиапатита с коллагеном, при внутримышечной их имплантации бестимусным голым крысам было продемонстрировано более выраженное эктопическое формирование костной ткани в случае использования скаффолда на основе ПОБ.
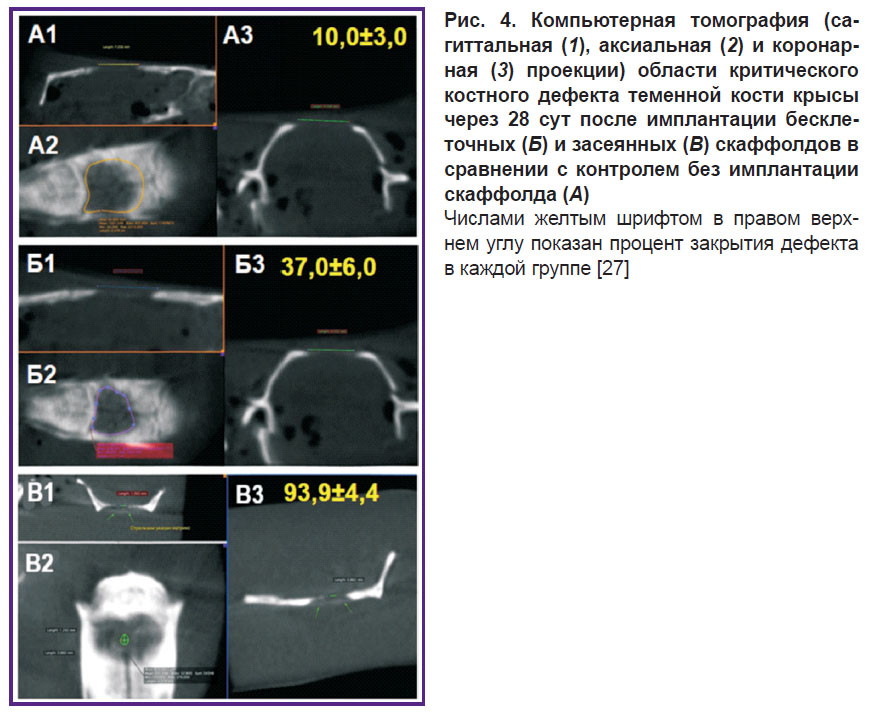
Наиболее показательным исследованием на критическом костном дефекте является работа T. Gredes с коллегами [87]. Исследователи наносили на череп крысы сразу два дефекта, расположенных рядом. За счет этого достигалась большая чистота эксперимента, так как экспериментальный, т.е. восстанавливаемый с помощью матрикса, и контрольный (без имплантации) дефекты находились в абсолютно равных условиях на одном животном (рис. 3). Это было сделано с помощью трепана при постоянной промывке раневой поверхности. В данном эксперименте заплата из ПОБ показала хорошую способность к восстановлению костной ткани. Через 12 нед после имплантации происходило зарастание костных дефектов на 54%, которое сопровождалось выраженной васкуляризацией и значительно повышенной по сравнению с контролем экспрессией остеогенных маркеров: щелочной фосфатазы 1-го типа, коллагена альфа-1 типа I и фактора роста эндотелия сосудов А, что свидетельствует о выраженном остеоиндуктивном эффекте.
|
Рис. 3. Два дефекта кости, нанесенные рядом друг с другом одному животному, и дефект, закрытый накладкой из поли-3-оксибутирата [87] |
В другом исследовании [34] использовали двусторонний критический костный дефект теменной кости. Диаметр каждого дефекта — 5 мм, один из них был закрыт волокнистым скаффолдом из сополимера П34ОБ. Через 12 нед после операции визуально наблюдалось много новых костных образований. В области дефекта с имплантированным скаффолдом из П34ОБ отмечено большее количество полосатых коллагеновых пучков на 4-й неделе и новообразованной костной ткани в области дефекта — на 12-й неделе по сравнению с контрольной группой без использования скаффолда. Разрозненные коллагеновые пучки исходили от краев дефектов и тянулись в скаффолды, разрастаясь вдоль их полимерных волокон. Более того, у края дефекта наблюдались более плотные коллагеновые пучки в виде ретикуло-фиброзной костной ткани, что указывает на возможность электроформованных скаффолдов из П34ОБ способствовать созреванию костной ткани.
В исследовании на одиночном критическом костном дефекте теменной кости крысы диаметром 5 мм [79] показано, что напечатанные на 3D-принтере скаффолды из П34ОБ, покрытые полидопамином с адгезированным к этому слою человеческим рекомбинантным ростовым фактором BMP-2, продемонстрировали выраженную способность ускорять регенерацию костной ткани: в меньшей степени для скаффолдов из П34ОБ, не покрытых и покрытых полидопамином, и в большей степени для скаффолдов, содержащих BMP-2. В работе T. Higuchi с соавт. [88] исследователи наносили похожий дефект, но только на нижнюю челюсть крысы с последующим введением скаффолда из композита ПМГК с коллагеном, загруженного BMP-2. Затем мышечные волокна и кожа сшивались. Через 2 нед на выведенных из эксперимента крысах проводили исследование остеогенеза. Показано, что через 4 нед в группе с использованием скаффолда, не содержащего ростовой фактор, наблюдалось лишь минимальное формирование новообразованной костной ткани, тогда как при использовании скаффолда, загруженного BMP-2, регенерация костной ткани происходила гораздо активнее, что свидетельствует об отсутствии остеоиндуктивных свойств у синтетического ПМГК.
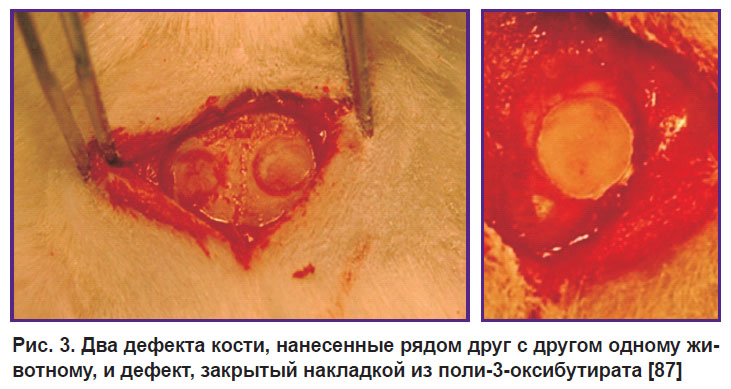
Нами ранее [27] было показано на одиночном критическом дефекте теменной кости крысы диаметром 8 мм при использовании скаффолда из ПОБ, заполненного альгинатным гидрогелем, что он через 28 сут после имплантации для закрытия области дефекта способен вызывать активную регенерацию костной ткани с восстановлением дефекта на 37%, а скаффолд, засеянный МСК, вызывал восстановление критического костного дефекта на 94% (рис. 4).
Другие же модели дефектов используются в восстановлении скелетных компонентов, вовлеченных в опорно-двигательную систему, таких как, например, бедренная кость. Следует отметить, что нас в первую очередь снова интересуют модели на грызунах в силу простоты работы с этими животными, а также доступности таких экспериментов. M.S. Virk [89] с коллегами в своей работе использовали довольно распространенный подход. Они вырезали сегмент диафиза бедренной кости крысы критического размера, следуя протоколам Institutional Animal Care and Use Committee. Под критическим здесь понимается такой размер дефекта, который самостоятельно, без ортопедической помощи срастись правильным образом уже не может. Эта работа интересна тем, что в ней не используется каркасный матрикс, а лишь проводится системное введение антител, блокирующих склеростин — белок-антагонист, регулирующий распространение остеобластов при формировании кости. Фиксация кости при этом осуществляется с помощью каркасных элементов. На рис. 5 хорошо виден эффект от воздействия антител на остеогенез и заживление дефекта. Куски кости значительно лучше срастаются по сравнению с контрольным образцом.
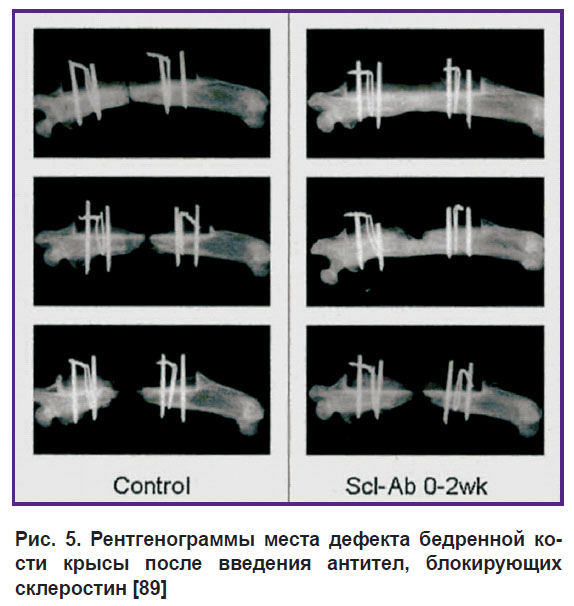
|
Рис. 5. Рентгенограммы места дефекта бедренной кости крысы после введения антител, блокирующих склеростин [89] |
Подобные работы в большей степени распространены среди приверженцев использования биоматериалов и ортопедических имплантатов из них. Так, A. Berner с соавт. [90] применяет эту модель для тестирования заминерализированной трубки из электроформованного полотна на основе поликапролактона. Похожим образом сделанный дефект (рис. 6) [90] при этом дополнительно фиксируется железной арматурой. С помощью уже агониста остеогенеза — белка BMP-7 — проводится хорошее замещение матрикса костной тканью. Ход эксперимента также контролировали с помощью микро-КТ и рентгенографии. Кроме того, данная группа проводила биомеханическое исследование новообразованной кости ex vivo.
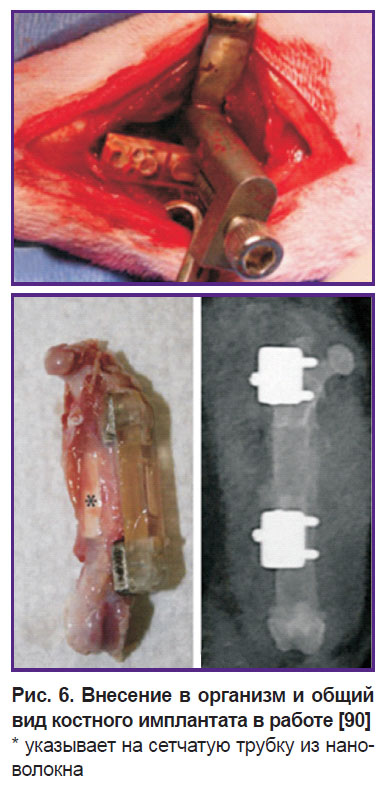
|
Рис. 6. Внесение в организм и общий вид костного имплантата в работе [90] * указывает на сетчатую трубку из нановолокна |
У большого количества исследователей (например, W. Li с соавт. [91] и других) эксперимент проводился таким же образом, что обусловлено логичностью применения данной модели для тестирования различных подходов к остеонеогенезу, хотя пути решения этой проблемы у авторов сильно разнятся.
Следует отметить, что рассмотренные модели критических дефектов применяются на более поздних стадиях доклинических исследований, когда биобезопасность остеопластического материала уже доказана и исследователей интересует его терапевтическая эффективность. Когда же перед ученым стоит вопрос не количественный (за сколько времени и с какой эффективностью произойдет восстановление данного дефекта), а качественный, т.е. происходит ли вообще образование клеток костной ткани, то зачастую достаточно лишь небольшого отверстия в бедренной кости. Например, в работе W. Feng с соавт. [92] гистохимическими методами исследовали остеогенную дифференцировку стволовых клеток, выделенных из жировой ткани, в месте высверленного костного дефекта размером 3×5×5 мм (рис. 7).
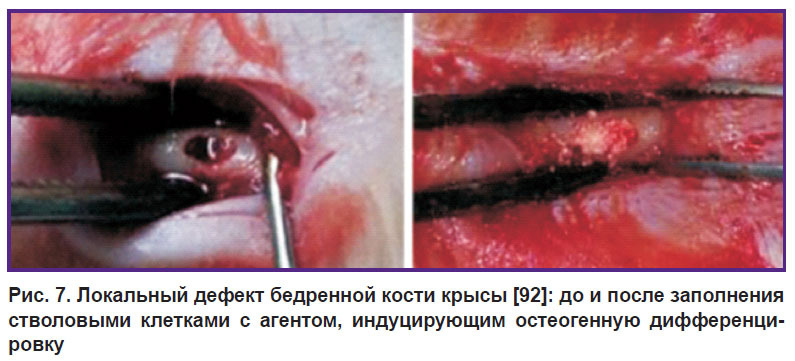
|
Рис. 7. Локальный дефект бедренной кости крысы [92]: до и после заполнения стволовыми клетками с агентом, индуцирующим остеогенную дифференцировку |
Заключение
Остеоиндуктивные свойства, которые проявляют поли-3-оксибутират и продукты его биодеградации, делают этот полимер перспективным материалом для инженерии костной ткани. Скаффолды и микросферы на основе поли-3-оксибутирата и его сополимеров могут быть использованы для разработки остеопластического материала для восстановления костных дефектов в челюстно-лицевой хирургии и ортопедии, который будет обладать не только остеокондуктивными, но и остеоиндуктивными свойствами. Кроме того, они могут служить платформой для разработки целого ряда изделий, обладающих дополнительными видами биоактивности, вследствие наполнения различными агентами: низкомолекулярными лекарственными веществами, пептидами, ростовыми факторами, экзосомами, стволовыми клетками.
Вклад авторов: А.А. Венедиктов, Н.Н. Диденко, Е.М. Бойко — написание раздела «Скаффолды из поли-3-оксибутирата и его сополимеров для инженерии костной ткани: исследования на клеточных культурах in vitro»; А.П. Бонарцев, В.В. Воинова — написание раздела «Скаффолды из поли-3-оксибутирата и его сополимеров для инженерии костной ткани: исследования на моделях критических и некритических костных дефектов in vivo»; А.А. Мураев, А.В. Волков — написание раздела «Введение»; А.А. Долгалев — написание раздела «Заключение».
Финансирование. Работа выполнена при финансовой поддержке гранта Российского научного фонда №20-64-47008 в части раздела «Скаффолды из ПОБ и его сополимеров для инженерии костной ткани: исследования на моделях критических и некритических костных дефектов in vivo» по аффиляции Московского государственного университета им. М.В. Ломоносова.
Конфликт интересов отсутствует.
Литература
- Paschos N.K., Brown W.E., Eswaramoorthy R., Hu J.C., Athanasiou K.A. Advances in tissue engineering through stem cell-based co-culture. J Tissue Eng Regen Med 2015; 9(5): 488–503, https://doi.org/10.1002/term.1870.
- Oryan A., Alidadi S., Moshiri A., Maffulli N. Bone regenerative medicine: classic options, novel strategies, and future directions. J Orthop Surg Res 2014; 9(1): 18, https://doi.org/10.1186/1749-799x-9-18.
- Koons G.L., Diba M., Mikos A.G. Materials design for bone-tissue engineering. Nat Rev Mater 2020; 5: 584–603, https://doi.org/10.1038/s41578-020-0204-2.
- Wei G., Ma P.X. Polymeric biomaterials for tissue engineering. In: Tissue engineering using ceramics and polymers. 2nd edition. Boccaccini A.R., Ma P.X. (editors). Cambridge: Elsewier; 2014; p. 35–66, https://doi.org/10.1533/9780857097163.1.35.
- Lim J., You M., Li J., Li Z. Emerging bone tissue engineering via polyhydroxyalkanoate (PHA)-based scaffolds. Mater Sci Eng C Mater Biol Appl 2017; 79: 917–929, https://doi.org/10.1016/j.msec.2017.05.132.
- Farah S., Anderson D.G., Langer R. Physical and mechanical properties of PLA, and their functions in widespread applications — a comprehensive review. Adv Drug Deliv Rev 2016; 107: 367–392, https://doi.org/10.1016/j.addr.2016.06.012.
- Feng Y., Zhu S., Mei D., Li J., Zhang J., Yang S., Guan S. Application of 3D printing technology in bone tissue engineering: a review. Curr Drug Deliv 2021; 18(7): 847–861, https://doi.org/10.2174/1567201817999201113100322.
- Chahal S., Kumar A., Hussian F.S.J. Development of biomimetic electrospun polymeric biomaterials for bone tissue engineering. A review. J Biomater Sci Polym Ed 2019; 30(14): 1308–1355, https://doi.org/10.1080/09205063.2019.1630699.
- Murray I.R., West C.C., Hardy W.R., James A.W., Park T.S., Nguyen A., Tawonsawatruk T., Lazzari L., Soo C., Péault B. Natural history of mesenchymal stem cells, from vessel walls to culture vessels. Cell Mol Life Sci 2014; 71(8): 1353–1374, https://doi.org/10.1007/s00018-013-1462-6.
- Shang F., Yu Y., Liu S., Ming L., Zhang Y., Zhou Z., Zhao J., Jin Y. Advancing application of mesenchymal stem cell-based bone tissue regeneration. Bioact Mater 2020; 6(3): 666–683, https://doi.org/10.1016/j.bioactmat.2020.08.014.
- Marolt Presen D., Traweger A., Gimona M., Redl H. Mesenchymal stromal cell-based bone regeneration therapies: from cell transplantation and tissue engineering to therapeutic secretomes and extracellular vesicles. Front Bioeng Biotechnol 2019; 7: 352, https://doi.org/10.3389/fbioe.2019.00352.
- Mokhtarzadeh A., Alibakhshi A., Hejazi M., Omidi Y., Dolatabadi J.E.N. Bacterial-derived biopolymers: advanced natural nanomaterials for drug delivery and tissue engineering. Trends Anal Chem 2016; 82: 367–384, https://doi.org/10.1016/j.trac.2016.06.013.
- Bonartsev A.P. Poly(3-hydroxybutyrate): applications. In: Encyclopedia of polymer applications. Mishra M. (editor). Boca Raton: CRC Press; 2019; p. 2061–2076.
- Wang Y.W., Wu Q., Chen G.Q. Attachment, proliferation and differentiation of osteoblasts on random biopolyester poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) scaffolds. Biomaterials 2004; 25(4): 669–675, https://doi.org/10.1016/s0142-9612(03)00561-1.
- Misra S.K., Ansari T., Mohn D., Valappil S.P., Brunner T.J., Stark W.J., Roy I., Knowles J.C., Sibbons P.D., Jones E.V., Boccaccini A.R., Salih V. Effect of nanoparticulate bioactive glass particles on bioactivity and cytocompatibility of poly(3-hydroxybutyrate) composites. J R Soc Interface 2010; 7(44): 453–465, https://doi.org/10.1098/rsif.2009.0255.
- Hosseini F.S., Soleimanifar F., Aidun A., Enderami S.E., Saburi E., Marzouni H.Z., Khani M.M., Khojasteh A., Ardeshirylajimi A. Poly (3-hydroxybutyrate-co-3-hydroxyvalerate) improved osteogenic differentiation of the human induced pluripotent stem cells while considered as an artificial extracellular matrix. J Cell Physiol 2019; 234(7): 11537–11544, https://doi.org/10.1002/jcp.27807.
- Lü L.X., Wang Y.Y., Mao X., Xiao Z.D., Huang N.P. The effects of PHBV electrospun fibers with different diameters and orientations on growth behavior of bone-marrow-derived mesenchymal stem cells. Biomed Mater 2012; 7(1): 015002, https://doi.org/10.1088/1748-6041/7/1/015002.
- Bretcanu O., Misra S., Roy I., Renghini C., Fiori F., Boccaccini A.R., Salih V. In vitro biocompatibility of 45S5 Bioglass-derived glass-ceramic scaffolds coated with poly(3-hydroxybutyrate). J Tissue Eng Regen Med 2009; 3(2): 139–148, https://doi.org/10.1002/term.150.
- Aghajanian A.H., Bigham A., Sanati A., Kefayat A., Salamat M.R., Sattary M., Rafienia M. A 3D macroporous and magnetic Mg2SiO4-CuFe2O4 scaffold for bone tissue regeneration: surface modification, in vitro and in vivo studies. Biomater Adv 2022; 137: 212809, https://doi.org/10.1016/j.bioadv.2022.212809.
- Shumilova A.A., Myltygashev M.P., Kirichenko A.K., Nikolaeva E.D., Volova T.G., Shishatskaya E.I. Porous 3D implants of degradable poly-3-hydroxybutyrate used to enhance regeneration of rat cranial defect. J Biomed Mater Res A 2017; 105(2): 566–577, https://doi.org/10.1002/jbm.a.35933.
- Köse G.T., Korkusuz F., Korkusuz P., Purali N., Ozkul A., Hasirci V. Bone generation on PHBV matrices: an in vitro study. Biomaterials 2003; 24(27): 4999–5007, 14559013, https://doi.org/10.1016/s0142-9612(03)00417-4.
- Bonartsev A.P., Zharkova I.I., Yakovlev S.G., Myshkina V.L., Makhina T.K., Zernov A.L., Kudryashova K.S., Feofanov A.V., Akulina E.A., Ivanova E.V., Zhuikov V.A., Volkov A.V., Andreeva N.V., Voinova V.V., Bonartseva G.A., Shaitan K.V., Kirpichnikov M.P. 3D scaffolds from poly(3-hydroxybutyrate)-poly(ethylene glycol) copolymer. J Biomater Tissue Eng 2016; 6(1): 42–52, https://doi.org/10.1166/jbt.2016.1414.
- Wang Y., Jiang X.L., Peng S.W., Guo X.Y., Shang G.G., Chen J.C., Wu Q., Chen G.Q. Induced apoptosis of osteoblasts proliferating on polyhydroxyalkanoates. Biomaterials 2013; 34(15): 3737–3746, https://doi.org/10.1016/j.biomaterials.2013.01.088.
- Hu Y.J., Wei X., Zhao W., Liu Y.S., Chen G.Q. Biocompatibility of poly(3-hydroxybutyrate-co-3-hydroxyvalerate-co-3-hydroxyhexanoate) with bone marrow mesenchymal stem cells. Acta Biomater 2009; 5(4): 1115–1125, https://doi.org/10.1016/j.actbio.2008.09.021.
- Yu B.Y., Chen P.Y., Sun Y.M., Lee Y.T., Young T.H. Response of human mesenchymal stem cells (hMSCs) to the topographic variation of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) (PHBHHx) films. J Biomater Sci Polym Ed 2012; 23(1–4): 1–26, https://doi.org/10.1163/092050610x541386.
- Lomas A.J., Chen G.G., El Haj A.J., Forsyth N.R. Poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) supports adhesion and migration of mesenchymal stem cells and tenocytes. World J Stem Cells 2012; 4(9): 94–100, https://doi.org/10.4252/wjsc.v4.i9.94.
- Volkov A.V., Muraev A.A., Zharkova I.I., Voinova V.V., Akoulina E.A., Zhuikov V.A., Khaydapova D.D., Chesnokova D.V., Menshikh K.A., Dudun A.A., Makhina T.K., Bonartseva G.A., Asfarov T.F., Stamboliev I.A., Gazhva Y.V., Ryabova V.M., Zlatev L.H., Ivanov S.Y., Shaitan K.V., Bonartsev A.P. Poly(3-hydroxybutyrate)/hydroxyapatite/alginate scaffolds seeded with mesenchymal stem cells enhance the regeneration of critical-sized bone defect. Mater Sci Eng C Mater Biol Appl 2020; 114: 110991, https://doi.org/10.1016/j.msec.2020.110991.
- Lü L.X., Zhang X.F., Wang Y.Y., Ortiz L., Mao X., Jiang Z.L., Xiao Z.D., Huang N.P. Effects of hydroxyapatite-containing composite nanofibers on osteogenesis of mesenchymal stem cells in vitro and bone regeneration in vivo. ACS Appl Mater Interfaces 2013; 5(2): 319–330, https://doi.org/10.1021/am302146w.
- de Paula A.C., Zonari A.A., Martins T.M., Novikoff S., da Silva A.R., Correlo V.M., Reis R.L., Gomes D.A., Goes A.M. Human serum is a suitable supplement for the osteogenic differentiation of human adipose-derived stem cells seeded on poly-3-hydroxibutyrate-co-3-hydroxyvalerate scaffolds. Tissue Eng Part A 2013; 19(1–2): 277–289, https://doi.org/10.1089/ten.tea.2012.0189.
- Gorodzha S.N., Muslimov A.R., Syromotina D.S., Timin A.S., Tcvetkov N.Y., Lepik K.V., Petrova A.V., Surmeneva M.A., Gorin D.A., Sukhorukov G.B., Surmenev R.A. A comparison study between electrospun polycaprolactone and piezoelectric poly(3-hydroxybutyrate-co-3-hydroxyvalerate) scaffolds for bone tissue engineering. Colloids Surf B Biointerfaces 2017; 160: 48–59, https://doi.org/10.1016/j.colsurfb.2017.09.004.
- Cool S.M., Kenny B., Wu A., Nurcombe V., Trau M., Cassady A.I., Grøndahl L. Poly(3-hydroxybutyrate-co-3-hydroxyvalerate) composite biomaterials for bone tissue regeneration: in vitro performance assessed by osteoblast proliferation, osteoclast adhesion and resorption, and macrophage proinflammatory response. J Biomed Mater Res A 2007; 82(3): 599–610, https://doi.org/10.1002/jbm.a.31174.
- Köse G.T., Ber S., Korkusuz F., Hasirci V. Poly(3-hydroxybutyric acid-co-3-hydroxyvaleric acid) based tissue engineering matrices. J Mater Sci Mater Med 2003; 14(2): 121–126, https://doi.org/10.1023/a:1022063628099.
- Wang Y., Gao R., Wang P.P., Jian J., Jiang X.L., Yan C., Lin X., Wu L., Chen G.Q., Wu Q. The differential effects of aligned electrospun PHBHHx fibers on adipogenic and osteogenic potential of MSCs through the regulation of PPARγ signaling. Biomaterials 2012; 33(2): 485–493, 22014456, https://doi.org/10.1016/j.biomaterials.2011.09.089.
- Liu W., Jiao T., Su Y., Wei R., Wang Z., Liu J., Fu N., Sui L. Electrospun porous poly(3-hydroxybutyrate-co-4-hydroxybutyrate)/lecithin scaffold for bone tissue engineering. RSC Adv 2022; 12(19): 11913–11922, https://doi.org/10.1039/d2ra01398c.
- Zonari A., Novikoff S., Electo N.R., Breyner N.M., Gomes D.A., Martins A., Neves N.M., Reis R.L., Goes A.M. Endothelial differentiation of human stem cells seeded onto electrospun polyhydroxybutyrate/polyhydroxybutyrate-co-hydroxyvalerate fiber mesh. PLoS One 2012; 7(4): e35422, https://doi.org/10.1371/journal.pone.0035422.
- Sundaramurthi D., Krishnan U.M., Sethuraman S. Epidermal differentiation of stem cells on poly(3-hydroxybutyrate-co-3-hydroxyvalerate) (PHBV) nanofibers. Ann Biomed Eng 2014; 42(12): 2589–2599, https://doi.org/10.1007/s10439-014-1124-3.
- Fischer D., Li Y., Ahlemeyer B., Krieglstein J., Kissel T. In vitro cytotoxicity testing of polycations: influence of polymer structure on cell viability and hemolysis. Biomaterials 2003; 24(7): 1121–1131, https://doi.org/10.1016/s0142-9612(02)00445-3.
- Wang Y.W., Yang F., Wu Q., Cheng Y.C., Yu P.H., Chen J., Chen G.Q. Effect of composition of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) on growth of fibroblast and osteoblast. Biomaterials 2005; 26(7): 755–761, https://doi.org/10.1016/j.biomaterials.2004.03.023.
- Ostwald J., Dommerich S., Nischan C., Kramp B. In vitro culture of cells from respiratory mucosa on foils of collagen, poly-L-lactide (PLLA) and poly-3-hydroxy-butyrate (PHB). Laryngorhinootologie 2003; 82(10): 693–699, https://doi.org/10.1055/s-2003-43238.
- Chanvel-Lesrat D.J., Pellen-Mussi P., Auroy P., Bonnaure-Mallet M. Evaluation of the in vitro biocompatibility of various elastomers. Biomaterials 1999; 20(3): 291–299, https://doi.org/10.1016/s0142-9612(98)00181-1.
- Wollenweber M., Domaschke H., Hanke T., Boxberger S., Schmack G., Gliesche K., Scharnweber D., Worch H. Mimicked bioartificial matrix containing chondroitin sulphate on a textile scaffold of poly(3-hydroxybutyrate) alters the differentiation of adult human mesenchymal stem cells. Tissue Eng 2006; 12(2): 345–359, https://doi.org/10.1089/ten.2006.12.345.
- Criscenti G., Vasilevich A., Longoni A., De Maria C., van Blitterswijk C.A., Truckenmuller R., Vozzi G., De Boer J., Moroni L. 3D screening device for the evaluation of cell response to different electrospun microtopographies. Acta Biomater 2017; 55: 310–322, https://doi.org/10.1016/j.actbio.2017.03.049.
- Boyan B.D., Hummert T.W., Dean D.D., Schwartz Z. Role of material surfaces in regulating bone and cartilage cell response. Biomaterials 1996; 17(2): 137–146, https://doi.org/10.1016/0142-9612(96)85758-9.
- Bowers K.T., Keller J.C., Randolph B.A., Wick D.G., Michaels C.M. Optimization of surface micromorphology for enhanced osteoblasts responses in vitro. Int J Oral Maxillofac Implants 1992; 7(3): 302–310.
- Cochran D., Simpson J., Weber H.P., Buser D. Attachment and growth of periodontal cells on smooth and rough titanium. Int J Oral Max Impl 1994; 9(3): 289–297.
- Saad B., Ciardelli G., Matter S., Welti M., Uhlschmid G.K., Neuenschwander P., Suter U.W. Characterization of the cell response of cultured macrophages and fibroblasts to particles of short-chain poly[(R)-3-hydroxybutyric acid]. J Biomed Mater Res 1996; 30(4): 429–439, https://doi.org/10.1002/(sici)1097-4636(199604)30:4429::aid-jbm13.0.co;2-r.
- Wu A.C., Grøndahl L., Jack K.S., Foo M.X., Trau M., Hume D.A., Cassady A.I. Reduction of the in vitro pro-inflammatory response by macrophages to poly(3-hydroxybutyrate-co-3-hydroxyvalerate). Biomaterials 2006; 27(27): 4715–4725, https://doi.org/10.1016/j.biomaterials.2006.05.010.
- Menzyanova N.G., Pyatina S.А., Nikolaeva E.D., Shabanov A.V., Nemtsev I.V., Stolyarov D.P., Dryganov D.B., Sakhnov E.V., Shishatskaya E.I. Screening of biopolymeric materials for cardiovascular surgery toxicity — evaluation of their surface relief with assessment of morphological aspects of monocyte/macrophage polarization in atherosclerosis patients. Toxicol Rep 2018; 6: 74–90, https://doi.org/10.1016/j.toxrep.2018.11.009.
- Bat E., van Kooten T.G., Feijen J., Grijpma D.W. Macrophage-mediated erosion of gamma irradiated poly(trimethylene carbonate) films. Biomaterials 2009; 30(22): 3652–3661, https://doi.org/10.1016/j.biomaterials.2009.03.033.
- Kulikouskaya V.I., Nikalaichuk V.V., Bonartsev A.P., Akoulina E.A., Belishev N.V., Demianova I.V., Chesnokova D.V., Makhina T.K., Bonartseva G.A., Shaitan K.V., Hileuskaya K.S., Voinova V.V. Honeycomb-structured porous films from poly(3-hydroxybutyrate) and poly(3-hydroxybutyrate-co-3-hydroxyvalerate): physicochemical characterization and mesenchymal stem cells behavior. Polymers (Basel) 2022; 14(13): 2671, https://doi.org/10.3390/polym14132671.
- Cheng S., Chen G.Q., Leski M., Zou B., Wang Y., Wu Q. The effect of D,L-β-hydroxybutyric acid on cell death and proliferation in L929 cells. Biomaterials 2006; 27(20): 3758–3765, https://doi.org/10.1016/j.biomaterials.2006.02.046.
- Cheng S., Wu Q., Yang F., Xu M., Leski M., Chen G.Q. Influence of DL-3-hydroxybutyric acid on cell proliferation and calcium influx. Biomacromolecules 2005; 6(2): 593–597, https://doi.org/10.1021/bm049465y.
- Zhao Y., Zou B., Shi Z., Wu Q., Chen G.Q. The effect of 3-hydroxybutyrate on the in vitro differentiation of murine osteoblast MC3T3-E1 and in vivo bone formation in ovariectomized rats. Biomaterials 2007; 28(20): 3063–3073, https://doi.org/10.1016/j.biomaterials.2007.03.003.
- Zou X.H., Li H.M., Wang S., Leski M., Yao Y.C., Yang X.D., Huang Q.J., Chen G.Q. The effect of 3-hydroxybutyrate methyl ester on learning and memory in mice. Biomaterials 2009; 30(8): 1532–1541, https://doi.org/10.1016/j.biomaterials.2008.12.012.
- Zhang J., Cao Q., Li S., Lu X., Zhao Y., Guan J.S., Chen J.C., Wu Q., Chen G.Q. 3-hydroxybutyrate methyl ester as a potential drug against Alzheimer’s disease via mitochondria protection mechanism. Biomaterials 2013; 34(30): 7552–7562, https://doi.org/10.1016/j.biomaterials.2013.06.043.
- Lehninger principles of biochemistry. 5th edition. Nelson D.L., Cox M.M. (editors). New York: W.H. Freeman and Company; 2008; p. 852–860.
- Saad B., Ciardelli G., Matter S., Welti M., Uhlschmid G.K., Neuenschwander P., Suter U.W. Degradable and highly porous polyesterurethane foam as biomaterial: effects and phagocytosis of degradation products in osteoblasts. J Biomed Mater Res 1998; 39(4): 594–602, https://doi.org/10.1002/(sici)1097-4636(19980315) 39:4594::aid-jbm143.0.co;2-7.
- Ji Y., Li X.T., Chen G.Q. Interactions between a poly(3-hydroxybutyrate-co-3-hydroxyvalerate-co-3-hydroxyhexanoate) terpolyester and human keratinocytes. Biomaterials 2008; 29(28): 3807–3814, https://doi.org/10.1016/j.biomaterials.2008.06.008.
- Yang X.D., Zou X.H., Dai Z.W., Luo R.C., Wei C.J., Chen G.Q. Effects of oligo(3-hydroxyalkanoates) on the viability and insulin secretion of murine beta cells. J Biomater Sci Polym Ed 2009; 20(12): 1729–1746, https://doi.org/10.1163/156856208x386291.
- Torres M.G. Polyurethane/urea composite scaffolds based on poly(3-hydroxybutyrate-g-2-amino-ethyl methacrylate). Compos B Eng 2019; 160: 362–368, https://doi.org/10.1016/j.compositesb.2018.12.090.
- Reyes A.P., Martínez Torres A., Carreón Castro Mdel P., Rodríguez Talavera J.R., Muñoz S.V., Aguilar V.M., Torres M.G. Novel poly(3-hydroxybutyrate-g-vinyl alcohol) polyurethane scaffold for tissue engineering. Sci Rep 2016; 6: 31140, https://doi.org/10.1038/srep31140.
- Torres M.G. 3D-composite scaffolds from radiation-induced chitosan grafted poly(3-hydroxybutyrate) polyurethane. Mater Today Commun 2020; 23: 100902, https://doi.org/10.1016/j.mtcomm.2020.100902.
- Daniel I.M., Ori I. Engineering mechanics of composite materials. 2nd edition. Oxford University Press; 2006.
- Sefat F., Mozafari M., Atala A. Introduction to tissue engineering scaffolds. In: Handbook of tissue engineering scaffolds: volume one. Elsevier; 2019, p. 3–22, https://doi.org/10.1016/b978-0-08-102563-5.00001-0.
- Houben A., Van Hoorick J., Van Erps J., Thienpont H., Van Vlierberghe S., Dubruel P. Indirect rapid prototyping: opening up unprecedented opportunities in scaffold design and applications. Ann Biomed Eng 2017; 45(1): 58–83, https://doi.org/10.1007/s10439-016-1610-x.
- Salvatore L., Carofiglio V.E., Stufano P., Bonfrate V., Calò E., Scarlino S., Nitti P., Centrone D., Cascione M., Leporatti S., Sannino A., Demitri C., Madaghiele M. Potential of electrospun poly(3-hydroxybutyrate)/collagen blends for tissue engineering applications. J Healthc Eng 2018; 2018: 6573947, https://doi.org/10.1155/2018/6573947.
- Wang Z., Ma K., Jiang X., Xie J., Cai P., Li F., Liang R., Zhao J., Zheng L. Electrospun poly(3-hydroxybutyrate-co-4-hydroxybutyrate)/octacalcium phosphate nanofibrous membranes for effective guided bone regeneration. Mater Sci Eng C Mater Biol Appl 2020; 112: 110763, https://doi.org/10.1016/j.msec.2020.110763.
- Zhao K., Deng Y., Chun Chen J., Chen G.Q. Polyhydroxyalkanoate (PHA) scaffolds with good mechanical properties and biocompatibility. Biomaterials 2003; 24(6): 1041–1045, https://doi.org/10.1016/s0142-9612(02)00426-x.
- Saadat A., Behnamghader A., Karbasi S., Abedi D., Soleimani M., Shafiee A. Comparison of acellular and cellular bioactivity of poly 3-hydroxybutyrate/hydroxyapatite nanocomposite and poly 3-hydroxybutyrate scaffolds. Biotechnol Bioprocess Eng 2013; 18: 587–593, https://doi.org/10.1007/s12257-012-0744-4.
- Hajiali H., Karbasi S., Hosseinalipour M., Rezaie H.R. Preparation of a novel biodegradable nanocomposite scaffold based on poly (3-hydroxybutyrate)/bioglass nanoparticles for bone tissue engineering. J Mater Sci Mater Med 2010; 21(7): 2125–2132, https://doi.org/10.1007/s10856-010-4075-8.
- Hajiali H., Hosseinalipour M., Karbasi S., Shokrgozar M.A. The influence of bioglass nanoparticles on the biodegradation and biocompatibility of poly (3-hydroxybutyrate) scaffolds. Int J Artif Organs 2012; 35(11): 1015–1024, https://doi.org/10.1177/039139881203501107.
- Iron R., Mehdikhani M., Naghashzargar E., Karbasi S., Semnani D. Effects of nano-bioactive glass on structural, mechanical and bioactivity properties of poly (3-hydroxybutyrate) electrospun scaffold for bone tissue engineering applications. Mater Technol 2019; 34: 540–548, https://doi.org/10.1080/10667857.2019.1591728.
- Ambrosio A.M.A., Sahota J.S., Khan Y., Laurencin C.T. A novel amorphous calcium phosphate polymer ceramic for bone repair: I. Synthesis and characterization. J Biomed Mater Res 2001; 58(3): 295–301, https://doi.org/10.1002/1097-4636(2001)58:3295::aid-jbm10203.0.co;2-8.
- Kim S.S., Ahn K.M., Park M.S., Lee J.H., Choi C.Y., Kim B.S. A poly(lactide-co-glycolide)/hydroxyapatite composite scaffold with enhanced osteoconductivity. J Biomed Mater Res A 2007; 80(1): 206–215, https://doi.org/10.1002/jbm.a.30836.
- Degli Esposti M., Chiellini F., Bondioli F., Morselli D., Fabbri P. Highly porous PHB-based bioactive scaffolds for bone tissue engineering by in situ synthesis of hydroxyapatite. Mater Sci Eng C Mater Biol Appl 2019; 100: 286–296, https://doi.org/10.1016/j.msec.2019.03.014.
- Sarrami P., Karbasi S., Farahbakhsh Z., Bigham A., Rafienia M. Fabrication and characterization of novel polyhydroxybutyrate-keratin/nanohydroxyapatite electrospun fibers for bone tissue engineering applications. Int J Biol Macromol 2022; 220: 1368–1389, https://doi.org/10.1016/j.ijbiomac.2022.09.117.
- González M., Merino U., Vargas S., Quintanilla F., Rodríguez R. Synthesis and characterization of a HAp-based biomarker with controlled drug release for breast cancer. Mater Sci Eng C Mater Biol Appl 2016; 61: 801–808, https://doi.org/10.1016/j.msec.2016.01.015.
- Luz G.M., Mano J.F. Mineralized structures in nature: examples and inspirations for the design of new composite materials and biomaterials. Compos Sci Technol 2010; 70(13): 1777–1788, https://doi.org/10.1016/j.compscitech.2010.05.013.
- Zhang X., Li J., Chen J., Peng Z.X., Chen J.N., Liu X., Wu F., Zhang P., Chen G.Q. Enhanced bone regeneration via PHA scaffolds coated with polydopamine-captured BMP2. J Mater Chem B 2022; 10(32): 6214–6227, https://doi.org/10.1039/d2tb01122k.
- Urban R.M., Jacobs J.J., Tomlinson M.J., Gavrilovic J., Black J., Peoc’h M. Dissemination of wear particles to the liver, spleen, and abdominal lymph nodes of patients with hip or knee replacement. J Bone Joint Surg Am 2000; 82(4): 457–476, https://doi.org/10.2106/00004623-200004000-00002.
- ГОСТ ISO 10993-6—2011 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 6. Исследования местного действия после имплантации». 2013.
- Liu Y., Zhou Y., Feng H., Ma G.E., Ni Y. Injectable tissue-engineered bone composed of human adipose-derived stromal cells and platelet-rich plasma. Biomaterials 2008; 29(23): 3338–3345, https://doi.org/10.1016/j.biomaterials.2008.04.037.
- Im J.Y., Min W.K., You C., Kim H.O., Jin H.K., Bae J.S. Bone regeneration of mouse critical-sized calvarial defects with human mesenchymal stem cells in scaffold. Lab Anim Res 2013;29(4): 196–203, https://doi.org/10.5625/lar.2013.29.4.196.
- Zhou Y.S., Liu Y.S., Tan J.G. Is 1, 25-dihydroxyvitamin D3 an ideal substitute for dexamethasone for inducing osteogenic differentiation of human adipose tissue-derived stromal cells in vitro? Chin Med J (Engl) 2006; 119(15): 1278–1286.
- Rentsch C., Rentsch B., Breier A., Hofmann A., Manthey S., Scharnweber D., Biewener A., Zwipp H. Evaluation of the osteogenic potential and vascularization of 3D poly(3)hydroxybutyrate scaffolds subcutaneously implanted in nude rats. J Biomed Mater Res A 2010; 92(1): 185–195, https://doi.org/10.1002/jbm.a.32314.
- Mai R., Hagedorn M.G., Gelinsky M., Werner C., Turhani D., Späth H., Gedrange T., Lauer G. Ectopic bone formation in nude rats using human osteoblasts seeded poly(3)hydroxybutyrate embroidery and hydroxyapatite-collagen tapes constructs. J Craniomaxillofac Surg 2006; 34(Suppl 2): 101–109, https://doi.org/10.1016/s1010-5182(06)60022-x.
- Gredes T., Gedrange T., Hinüber C., Gelinsky M., Kunert-Keil C. Histological and molecular-biological analyses of poly(3-hydroxybutyrate) (PHB) patches for enhancement of bone regeneration. Ann Anat 2015; 199: 36–42, https://doi.org/10.1016/j.aanat.2014.04.003.
- Higuchi T., Kinoshita A., Takahashi K., Oda S., Ishikawa I. Bone regeneration by recombinant human bone morphogenetic protein-2 in rat mandibular defects. An experimental model of defect filling. J Periodontol 1999; 70(9): 1026–1031, https://doi.org/10.1902/jop.1999.70.9.1026.
- Virk M.S., Alaee F., Tang H., Ominsky M.S., Ke H.Z., Lieberman J.R. Systemic administration of sclerostin antibody enhances bone repair in a critical-sized femoral defect in a rat model. J Bone Joint Surg Am 2013; 95(8): 694–701, https://doi.org/10.2106/jbjs.l.00285.
- Berner A., Boerckel J.D., Saifzadeh S., Steck R., Ren J., Vaquette C., Zhang J.Q., Nerlich M., Guldberg R.E., Hutmacher D.W., Woodruff M.A. Biomimetic tubular nanofiber mesh and platelet rich plasma-mediated delivery of BMP-7 for large bone defect regeneration. Cell Tissue Res 2012; 347(3): 603–612, https://doi.org/10.1007/s00441-011-1298-z.
- Li W., Zara J.N., Siu R.K., Lee M., Aghaloo T., Zhang X., Wu B.M., Gertzman A.A., Ting K., Soo C. Nell-1 enhances bone regeneration in a rat critical-sized femoral segmental defect model. Plast Reconstr Surg 2011; 127(2): 580–587, https://doi.org/10.1097/prs.0b013e3181fed5ae.
- Feng W., Lv S., Cui J., Han X., Du J., Sun J., Wang K., Wang Z., Lu X., Guo J., Oda K., Amizuka N., Xu X., Li M. Histochemical examination of adipose derived stem cells combined with β-TCP for bone defects restoration under systemic administration of 1α,25(OH)2D3. Mater Sci Eng C Mater Biol Appl 2015; 54: 133–141, https://doi.org/10.1016/j.msec.2015.05.037.