Измеримые метрики клеточного старения мезенхимальных стволовых клеток
Цель исследования — проанализировать проявления отдельных маркеров старения на модели репликативного, стресс-индуцированного и хронологического старения мезенхимальных стволовых клеток человека, а также изучить реализуемость предиктивных моделей для оценки возраста и протяженности культивирования invitro на основе транскриптомных данных и исследования клеточной морфологии.
Материалы и методы. На различных моделях клеточного старения методом ПЦР в режиме реального времени проанализирована динамика экспрессии отдельных генов, кодирующих принципиальные регуляторы клеточного старения, а также исследована длина теломер. Проведен анализ данных высокопроизводительного секвенирования транскриптомов мезенхимальных стволовых клеток доноров разного возраста. С помощью методов регрессионного анализа подготовлены предиктивные модели на основе транскриптомных данных для оценки хронологического возраста и протяженности культивирования invitro. Методами микроскопии и последующего анализа изображений алгоритмами машинного обучения изучены морфологические изменения, ассоциированные с клеточным старением, и подготовлена сегментационная нейросетевая модель для экстракции параметров ядерной морфологии и классификации клеток по времени культивации invitro.
Результаты. На моделях репликативного, стресс-индуцированного и хронологического старения мезенхимальных стволовых клеток гены CDKN1A, LMNB1, HMGB2 демонстрировали воспроизводимую схожую динамику. Профиль экспрессии компонентов воспалительного фенотипа, ассоциированного со старением, был вариабелен в различных моделях клеточного старения. Анализ транскриптомов мезенхимальных стволовых клеток доноров разного возраста выявил значительную донор-зависимую гетерогенность клеток, что затрудняет разработку эффективных предиктивных моделей на основе транскриптомных данных. Исследование изменения длины теломер продемонстрировало свою применимость для оценки динамики репликативного старения invitro. Разработанная сегментационная нейросетевая модель позволила детектировать ассоциированную со старением динамику изменения ядерной морфологии в ходе репликативного старения.
Введение
Препараты аллогенных и аутологичных мезенхимальных стволовых клеток (МСК) рассматриваются в качестве перспективного компонента регенеративной клеточной терапии [1]. В клинических испытаниях применяют высокие дозы, достигающие сотни миллионов клеток на одну процедуру. Это зачастую обусловливает необходимость предварительного масштабирования культуры invitro, что наряду с функциональным состоянием организма донора может снижать качество клеточных препаратов [2–4]. Функциональные методы контроля препаратов МСК для клинического применения подразумевают оценку морфологии, клеточной выживаемости, потенциала к дифференцировке и биобезопасности [5, 6]. Вместе с тем изучение влияния функционального состояния организма донора, условий и протяженности культивации на качество клеточных продуктов требует проведения дополнительных исследований. При классификации признаков старения организма выделяют различные функциональные проявления, такие как метаболические и иммунные нарушения, геномная нестабильность и изменения эпигенома [7]. Одним из признаков старения организма считается накопление стареющих (сенесцентных) клеток, неспособных делиться, устойчивых к апоптозу и обладающих характерным морфологическим и метаболическим фенотипом [3, 7].
Индукторами клеточного старения могут служить исчерпание пролиферативного потенциала, сопряженное с критическим укорочением теломер; воздействие токсического, генотоксического и окислительного стресса; индукция онкогенов; воспаление; дисфункция митохондрий, нарушение эпигенетических механизмов регуляции и др. [3, 8–11]. Важно отметить, что перечисленные факторы также могут являться вторичными эффектами клеточного старения, а его фенотипические проявления на клеточном уровне способны варьировать в широком диапазоне.
В связи с подобной гетерогенностью как в культурах, так и на уровне организма на настоящий момент не существует специфичного универсального маркера клеточного старения [12, 13]. По этой причине исследование динамики клеточного старения, как правило, опирается на анализ нескольких маркеров, комбинация которых в большей степени присуща этому процессу [3, 12]. К таким маркерам можно отнести индукцию β-галактозидазы, ассоциированной со старением; активацию ингибиторов клеточного цикла p16INK4A, p21CIP1; снижение экспрессии белков LMNB1 и HMGB2, определяющих структуру и архитектуру клеточного ядра [14–16]. В дополнение к анализу указанных маркеров возможно проведение функциональных тестов для оценки пролиферативного потенциала, проявления маркеров повреждения ДНК и апоптоза [12, 17].
Характерной особенностью сенесцентных клеток является секреция провоспалительных цитокинов, хемокинов, факторов роста и протеаз, которые объединены понятием секреторного фенотипа, ассоциированного со старением (SASP) [18]. Детекция факторов SASP может служить индикатором клеточного старения, однако их представленность существенно варьирует и зависит, в частности, от функциональной причины индукции клеточного старения [11]. Таким образом, классический подход к исследованию клеточного старения основан на анализе достаточно широкого спектра неисключительных маркеров и проведении функциональных тестов. Вместе с тем в настоящее время развиваются подходы к интегральной оценке клеточного старения предиктивными моделями, построенными на основе анализа паттернов метилирования ДНК, транскриптомных данных и клеточной морфологии [19–21]. Такие предиктивные модели позволяют учитывать вариабельность проявлений клеточного старения и, как правило, в меньшей степени зависят от отдельных маркеров, что позволяет рассматривать их в качестве перспективного инструмента анализа.
Цель исследования — проанализировать проявления отдельных маркеров старения на модели репликативного, стресс-индуцированного и хронологического старения мезенхимальных стволовых клеток человека. В качестве таких маркеров мы рассматривали уровень экспрессии отдельных генов, динамика которых ассоциирована со старением; глобальные изменения транскриптома в ходе хронологического и invitro старения клеток; исследование длины теломер; а также изменения клеточной морфологии и проявления отдельных цитологических маркеров клеточного старения. В рамках работы мы оценили применимость указанных маркеров для оценки старения МСК, а также ограничения используемых методов, потенциально способные исказить анализ. Кроме того, была проанализирована концептуальная возможность построения предиктивных моделей для оценки хронологического возраста и протяженности культивирования invitro на основе транскриптомных данных и исследования клеточной морфологии.
Материалы и методы
Культуры клеток. Образцы клеток были взяты с добровольного информированного согласия доноров. Исследование было одобрено локальным этическим комитетом Федерального центра мозга и нейротехнологий ФМБА России (протокол №7-5-22 от 6 сентября 2022 г.).
В работе были использованы МСК (n=2), выделенные из вартонового студня здоровой роженицы на 38–40 нед гестации; МСК костного мозга (КМ-МСК) здоровых доноров 18–25 лет (n=3) и старше 65 лет (n=3), взятые из фракции мононуклеарных клеток костного мозга, полученных методом градиентного центрифугирования (20 мин, 400 g) в растворе фиколла («ПанЭко», Россия). Клетки культивировали в среде DMEM/F12 (Servicebio, Китай) с добавление 15% фетальной бычьей сыворотки (Capricorn, Китай) и коктейля антибиотиков пенициллина (100 ед./мл) и стрептомицина (100 мкг/мл) (Gibco, США). Субкультивирование проводили с коэффициентом рассева 1:4. Методом проточной цитофлуориметрии анализировали экспрессию маркеров МСК: CD29, CD44, CD73, CD90, CD105, CD34, CD45 (FITC/PE; Miltenyi Biotec, Германия) и HLA-DR. Клетки имели морфологию и иммунофенотип, характерные для МСК: CD29+, CD44+, CD73+, CD90+, CD105+, CD34–, CD45–.
Для индукции стресс-индуцированного клеточного старения культивировали МСК до достижения 60% конфлюентности, после чего меняли культуральную среду на среду, содержащую 200 мкМ перекиси водорода («Диаэм», Россия). Спустя 4 ч инкубации удаляли среду и дважды промывали МСК фосфатно-солевым буфером. Затем клетки инкубировали в стандартных условиях культивации в течение 3 дней, после чего использовали для дальнейшего анализа.
Иммуноокрашивание и цитохимический анализ активности β-галактозидазы, ассоциированной со старением. Для приготовления препаратов клетки культивировали в 96-луночных планшетах для конфокальной микроскопии (SPL Lifesciences, Южная Корея) либо на покровных стеклах, предварительно покрытых 0,1% раствором желатина (Sigma-Aldrich, США). По достижении необходимой конфлюентности препараты фиксировали в 4% растворе формальдегида (Sigma-Aldrich, США). Анализ активности β-галактозидазы, ассоциированной со старением, выполняли по описанной ранее методике [22]. Для проведения иммуноокрашивания клетки инкубировали в растворе 0,1% Triton X-100 (Amresco, США) в течение 30 мин, после чего инкубировали в 1% растворе BSA (Sigma-Aldrich, США) в течение 1 ч. Для иммуноокрашивания использовали следующие первичные и вторичные антитела: Ki-67 (Cell Signalling Technology, США либо Milteny Biotec, Германия); H3K9me3 (Active Motif, США); Donkey Anti-Mouse IgG H&L (Alexa Fluor® 488) (Abcam, Великобритания); Goat Anti-Rabbit IgG H&L (Alexa Fluor® 568) (Abcam, Великобритания); Goat anti-Rabbit IgG (H+L) (PE-Alexa Fluor™ 647) (Invitrogen, США). В качестве ядерного красителя применяли Hoechst 33342 (Invitrogen, США). Анализ препаратов проводили с использованием флуоресцентного микроскопа Olympus BX 51 (Olympus Corporation, Япония) и сканирующего лазерного конфокального микроскопа Nikon A1 (Nikon Corporation, Япония).
Оценка экспрессии генов методом ПЦР в режиме реального времени. Для выделения РНК применяли реагент Rizol (diaGene, Россия) в соответствии с протоколом производителя. Синтез комплементарной ДНК осуществляли с помощью набора реагентов для обратной транскрипции («Биолабмикс», Россия). ПЦР в режиме реального времени проводили с использованием реакционных смесей «БиоМастер UDG HS-qPCR SYBR Blue» («Биолабмикс», Россия). Для нормализации применяли референсные гены ACTB и SDHA.
Последовательности использованных в работе олигонуклеотидов:
ACTB_F ACAGAGCCTCGCCTTTG, ACTB_RCCTTGCACATGCCGGAG;
SDHA_F TTTGATGCAGTGGTGGTAGG, SDHA_R CAGAGCAGCATTGATTCCTC;
p21_F TGGAGACTC TCAGGGTCGAAA, p21_
R GGCGTTTGGAGTG GTAGAAATC;
HMGB2_F CTTGGCACGATATGCAGCAA, HMGB2_
R CAGCCAAAGATAAACAACCATATGA;
LMNB1_F ACACTTCTGAACAGGATCAACC, LMNB1_R CTGTGACACCAGCGTTTGC;
p16ink4a_F CCCAACGCACCGAATAGTTA,
p16ink4a_R ACCAGCGTGTCCAGGAAG;
IL6_F GTGGCTGCAGGACATGACAA, IL6_
R TGAGGTGCCCATGCTACATTT;
IL8_F AAGAGCCAGGAAGAAACCACC, IL8_R CTGCAGAAATCAGGAAGGCTG;
IL1b_F CTGTCCTGCGTGTTGAAAGA, IL1b_
R TTGGGTAATTTTTGGGATCTACA;
PAI1-F CTCATCAGCCACTGGAAAGGCA, PAI1-
R GACTCGTGAAGTCAGCCTGAAAC;
MCP1_F CTTCTGTGCCTGCTGCTCATA, MCP1_R CTTTGGGACACTTGCTGCTG;
MMP1-F TGGACGTTCCCAAAATCCTG, MMP1-
R AAGGGATTTGTGCGCATGTAG;
MMP3-F CTGCTGTTGAGAAAGCTCTG, MMP3-
R AATTGGTCCCTGTTGTATCCT.
Определение длины теломер методом ПЦР в режиме реального времени. ПЦР в режиме реального времени проводили с использованием реакционных смесей «БиоМастер UDG HS-qPCR SYBR Blue» («Биолабмикс», Россия) с парами праймеровTel-F CGGTTTGTTTGGGTTTGGGTTTGGGTTTGGGTTTGGGTT и Tel-R GGCTTGCCTTACCCTTACCCTTACCCTTACCCTTACCCT, специфичными к повторам теломерной ДНК, а также 36B4u CAGCAAGTGGGAAGGTGTAATCC и 36B4d CCCATTCTATCATCAACGGGTACAA, специфичными к участку гена кислого рибосомного фосфопротеина P0 на хромосоме 12. Копийность генома и суммарную длину теломерной ДНК на старте ПЦР определяли относительно стандартной ДНК, которая представляла собой плазмиду pAL2-T («Евроген», Россия) со встройкой ампликона 36B4 или со встройкой кластера из 14 повторов теломерной ДНК человека суммарной длиной 84 п.н. Программа амплификации — 50ºС в течение 5 мин, 95ºС в течение 10 мин, 39 циклов 95ºС в течение 15 с и 60ºС в течение 1 мин.
Анализ данных высокопроизводительного секвенирования транскриптома и построение предиктивных моделей на основе транскриптомных данных. В работе были использованы ранее опубликованные данные, размещенные в репозитории Gene Expression Omnibus (GSE139073, GSE145008) [23, 24]. Выравнивание сырых прочтений на референсный геном GRCh38, препроцессинг и детекцию генной экспрессии на уровне прочтений проводили с использованием программ STAR, SAMtools и featureCounts [25–27]. Для устранения батч-эффектов в транскриптомных данных применялся метод ComBat-seq, реализованный в пакете sva [28]. Анализ дифференциальной экспрессии генов проводили с использованием статистического пакета edgeR [29].
Для построения предиктивных моделей хронологического возраста и длительности культивации invitro использовали нормализованные значения генной экспрессии. Были отобраны гены, экспрессия которых статистически значимо коррелировала с пассажем либо хронологическим возрастом доноров с применением коэффициентов корреляции Спирмена и Пирсона (коэффициент > |0,5|, скорректированный уровень значимости (p-value-adjusted) <0,05). Регрессионные модели были построены с использованием LASSO-регрессии и метода случайного леса (random forest regressor, RFR) из пакета Scikit-learn [30]. Данные были разделены на обучающую (80%, 84 образца секвенирования) и тестовую (20%, 22 образца секвенирования) выборки. Для модели на основе LASSO-регрессии применена автоматическая настройка гиперпараметра с помощью LassoCV на обучающей выборке. Для RFR-модели использованы базовые параметры количества деревьев. Качество моделей оценивалось на тестовой выборке, которая не участвовала в процессе обучения.
Подготовка данных и обучение нейросетевой сегментационной модели. На первом этапе с использованием модели распознавания изображений Segment Anything c последующей ручной валидацией и коррекцией были подготовлены маски ядер для микроскопических снимков клеточных препаратов пуповинных МСК на разных культуральных пассажах (диапазон пассажей — 3–15, суммарно 27 500 клеток) [31]. На следующем шаге снимки были масштабированы до одинакового разрешения и разделены скользящим окном с шагом 246 пикселей на перекрывающиеся фрагменты размером 256×256 пикселей. Шаг окна обеспечивал перекрытие соседних фрагментов изображений на 10 пикселей с каждой стороны, что позволило уменьшить граничные артефакты при последующей сборке итоговой карты сегментации. Для повышения устойчивости модели к различным вариантам экспозиции и контрастности изображений применяли методы аугментации. Среди использованных преобразований — горизонтальные и вертикальные отражения, случайные изменения яркости и контраста, а также масштабирование с небольшими сдвигами. Итоговый набор данных состоял из 563 примеров и был разделен в соотношении 80/20% для обучения и тестирования, обеспечивая достаточное число примеров для корректной настройки параметров сети.
Для решения задачи сегментации ядер клеток использовали сверточную архитектуру нейронной сети DeepLabV3+ [32]. В качестве базовой сети был выбран EfficientNet-b0 [33], предобученный на наборе данных ImageNet, что обеспечило моделям начальное представление о низкоуровневых признаках изображений. Обучение проводили в течение 40 эпох, что позволило модели достичь стабильной сходимости. За этот период модель обучалась на вычислительном узле с графическим процессором NVIDIA A100, что обеспечило полное выполнение тренировочного цикла за 3,5 ч. Для минимизации влияния несбалансированности классов (значительной разницы по размерам ядер и тонких границ) и достижения более точной сегментации использовали комбинированную функцию потерь, которая интегрировала в себе две составляющие: функция BCE-Dice Loss обеспечивала высокую чувствительность к дисбалансу между классами (ядро/фон) и учитывала пространственную согласованность предсказаний; функция Focal Loss улучшала обучение за счет снижения влияния легко классифицируемых примеров. В процессе обучения применяли планировщик скорости обучения (scheduler), который корректировал скорость обучения (learning rate) от начальной величины 1e–3 до 1e–5 после каждой итерации, обеспечивая постепенное уменьшение шага оптимизации и способствуя стабильной сходимости модели.
Для подсчёта количественных морфометрических характеристик ядер на входе функции анализа передавалась бинарная маска, полученная из результатов сегментации DeepLabV3+. Перед вычислениями из общей маски исключались пиксели, помеченные как «граница», а затем выполнялась последовательная эрозия–дилатация (по 20 пикселей) для удаления тонких артефактов и слияния разорванных контуров. Вычисляемые параметры для каждого ядра: координаты центра (X, Y), площадь, круглость, полуоси эллипса (major/minor) и угол наклона, дистанция Хаусдорфа. Был также установлен коэффициент принадлежности к классу пассажей: класс 1 (3–5-й пассаж), класс 2 (7–9-й пассаж), класс 3 (11–15-й пассаж). Исполняемые скрипты модели выложены в репозитории GitHub (https://github.com/LabADTCellSeg/cellseg).
Результаты
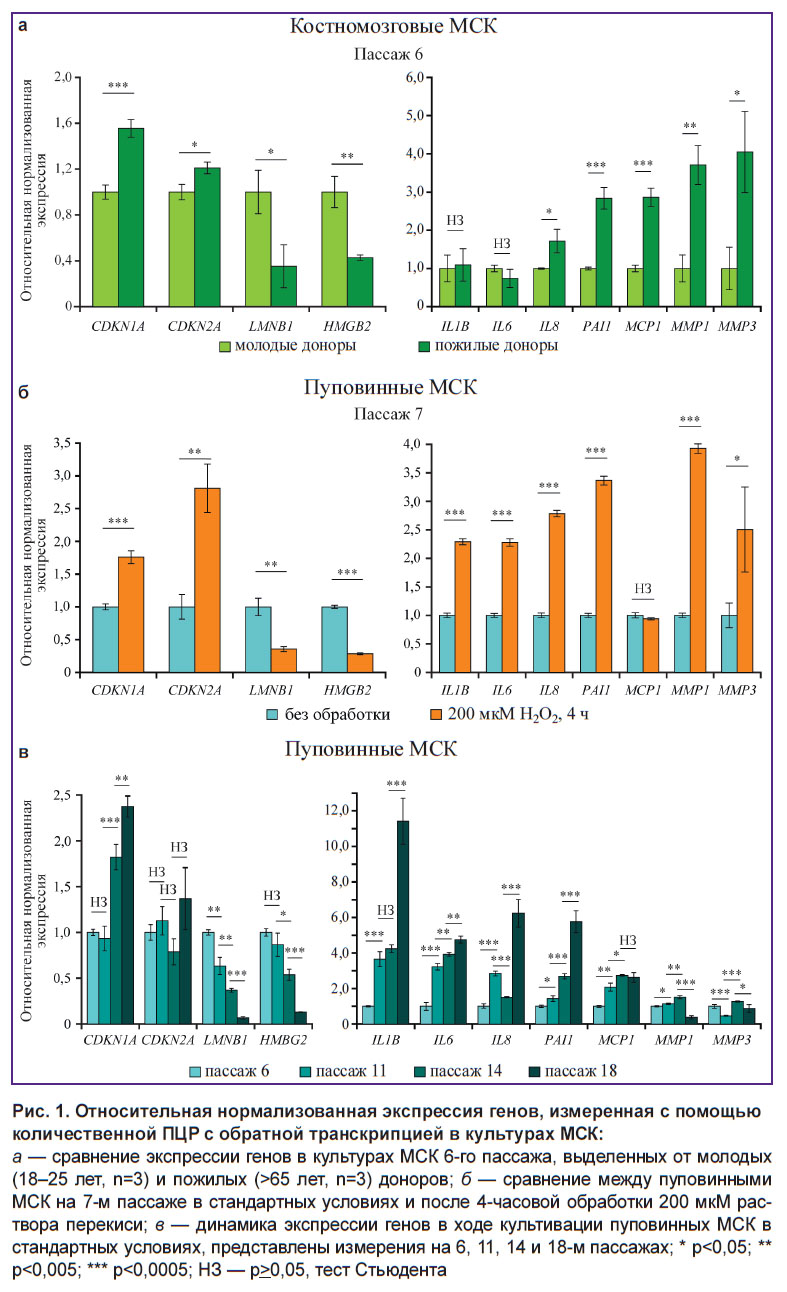
Ассоциированные со старением изменения профиля экспрессии генов. Для оценки ассоциированных со старением изменений экспрессии в МСК мы выбрали гены, являющиеся принципиальными регуляторами клеточного старения на уровне контроля клеточного цикла и структуры ядра, а также кодирующие компоненты провоспалительного фенотипа. Нами был исследован уровень экспрессии следующих генов: P16INK4a/СDKN2A, P21CIP1/CDKN1A, LMNB1, HMGB2, IL6, IL8/CXCL8, IL1B, SERPINE1/PAI1, MCP1/CCL2, MMP1, MMP3. Анализ экспрессии проведен на модели репликативного клеточного старения — независимых клеточных линиях пуповинных МСК, подвергнутых длительному культивированию (n=2); на модели хронологического старения — образцах КМ-МСК от групп доноров разного возраста: 20–25 лет (n=2) и старше 65 лет (n=2); на модели стресс-индуцированного старения — линиях пуповинных МСК, подвергнутых индукции клеточного старения пероксидом водорода (n=2).
Гены, кодирующие ингибиторы циклин-зависимых киназ (СDKN2A и CDKN1A), демонстрировали сходную динамику во всех исследованных образцах — их экспрессия увеличивалась в ходе продолжительной культивации, при воздействии окислительного стресса, а также с увеличением возраста доноров (рис. 1). Необходимо отметить, что увеличение экспрессии было более выражено для CDKN1A, в то время как изменения экспрессии CDKN2A были слабее и, в случае исследования репликативного старения, недостоверны. Уровень экспрессии генов, кодирующих ядерные архитектурные белки LMNB1 и HMGB2, статистически значимо снижался как при репликативном и стресс-индуцированном старении, так и в случае хронологического старения (см. рис. 1). Причем наиболее драматичные изменения наблюдались при репликативном старении, в ходе которого снижение экспрессии в течение культивирования достигало около 90% для LMNB1 и HMGB2. Интересно отметить, что гены, кодирующие компоненты SASP, демонстрировали различную динамику в зависимости от причины старения клеток (см. рис. 1). Так, индукция старения перекисью вызывала повышение уровня экспрессии всех исследованных генов, за исключением MCP1, в то время как репликативное старение не вызывало активации генов, кодирующих матриксные металлопротеиназы MMP1 и MMP3. Интересно отметить, что анализ образцов КМ-МСК доноров разного возраста не выявил возраст-зависимых изменений в уровне экспрессии генов, кодирующих цитокины IL-6, IL-1β, а CXCL8 достаточно слабо активировался в клетках возрастных доноров. Наиболее стабильно в контексте ассоциированной со старением клеток динамики экспрессии проявил себя ген SERPINE1/PAI1, кодирующий белок PAI-1.
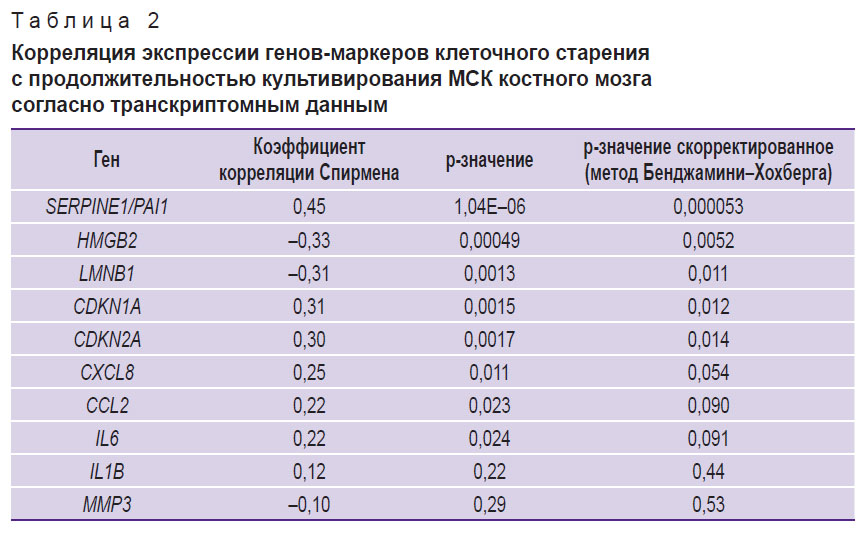
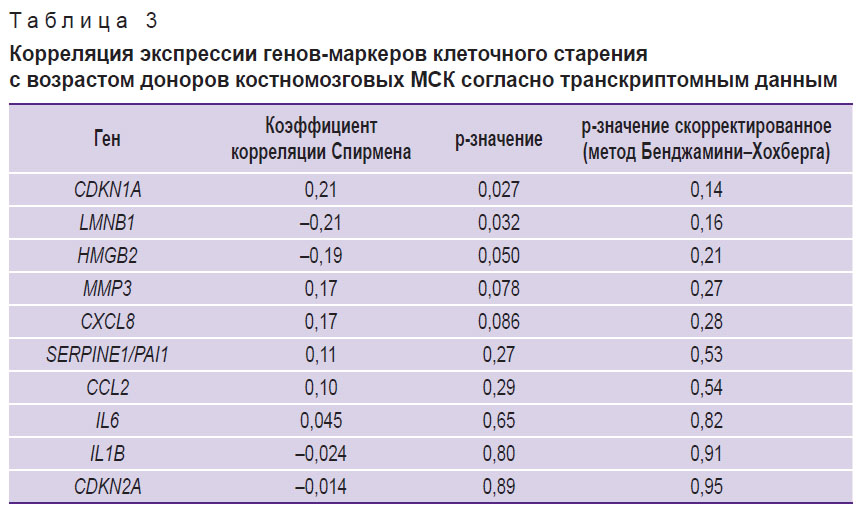
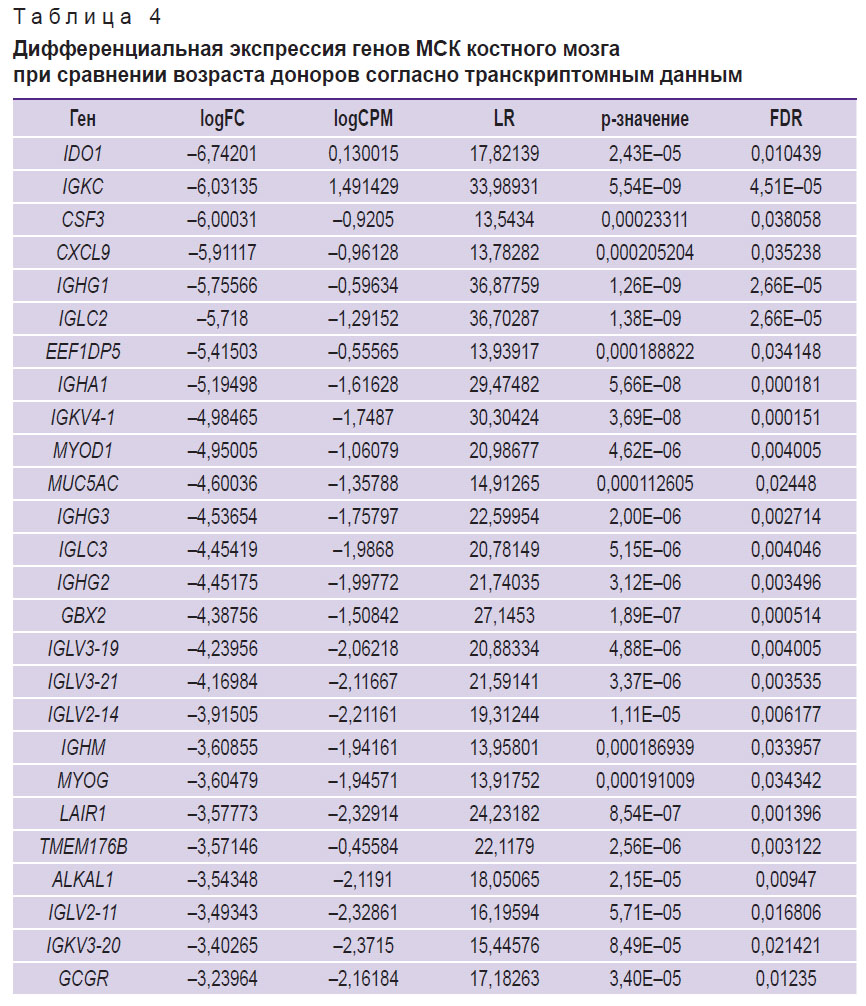
Различные проявления провоспалительного фенотипа, ассоциированного со старением, в зависимости от типа старения клеток в целом являются ожидаемыми, однако для независимой проверки полученных результатов был проведен поиск доступных данных высокопроизводительного секвенирования транскриптомов КМ-МСК, содержащих информацию о возрасте доноров, а также клеточном пассаже, в репозитории Gene Expression Omnibus. В результате был подготовлен набор данных (n=37, возраст — 3–85 лет, медианное значение — 47 лет; табл. 1) и проведен корреляционный анализ изменения экспрессии исследованных нами генов с продолжительностью культивирования, а также с возрастом доноров. В соответствии с полученными результатами гены SERPINE1/PAI1, CDKN1A и CDKN2A демонстрировали положительную корреляцию с протяженностью культивирования, а LMNB1 и HMGB2 — отрицательную (корреляция Спирмена, p<0,05; табл. 2). Корреляция с возрастом доноров была выявлена для генов CDKN1A и LMNB1 при условии отсутствия поправки на множественное тестирование (табл. 3). Анализ дифференциальной экспрессии в образцах КМ-МСК от группы доноров 20–35 лет (n=7) и доноров 60–85 лет (n=13) выявил лишь 50 генов, демонстрирующих статистически значимые существенные отличия уровня экспрессии (|logFC|>2, p<0,05) (табл. 4). По всей вероятности, донор-зависимая вариабельность паттернов экспрессии генов в КМ-МСК может быть достаточно высока, что затрудняет выявление транскрипционных маркеров хронологического старения. Вместе с тем для оценки клеточного старения in vitro анализ экспрессии отдельных генов представляется оправданным.
|
Таблица 2. Корреляция экспрессии генов-маркеров клеточного старения с продолжительностью культивирования МСК костного мозга согласно транскриптомным данным |
|
Таблица 3. Корреляция экспрессии генов-маркеров клеточного старения с возрастом доноров костномозговых МСК согласно транскриптомным данным |
|
Таблица 4. Дифференциальная экспрессия генов МСК костного мозга при сравнении возраста доноров согласно транскриптомным данным |
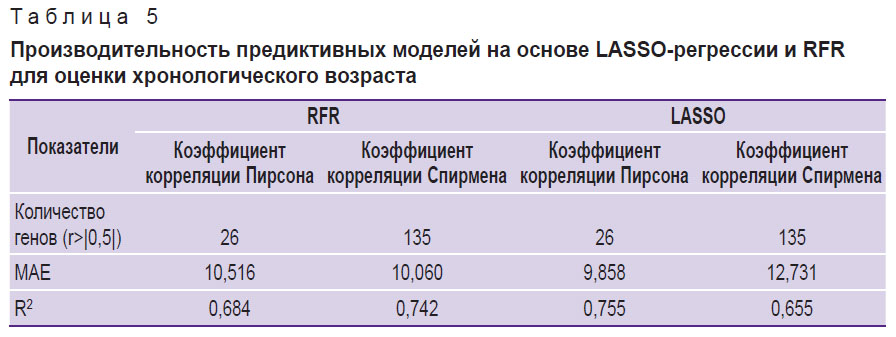
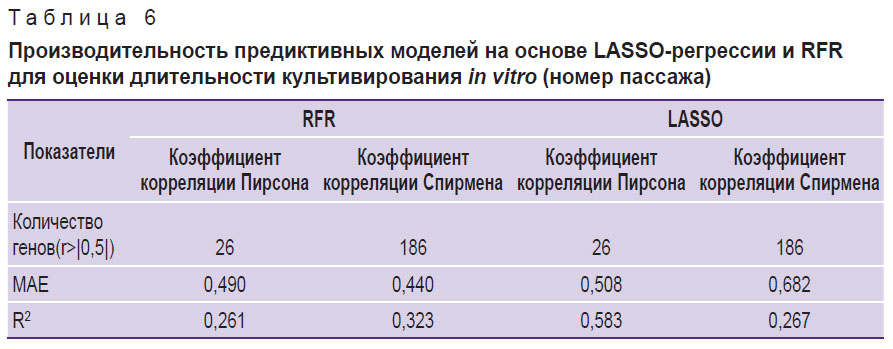
С целью концептуальной проверки применимости анализа транскриптомных данных для предсказания хронологического возраста доноров либо протяженности культивации клеток мы подготовили соответствующие предиктивные регрессионные модели на основе двух подходов: LASSO-регрессии и RFR. Отбор генов, используемых в качестве предикторов, проводили на основе коэффициентов корреляции Пирсона и Спирмена, с целью учета как линейных, так и монотонных зависимостей между признаками и целевыми переменными — хронологическим возрастом и протяженностью культивирования. В результате модели на основе LASSO-регрессии и RFR показали близкую производительность: R2=0,755; MAE=9,858 года и R2=0,742, MAE=10,060 года соответственно (табл. 5). При предсказании клеточного пассажа наивысшую точность предсказания на тестовой выборке продемонстрировала модель на основе LASSO-регрессии — R2=0,583; MAE=0,508 пассажей (табл. 6).
|
Таблица 5. Производительность предиктивных моделей на основе LASSO-регрессии и RFR для оценки хронологического возраста |
|
Таблица 6. Производительность предиктивных моделей на основе LASSO-регрессии и RFR для оценки длительности культивирования in vitro (номер пассажа) |
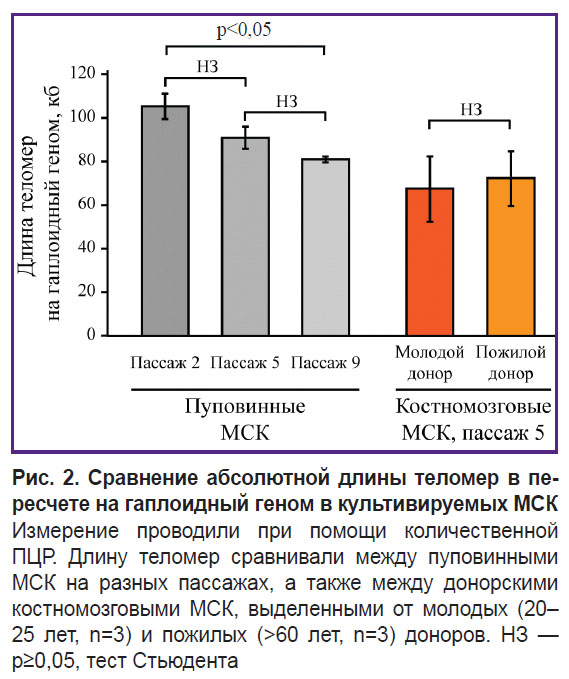
Анализ длины теломер для оценки старения клеток. Одним из традиционных маркеров оценки клеточного старения является анализ длины теломер. Для проведения подобного анализа нами был использован метод ПЦР в режиме реального времени. Проанализированы образцы пуповинных МСК разных пассажей и образцы КМ-МСК доноров возрастной группы 20–25 лет (n=2) и старше 65 лет (n=2) на 6-м культуральном пассаже. Данный метод позволил детектировать динамику укорочения теломер в ходе культивирования МСК, при этом статистически значимые отличия были детектированы спустя 7 пассажей (рис. 2). Вместе с тем при сравнении образцов от доноров разного возраста мы не обнаружили достоверных отличий.
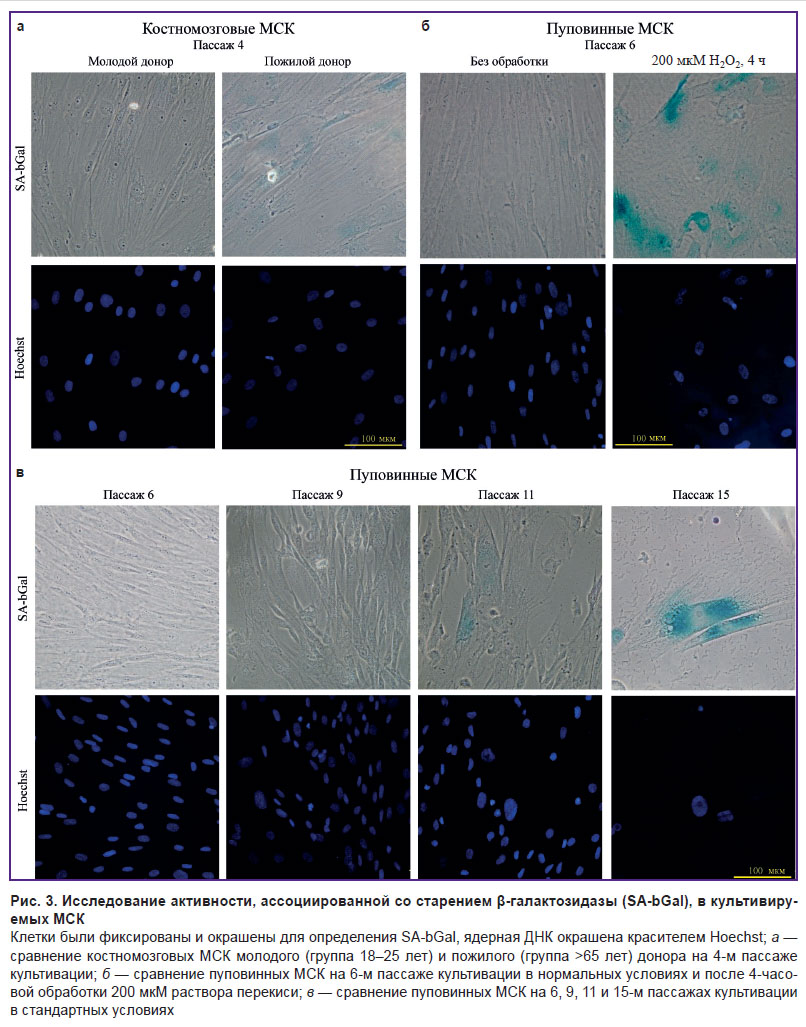
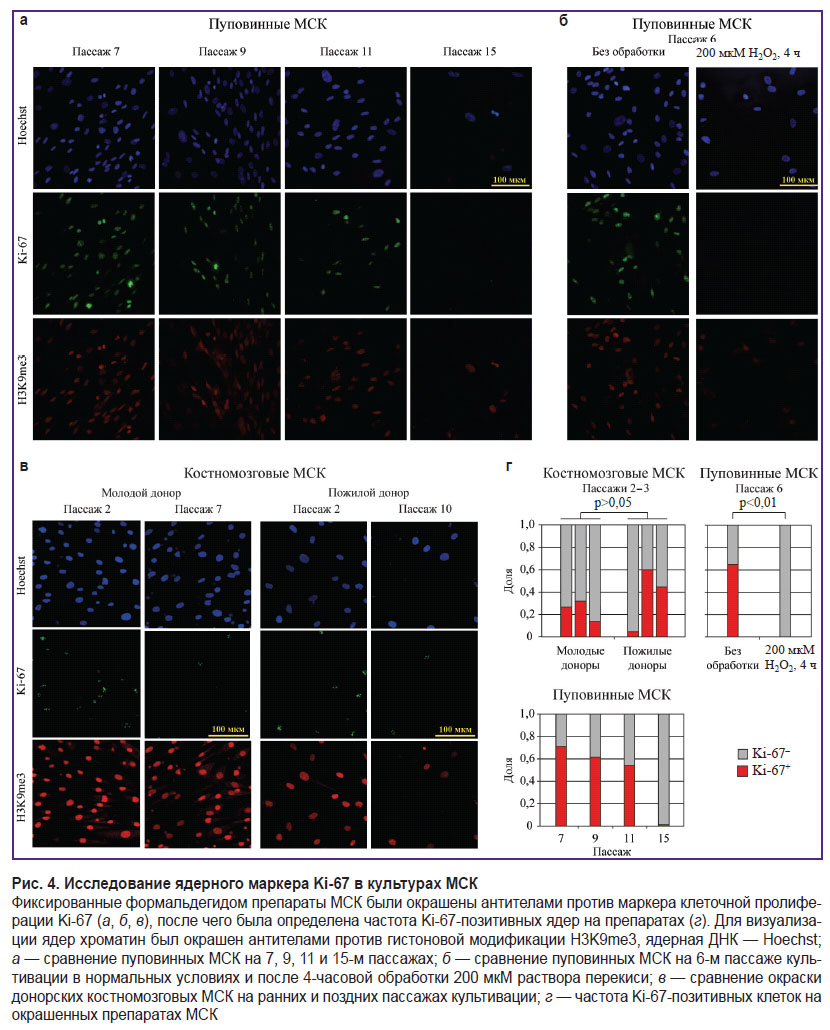
Анализ морфологии ядра в качестве маркера клеточного старения. Для оценки динамики изменения морфологии ядра и проявления отдельных белковых маркеров в ходе старения клеток различного генеза мы проанализировали препараты КМ-МСК трех доноров молодой (18–25 лет) и старшей (более 65 лет) возрастных групп, подвергнутые продолжительному культивированию; препараты пуповинных МСК; а также клеточные препараты, обработанные перекисью для индукции клеточного старения. При цитохимическом исследовании активности β-галактозидазы, ассоциированной со старением (рис. 3), наблюдалось увеличение ее активности в ходе репликативного и стресс-индуцированного старения (рис. 3, б, в). При анализе препаратов, полученных от доноров разного возраста, отличия не были ярко выраженными (рис. 3, а). Иммуноокрашивание клеток антителами против маркера пролиферации Ki-67 (рис. 4, а–в) позволило установить относительное снижение количества Ki-67-позитивных клеток, ассоциированное с продолжительностью культивирования (см. рис. 4, а; рис. 4, г), при этом мы не обнаружили явных отличий при сравнении клеточных препаратов от доноров разного возраста (см. рис. 4, в, г). На уровне морфологии ядер наблюдалось снижение интенсивности сигнала H3K9me3, что соотносится с эрозией гетерохроматина, наблюдаемой при старении, а также увеличение размера ядер как при анализе клеток на более поздних пассажах, так и в случае повышения возраста доноров. Аналогичные эффекты отмечались и при продолжительном культивировании, а также стресс-индуцированном старении пуповинных МСК (см. рис. 4, а–в).
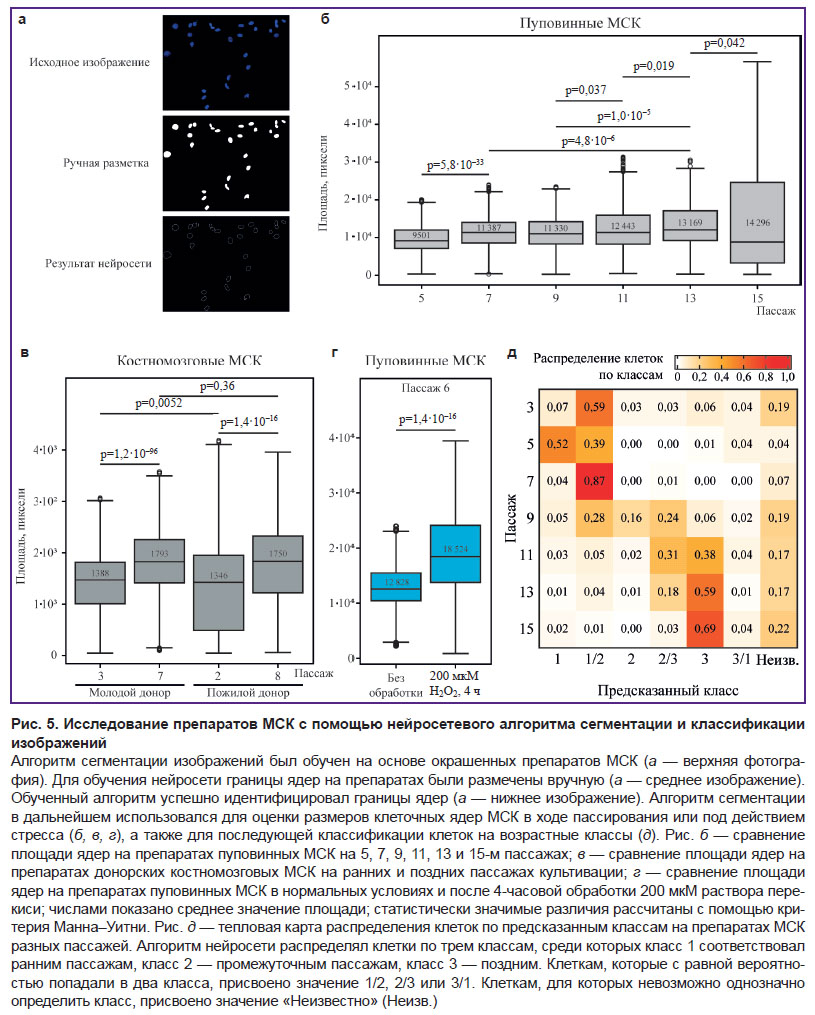
Интересно отметить, что накапливается все больше свидетельств в пользу возможности использования изменения морфологии ядра в качестве самостоятельного признака старения клеток. С технической точки зрения такой анализ выглядит наиболее устойчивым, поскольку фактически требует обработки препарата лишь флуоресцентными ядерными красителями и последующего микроскопического анализа. Кроме того, современные подходы в области машинного распознавания изображений позволяют значительно ускорить итоговую обработку результатов и сбор необходимой статистики. По этой причине для систематического анализа изменения ядерной морфологии в ходе старения мы обучили сегментационную нейросетевую модель, описывающую такие параметры ядерной морфологии, как площадь, круглость и параметры эллипса (см. «Материалы и методы»). Модель продемонстрировала высокое качество сегментации на тестовой выборке (рис. 5, а). В качестве основной метрики оценки эффективности модели использовался показатель Intersection over Union (IoU). Для разработанной модели он составил 0,88, что свидетельствует об эффективном выделении ядер клеток и их границ даже при наличии шумов и вариаций в исходных изображениях. Для каждого ядра вычисляли ряд параметров:
1) координаты центра (X, Y) позволяют сопоставлять ядро с другими клеточными структурами и использовать для пространственного анализа; определяются как центроид, полученный из моментов контура;
2) площадь — маркер общей крупности ядра; рост площади может быть ассоциирован с переходом клеток к поздним пассажам;
3) круглость характеризует компактность формы; увеличение значения свидетельствует о приобретении ядром более круглой формы, что может быть ассоциировано с более поздними стадиями клеточного старения;
4) полуоси эллипса и угол наклона позволяют оценить степень вытянутости и ориентацию ядра;
5) дистанция Хаусдорфа служит критерием качества аппроксимации; низкие значения (<10) указывают на соответствие формы ядра эллипсу.
С помощью разработанной модели были собраны данные о размерах и форме ядер МСК (рис. 5, б–г) доноров разного возраста (n=9308), подвергнутых культивации invitroразличной протяженности (n=5157), а также до и после индукции стресс-опосредованного клеточного старения (n=564). Клетки доноров старшей возрастной группы демонстрировали более широкий диапазон размеров ядер на первых этапах культивации, тогда как с увеличением пассажа размеры ядер у клеток от доноров разного возраста выравнивались (см. рис. 5, в). В ходе продолжительной культивации размер ядра также существенно увеличивался, причем такое увеличение размера происходит градуально (см. рис. 5, б). Стресс-индуцированное старение было сопряжено с наиболее драматичным увеличением размера ядер (см. рис. 5, г).
На следующем шаге мы оценили возможность предсказания протяженности культивации клеток, выраженной в порядковом номере культурального пассажа, по морфологии ядра. Разработанная модель классифицировала клетки на три класса — ранние культуральные пассажи (3–5-й пассаж), промежуточные (7–9-й пассаж) и поздние (11–15-й пассаж), согласно структуре обучающего набора данных. В результате работы модели анализируемым клеткам присваивался коэффициент принадлежности к какому-либо из перечисленных классов. Алгоритм вычисления коэффициентов принадлежности к классу состоял из нескольких этапов. На первом этапе была сформирована область клетки, для этого объединены маска границы и маски классов, затем по результатам сегментации извлекался и заполнялся контур клетки. На следующем этапе проводили подсчет перекрытий с масками классов для определения числа пикселей, лежащих одновременно в области клетки и в маске соответствующего класса. Затем выполняли нормировку по площади клетки, в рамках которой для каждого класса отношение числа перекрывающихся пикселей к общей площади клетки превращается в долю от 0 до 100%. Полученные доли корректировались таким образом, чтобы их сумма равнялась 100%, после чего скорректированные доли принимались за значения коэффициента принадлежности к каждому классу. Принадлежность к основным классам (1, 2, 3) определяли по наивысшему значению коэффициента принадлежности классу, смешанный класс (1/2, 2/3, 3/1) присваивали при условии не более 10% разницы коэффициентов принадлежности двум классам, неопределенный класс — в случае близкого значения коэффициентов принадлежности ко всем классам (все значения менее 40%). Оценка алгоритма на тестовой выборке продемонстрировала адекватное предсказание действительных культуральных пассажей исследуемых клеток (рис. 5, д). Начиная с 9-го пассажа увеличивалась представленность клеток в разных классах, что может быть связано с возрастанием морфологической гетерогенности клеток, ассоциированной со старением. С возрастанием пассажа клеток тестовой выборки планомерно увеличивалась доля клеток, классифицированных в качестве клеток позднего пассажа, что, по всей вероятности, также отражает динамику накопления состаренных клеток.
Обсуждение
Ключевым признаком клеточного старения является необратимая остановка клеточного цикла, опосредованная активацией ингибиторов циклин-зависимых киназ p16INK4a and p21CIP1a [3]. На исследованных моделях клеточного старения МСК гены, кодирующие белки p16INK4a, p21CIP1a, также продемонстрировали ожидаемую динамику. Кроме того, существенные изменения претерпевают клеточная морфология и архитектура ядра. Значимую роль в изменении структуры ядра и хроматина играет ассоциированное с клеточным старением снижение уровня экспрессии гена LMNB1 [15, 34], которое наблюдалось во всех исследованных моделях клеточного старения и было наиболее выражено на модели репликативного старения МСК. К специфическим изменениям структуры хроматина также относится формирование так называемых доменов гетерохроматина, ассоциированного со старением (SAHF и SAHD), наряду с деконденсацией пери-/центромерных регионов гетерохроматина (SADS) и глобальной эрозией гетерохроматина [16, 35–37]. Такие изменения вовлечены в регуляцию как генов, необходимых для прогрессии клеточного цикла, так и генов, составляющих так называемый провоспалительный фенотип, ассоциированный со старением [14, 35].
Одним из факторов, определяющих структуру хроматина, является ядерный архитектурный белок HMGB2, экспрессия которого снижается в ходе клеточного старения, что, в частности, рассматривается в качестве раннего маркера клеточного старения [14, 38]. Снижение уровня экспрессии гена HMGB2 также было обнаружено при хронологическом, стресс-индуцированном и репликативном старении МСК. Интересно отметить, что на модели онкоген-индуцированного клеточного старения было показано, что HMGB2 предотвращает распространение гетерохроматина в геномных районах, содержащих гены, формирующие так называемый провоспалительный фенотип, ассоциированный со старением, влияя таким образом на поддержание их экспрессии [14]. Подобный эффект не был подтвержден на модели репликативного старения. Вместе с тем формирование более пермиссивного состояния хроматина в ходе старения, обусловленное нарушениями системы поддержания факультативного и конститутивного гетерохроматина; перестройка пространственной топологии ядра; активация внутриклеточных провоспалительных сигнальных путей в ответ на повреждение ДНК (cGAS-STING) являются ключевыми факторами, определяющими формирование SASP [15, 37, 39].
Понятие секреторного фенотипа, ассоциированного со старением, объединяет комплекс провоспалительных цитокинов, факторов роста и металлопротеиназ [40]. К основным факторам, формирующим SASP, причисляют TNFα, MCP-1, MCP-2, SERPINE1/PAI-1, GM-CSF, GROα, β, γ, IGFBP-7, интерлейкины IL-1α, IL-6, IL-7, IL-8, хемокин MIP1α, а также матриксные металлопротеиназы MMP-1, MMP-10 и MMP-3 [41]. Вместе с тем важно отметить, что в зависимости от причины клеточного старения и клеточного типа значительно меняется состав SASP [18]. Интересно, что при сравнении МСК доноров разного возраста не было обнаружено существенной динамики экспрессии генов, кодирующих отдельные интерлейкины. При этом в ходе культивации и при стресс-индуцированном старении активировались провоспалительные факторы SASP, такие как IL-6, CXCL8, IL-1β. Отчасти это наблюдение идет вразрез с показанным ранее увеличением активности таких факторов SASP в МСК более возрастных доноров [42]. Следует, однако, отметить, что в указанной работе убедительная разница в экспрессии была продемонстрирована только для IL-6. Кроме того, проведенный нами анализ опубликованных транскриптомов образцов КМ-МСК (n=37) не выявил достоверной корреляции экспрессии исследованных генов, кодирующих отдельные компоненты SASP, с возрастом. Все вместе это может свидетельствовать о гетерогенности и значительном вкладе донор-специфичных эффектов, затрудняющих анализ возраст-зависимых изменений генной экспрессии. Это также подтверждается достигнутыми параметрами регрессионной модели для предсказания хронологического возраста имеющей достаточно высокое значение средней абсолютной ошибки (R2=0,755; MAE=9,858 года).
Необходимо отметить, что описанные ранее предиктивные модели для оценки возраста на основе транскриптомных данных демонстрируют близкую эффективность [20, 43, 44]. Более точные подобные алгоритмы, как правило, показывают максимальную производительность на узких возрастных когортах. Кроме того, в ходе разработки авторы исключали множество доступных образцов для анализа, поскольку их добавление существенно ухудшало качество модели [45]. Таким образом, оценка динамики экспрессии генов в большей степени может быть использована для анализа клеточного старения in vitro. В таком случае, как правило, исследуется ограниченное количество клеточных линий в достаточно стандартизованных условиях культивирования, что, по всей вероятности, позволяет снизить вариабельность профилей экспрессии генов, присущую первичным донорским клеточным культурам и образцам. Аналогичным образом, согласно полученным нами данным, оценка длины теломер МСК, по меньшей мере на небольших выборках, также в большей степени применима для оценки репликативного клеточного старения invitro.
Методы цитологического анализа широко применяются для исследования клеточного старения. Старение клеток сопровождается характерными морфологическими изменениями, такими как уплощение, увеличение в размерах клетки и ядра, а также проявление характерных белковых маркеров, среди которых классическим маркером клеточного старения считается цитохимическая оценка активности β-галактозидазы, ассоциированной со старением [3, 46]. В представленной работе активность β-галактозидазы использовалась для качественной оценки процессов клеточного старения in vitro как при репликативном, так и при стресс-индуцированном старении. Вместе с тем применение этого маркера для оценки функционального состояния клеток, полученных от доноров разного возраста, требует стандартизации ряда условий. Во-первых, следует осуществлять контроль эффективности работы лота используемых реагентов, поскольку сдвиг pH применяемых реагентов может значительно исказить результаты. С учетом необходимости анализа свежеприготовленных препаратов это не всегда выполнимо в серийных экспериментах, проводимых в условиях научной лаборатории. Кроме того, клеточные препараты должны демонстрировать близкую клеточную плотность, поскольку повышенная конфлюентность способна приводить к искаженным результатам [47]. Интерпретация полученных результатов на ранних стадиях клеточного старения может быть затруднена отсутствием некоего фиксированного порогового значения активности β-галактозидазы, что в свою очередь затрудняет отнесение клеток к позитивным или негативным по этому маркеру. Все вместе это ограничивает использование данного маркера для исследования клеточных препаратов, полученных от доноров различного возраста.
В качестве альтернативы можно рассматривать подходы к оценке клеточного старения, основанные на анализе представленности нескольких белковых маркеров, ассоциированных, например, с пролиферацией, апоптозом и повреждением ДНК [17]. Вместе с тем применимость подобных подходов в очередной раз ограничивается сложностью подбора оптимальных маркеров. Так, например, экспрессия широко используемого в качестве маркера пролиферации белка Ki-67 зависит от стадии клеточного цикла, а вариант гистона γH2Ax — маркер повреждения ДНК — обнаруживается на более поздних стадиях клеточного старения [17, 48].
С развитием методов машинного обучения была предложена концепция, согласно которой процессивный анализ клеточной морфологии может служить интегральной метрикой клеточного старения [21, 49, 50]. Для оценки применимости подобного подхода мы подготовили сегментационную нейросетевую модель для автоматизированной оценки параметров ядерной морфологии. При анализе КМ-МСК от доноров разного возраста на ранних пассажах диапазон размеров ядер был шире в клеточных препаратах доноров старшей возрастной группы. Размер ядер планомерно увеличивался в ходе культивации МСК, при этом на более поздних пассажах размер ядер КМ-МСК доноров разных возрастов не демонстрировал достоверных отличий между возрастными группами. Наиболее резкое изменение ядерной морфологии наблюдалось при стресс-индуцированном клеточном старении. Подготовленная модель также позволяет достаточно эффективно классифицировать пассаж отдельных клеток в качестве суррогатной метрики стадии клеточного старения для препаратов пуповинных МСК. В связи с этим можно предположить возможность ее аналогичного использования и для оценки функционального состояния препаратов КМ-МСК доноров, при условии наличия достаточного количества данных для формирования обучающей выборки. Кроме того, представляет интерес применение подобных моделей для оценки эффектов, направленных на снижение проявлений клеточного старения, таких как, например, реювенация частичным репрограммированием [51, 52].
Заключение
В ходе работы были изучены отдельные аспекты фенотипических проявлений различных типов клеточного старения у МСК. На уровне исследования отдельных генов, динамика экспрессии которых ассоциирована со старением, показано, что изменение уровня экспрессии CDKN1A, LMNB1,HMGB2 и SERPINE1/PAI1 наблюдается во всех рассмотренных моделях клеточного старения. Вместе с тем анализ транскриптомных данных продемонстрировал существенную донор-зависимую гетерогенность профилей экспрессии генов, которая затрудняет построение эффективных предиктивных моделей для оценки хронологического возраста и протяженности культивирования клеточных препаратов. Альтернативной предиктивной метрикой клеточного старения, по меньшей мере в случае репликативного старения, может служить изменение морфологии ядра, анализ динамики которой нейросетевыми моделями позволяет оценить протяженность культивирования invitro. Комбинация таких подходов с другими перспективными метриками оценки старения, такими как алгоритмы эпигенетических часов, позволяет надеяться на разработку функциональных алгоритмов оценки феномена клеточного старения.
Финансирование. Исследование проведено при финансовой поддержке Российского научного фонда в рамках научного проекта №22-74-10123.
Конфликт интересов отсутствует.
Литература
- Margiana R., Markov A., Zekiy A.O., Hamza M.U., Al-Dabbagh K.A., Al-Zubaidi S.H., Hameed N.M., Ahmad I., Sivaraman R., Kzar H.H., Al-Gazally M.E., Mustafa Y.F., Siahmansouri H. Clinical application of mesenchymal stem cell in regenerative medicine: a narrative review. Stem Cell Res Ther 2022; 13(1): 366, https://doi.org/10.1186/s13287-022-03054-0.
- Galderisi U., Peluso G., Di Bernardo G. Clinical trials based on mesenchymal stromal cells are exponentially increasing: where are we in recent years? Stem Cell Rev Rep 2022; 18(1): 23–36, https://doi.org/10.1007/s12015-021-10231-w.
- Campisi J., d’Adda di Fagagna F. Cellular senescence: when bad things happen to good cells. Nat Rev Mol Cell Biol 2007; 8(9): 729–740, https://doi.org/10.1038/nrm2233.
- Zha K., Li X., Yang Z., Tian G., Sun Z., Sui X., Dai Y., Liu S., Guo Q. Heterogeneity of mesenchymal stem cells in cartilage regeneration: from characterization to application. NPJ Regen Med 2021; 6(1): 14, https://doi.org/10.1038/s41536-021-00122-6.
- Alm J.J., Qian H., Le Blanc K. Chapter 13 — Clinical grade production of mesenchymal stromal cells. In: Tissue engineering. Elsevier; 2014; p. 427–469, https://doi.org/10.1016/B978-0-12-420145-3.00013-4.
- Xiang S., Gao W., Peng H., Liu A., Ao Q., Yang M., Yu Y., Liu Y., Rong R. Standards of clinical-grade mesenchymal stromal cell preparation and quality control (2020 China version). J Neurorestoratol 2020; 8(4): 197–216, https://doi.org/10.26599/JNR.2020.9040021.
- López-Otín C., Blasco M.A., Partridge L., Serrano M., Kroemer G. Hallmarks of aging: an expanding universe. Cell 2023; 186(2): 243–278, https://doi.org/10.1016/j.cell.2022.11.001.
- Kuilman T., Michaloglou C., Mooi W.J., Peeper D.S. The essence of senescence. Genes Dev 2010; 24(22): 2463–2479, https://doi.org/10.1101/gad.1971610.
- Pazolli E., Alspach E., Milczarek A., Prior J., Piwnica-Worms D., Stewart S.A. Chromatin remodeling underlies the senescence-associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Res 2012; 72(9): 2251–2261, https://doi.org/10.1158/0008-5472.CAN-11-3386.
- Mikuła-Pietrasik J., Niklas A., Uruski P., Tykarski A., Książek K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cell Mol Life Sci 2020; 77(2): 213–229, https://doi.org/10.1007/s00018-019-03261-8.
- Kumari R., Jat P. Mechanisms of cellular senescence: cell cycle arrest and senescence associated secretory phenotype. Front Cell Dev Biol 2021; 9: 645593, https://doi.org/10.3389/fcell.2021.645593.
- González-Gualda E., Baker A.G., Fruk L., Muñoz-Espín D. A guide to assessing cellular senescence in vitro and in vivo. FEBS J 2021; 288(1): 56–80, https://doi.org/10.1111/febs.15570.
- Carnero A. Markers of cellular senescence. Methods Mol Biol 2013; 965: 63–81, https://doi.org/10.1007/978-1-62703-239-1_4.
- Aird K.M., Iwasaki O., Kossenkov A.V., Tanizawa H., Fatkhutdinov N., Bitler B.G., Le L., Alicea G., Yang T.L., Johnson F.B., Noma K.I., Zhang R. HMGB2 orchestrates the chromatin landscape of senescence-associated secretory phenotype gene loci. J Cell Biol 2016; 215(3): 325–334, https://doi.org/10.1083/jcb.201608026.
- Shah P.P., Donahue G., Otte G.L., Capell B.C., Nelson D.M., Cao K., Aggarwala V., Cruickshanks H.A., Rai T.S., McBryan T., Gregory B.D., Adams P.D., Berger S.L. Lamin B1 depletion in senescent cells triggers large-scale changes in gene expression and the chromatin landscape. Genes Dev 2013; 27(16): 1787–1799, https://doi.org/10.1101/gad.223834.113.
- Criscione S.W., Teo Y.V., Neretti N. The chromatin landscape of cellular senescence. Trends Genet 2016; 32(11): 751–761, https://doi.org/10.1016/j.tig.2016.09.005.
- Galvis D., Walsh D., Harries L.W., Latorre E., Rankin J. A dynamical systems model for the measurement of cellular senescence. J R Soc Interface 2019; 16(159): 20190311, https://doi.org/10.1098/rsif.2019.0311.
- Coppé J.P., Desprez P.Y., Krtolica A., Campisi J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu Rev Pathol 2010; 5: 99–118, https://doi.org/10.1146/annurev-pathol-121808-102144.
- Simpson D.J., Chandra T. Epigenetic age prediction. Aging Cell 2021; 20(9): e13452, https://doi.org/10.1111/acel.13452.
- Mamoshina P., Volosnikova M., Ozerov I.V., Putin E., Skibina E., Cortese F., Zhavoronkov A. Machine learning on human muscle transcriptomic data for biomarker discovery and tissue-specific drug target identification. Front Genet 2018; 9: 242, https://doi.org/10.3389/fgene.2018.00242.
- Heckenbach I., Mkrtchyan G.V., Ezra M.B., Bakula D., Madsen J.S., Nielsen M.H., Oró D., Osborne B., Covarrubias A.J., Idda M.L., Gorospe M., Mortensen L., Verdin E., Westendorp R., Scheibye-Knudsen M. Nuclear morphology is a deep learning biomarker of cellular senescence. Nat Aging 2022; 2(8): 742–755, https://doi.org/10.1038/s43587-022-00263-3.
- Debacq-Chainiaux F., Erusalimsky J.D., Campisi J., Toussaint O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nat Protoc 2009; 4(12): 1798–1806, https://doi.org/10.1038/nprot.2009.191.
- Andrzejewska A., Catar R., Schoon J., Qazi T.H., Sass F.A., Jacobi D., Blankenstein A., Reinke S., Krüger D., Streitz M., Schlickeiser S., Richter S., Souidi N., Beez C., Kamhieh-Milz J., Krüger U., Zemojtel T., Jürchott K., Strunk D., Reinke P., Duda G., Moll G., Geissler S. Multi-parameter analysis of biobanked human bone marrow stromal cells shows little influence for donor age and mild comorbidities on phenotypic and functional properties. Front Immunol 2019; 10: 2474, https://doi.org/10.3389/fimmu.2019.02474.
- Ayhan S., Nemutlu E., Uçkan Çetinkaya D., Kır S., Özgül R.K. Characterization of human bone marrow niches with metabolome and transcriptome profiling. J Cell Sci 2021; 134(6): jcs250720, https://doi.org/10.1242/jcs.250720.
- Li H., Handsaker B., Wysoker A., Fennell T., Ruan J., Homer N., Marth G., Abecasis G., Durbin R; 1000 Genome Project Data Processing Subgroup. The sequence alignment/Map format and SAMtools. Bioinformatics 2009; 25(16): 2078–2079, https://doi.org/10.1093/bioinformatics/btp352.
- Dobin A., Davis C.A., Schlesinger F., Drenkow J., Zaleski C., Jha S., Batut P., Chaisson M., Gingeras T.R. STAR: ultrafast universal RNA-seq aligner. Bioinformatics 2013; 29(1): 15–21, https://doi.org/10.1093/bioinformatics/bts635.
- Liao Y., Smyth G.K., Shi W. featureCounts: an efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics 2014; 30(7): 923–930, https://doi.org/10.1093/bioinformatics/btt656.
- Zhang Y., Parmigiani G., Johnson W.E. ComBat-seq: batch effect adjustment for RNA-seq count data. NAR Genomics and Bioinformatics 2020; 2(3), https://doi.org/10.1093/nargab/lqaa078.
- Robinson M.D., McCarthy D.J., Smyth G.K. edgeR: a bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics 2010; 26(1): 139–140, https://doi.org/10.1093/bioinformatics/btp616.
- Pedregosa F., Varoquaux G., Gramfort A., Michel V., Thirion B., Grisel O., Blondel M., Prettenhofer P., Weiss R., Dubourg V., Vanderplas J., Passos A., Cournapeau D., Brucher M., Perrot M., Duchesnay E. Scikit-learn: machine learning in Python. Journal of Machine Learning Research 2011; 12: 2825–2830.
- Kirillov A., Mintun E., Ravi N., Mao H., Rolland C., Gustafson L., Xiao T., Whitehead S., Berg A.C., Lo W.-Y., Dollár P., Girshick R. Segment anything. In: 2023 IEEE/CVF International Conference on Computer Vision (ICCV). 2023, https://doi.org/10.1109/iccv51070.2023.00371.
- Chen L.C., Zhu Y., Papandreou G., Schroff F., Adam H. Encoder-decoder with atrous separable convolution for semantic image segmentation. In: Ferrari V., Hebert M., Sminchisescu C., Weiss Y. (editors). Computer Vision — ECCV 2018. ECCV 2018. Lecture Notes in Computer Science, vol. 11211. Springer, Cham; 2018, https://doi.org/10.1007/978-3-030-01234-2_49.
- Tan M., Le Q. EfficientNet: rethinking model scaling for convolutional neural networks. In: Le Proceedings of the 36th International Conference on Machine Learning, PMLR 2019; 97: 6105–6114.
- Freund A., Laberge R.M., Demaria M., Campisi J. Lamin B1 loss is a senescence-associated biomarker. Mol Biol Cell 2012; 23(11): 2066–2075, https://doi.org/10.1091/mbc.E11-10-0884.
- Narita M., Nũnez S., Heard E., Narita M., Lin A.W., Hearn S.A., Spector D.L., Hannon G.J., Lowe S.W. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell 2003; 113(6): 703–716, https://doi.org/10.1016/s0092-8674(03)00401-x.
- Sati S., Bonev B., Szabo Q., Jost D., Bensadoun P., Serra F., Loubiere V., Papadopoulos G.L., Rivera-Mulia J.C., Fritsch L., Bouret P., Castillo D., Gelpi J.L., Orozco M., Vaillant C., Pellestor F., Bantignies F., Marti-Renom M.A., Gilbert D.M., Lemaitre J.M., Cavalli G. 4D genome rewiring during oncogene-induced and replicative senescence. Mol Cell 2020; 78(3): 522–538.e9, https://doi.org/10.1016/j.molcel.2020.03.007.
- Dasgupta N., Arnold R., Equey A., Gandhi A., Adams P.D. The role of the dynamic epigenetic landscape in senescence: orchestrating SASP expression. NPJ Aging 2024; 10(1): 48, https://doi.org/10.1038/s41514-024-
- 00172-2.
- Zirkel A., Nikolic M., Sofiadis K., Mallm J.P., Brackley C.A., Gothe H., Drechsel O., Becker C., Altmüller J., Josipovic N., Georgomanolis T., Brant L., Franzen J., Koker M., Gusmao E.G., Costa I.G., Ullrich R.T., Wagner W., Roukos V., Nürnberg P., Marenduzzo D., Rippe K., Papantonis A. HMGB2 loss upon senescence entry disrupts genomic organization and induces CTCF clustering across cell types. Mol Cell 2018; 70(4): 730–744.e6, https://doi.org/10.1016/j.molcel.2018.03.030.
- Miller K.N., Dasgupta N., Liu T., Adams P.D., Vizioli M.G. Cytoplasmic chromatin fragments-from mechanisms to therapeutic potential. Elife 2021; 10: e63728, https://doi.org/10.7554/eLife.63728.
- Coppé J.P., Patil C.K., Rodier F., Sun Y., Muñoz D.P., Goldstein J., Nelson P.S., Desprez P.Y., Campisi J. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol 2008; 6(12): 2853–2868, https://doi.org/10.1371/journal.pbio.0060301.
- Freund A., Orjalo A.V., Desprez P.Y., Campisi J. Inflammatory networks during cellular senescence: causes and consequences. Trends Mol Med 2010; 16(5): 238–246, https://doi.org/10.1016/j.molmed.2010.03.003.
- Gnani D., Crippa S., Della Volpe L., Rossella V., Conti A., Lettera E., Rivis S., Ometti M., Fraschini G., Bernardo M.E., Di Micco R. An early-senescence state in aged mesenchymal stromal cells contributes to hematopoietic stem and progenitor cell clonogenic impairment through the activation of a pro-inflammatory program. Aging Cell 2019; 18(3): e12933, https://doi.org/10.1111/acel.12933.
- Peters M.J., Joehanes R., Pilling L.C., Schurmann C., Conneely K.N., Powell J., Reinmaa E., Sutphin G.L., Zhernakova A., Schramm K., Wilson Y.A., Kobes S., Tukiainen T.; NABEC/UKBEC Consortium; Ramos Y.F., Göring H.H., Fornage M., Liu Y., Gharib S.A., Stranger B.E., De Jager P.L., Aviv A., Levy D., Murabito J.M., Munson P.J., Huan T., Hofman A., Uitterlinden A.G., Rivadeneira F., van Rooij J., Stolk L., Broer L., Verbiest M.M., Jhamai M., Arp P., Metspalu A., Tserel L., Milani L., Samani N.J., Peterson P., Kasela S., Codd V., Peters A., Ward-Caviness C.K., Herder C., Waldenberger M., Roden M., Singmann P., Zeilinger S., Illig T., Homuth G., Grabe H.J., Völzke H., Steil L., Kocher T., Murray A., Melzer D., Yaghootkar H., Bandinelli S., Moses E.K., Kent J.W., Curran J.E., Johnson M.P., Williams-Blangero S., Westra H.J., McRae A.F., Smith J.A., Kardia S.L., Hovatta I., Perola M., Ripatti S., Salomaa V., Henders A.K., Martin N.G., Smith A.K., Mehta D., Binder E.B., Nylocks K.M., Kennedy E.M., Klengel T., Ding J., Suchy-Dicey A.M., Enquobahrie D.A., Brody J., Rotter J.I., Chen Y.D., Houwing-Duistermaat J., Kloppenburg M., Slagboom P.E., Helmer Q., den Hollander W., Bean S., Raj T., Bakhshi N., Wang Q.P., Oyston L.J., Psaty B.M., Tracy R.P., Montgomery G.W., Turner S.T., Blangero J., Meulenbelt I., Ressler K.J., Yang J., Franke L., Kettunen J., Visscher P.M., Neely G.G., Korstanje R., Hanson R.L., Prokisch H., Ferrucci L., Esko T., Teumer A., van Meurs J.B., Johnson A.D. The transcriptional landscape of age in human peripheral blood. Nat Commun 2015; 6: 8570, https://doi.org/10.1038/ncomms9570.
- Fleischer J.G., Schulte R., Tsai H.H., Tyagi S., Ibarra A., Shokhirev M.N., Huang L., Hetzer M.W., Navlakha S. Predicting age from the transcriptome of human dermal fibroblasts. Genome Biol 2018; 19(1): 221, https://doi.org/10.1186/s13059-018-1599-6.
- Shokhirev M.N., Johnson A.A. Modeling the human aging transcriptome across tissues, health status, and sex. Aging Cell 2021; 20(1): e13280, https://doi.org/10.1111/acel.13280.
- Dimri G.P., Lee X., Basile G., Acosta M., Scott G., Roskelley C., Medrano E.E., Linskens M., Rubelj I., Pereira-Smith O. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proc Natl Acad Sci U S A 1995; 92(20): 9363–9367, https://doi.org/10.1073/pnas.92.20.9363.
- Nadeau S., Cheng A., Colmegna I., Rodier F. Quantifying senescence-associated phenotypes in primary multipotent mesenchymal stromal cell cultures. Methods Mol Biol 2019; 2045: 93–105, https://doi.org/10.1007/7651_2019_217.
- Bruno S., Darzynkiewicz Z. Cell cycle dependent expression and stability of the nuclear protein detected by Ki-67 antibody in HL-60 cells. Cell Prolif 1992; 25(1): 31–40, https://doi.org/10.1111/j.1365-2184.1992.tb01435.x.
- Kusumoto D., Seki T., Sawada H., Kunitomi A., Katsuki T., Kimura M., Ito S., Komuro J., Hashimoto H., Fukuda K., Yuasa S. Anti-senescent drug screening by deep learning-based morphology senescence scoring. Nat Commun 2021; 12(1): 257, https://doi.org/10.1038/s41467-020-20213-0.
- Weber L., Lee B.S., Imboden S., Hsieh C.J., Lin N.Y.C. Phenotyping senescent mesenchymal stromal cells using AI image translation. Curr Res Biotechnol 2023; 5: 100120, https://doi.org/10.1016/j.crbiot.2023.100120.
- Olova N., Simpson D.J., Marioni R.E., Chandra T. Partial reprogramming induces a steady decline in epigenetic age before loss of somatic identity. Aging Cell 2019; 18(1): e12877, https://doi.org/10.1111/acel.12877.
- Singh P.B., Laktionov P.P., Newman A.G. Deconstructing age reprogramming. Journal of Biosciences 2019; 44(4), https://doi.org/10.1007/s12038-019-9923-1.