Взаимосвязь показателей нутритивного статуса и спирометрических параметров у детей с бронхиальной астмой
В настоящее время активно изучаются механизмы негативной модификации бронхиальной астмы (БА) на фоне ожирения. Вопрос о влиянии избыточной массы тела на формирование бронхиальной обструкции у детей с БА остается предметом дискуссии.
Цель исследования — изучение взаимосвязи спирометрических параметров, отражающих бронхиальную проходимость, с нутритивным статусом у детей с астмой.
Материалы и методы. В исследовании приняли участие 54 пациента с БА в возрасте от 8 до 17 лет, из них 33 мальчика и 21 девочка. Оценку состояния питания проводили с расчетом индекса массы тела (ИМТ), относительного индекса массы тела (ОИМТ) и определения жира в организме (%). Были проанализированы такие параметры спирограммы, как форсированная жизненная емкость легких (ФЖЕЛ), объем форсированного выдоха за 1 с (ОФВ1), отношение ОФВ1/ФЖЕЛ, максимальная объемная скорость выдоха на уровне 25% ФЖЕЛ ( МОС 25).
Результаты. Среди обследованных детей 9,3% (5/54) имели низкую массу тела (1-я группа); 33,3% (18/54) — нормальную (2-я группа); 31,5% (17/54) — избыточную массу (3-я группа) и 25,9% (14/54) — ожирение (4-я группа). По мере увеличения ИМТ наблюдалось статистически значимое уменьшение соотношения ОФВ1/ФЖЕЛ, составившее в соответствующих группах 84,6 [79,3; 90,0]; 79,4 [76,6; 82,2]; 74,6 [71,7; 77,5] и 70,2 [67,0; 73,4]%; р=0,003. Увеличение ИМТ сопровождалось также прогредиентным снижением МОС 25 в процентах от долженствующих величин (%дв), которое составило в соответствующих группах 95,6 [76,1; 115,2]; 81,7 [71,4; 92,0]; 56,3 [45,7; 66,9] и 48,4 [36,7; 60,1]%; р=0,003. Статистически значимая отрицательная корреляционная взаимосвязь была обнаружена между показателями нутритивного статуса, включая ИМТ, ОИМТ и процент жира в организме, и такими параметрами спирометрии, как отношение ОФВ1/ФЖЕЛ и МОС 25 (%дв); все р<0,01.
Заключение. Избыточная масса тела и ожирение у детей с БА, оцениваемые как расчетными методами с определением ИМТ и ОИМТ, так и прямым определением содержания жира в организме с помощью монитора состава тела, сопровождаются статистически значимым снижением бронхиальной проходимости, что позволяет рассматривать данные методы как необходимый компонент объективного обследования.
Введение
Бронхиальная астма (БА) представляет собой гетерогенное заболевание, которое характеризуется обратимым нарушением бронхиальной проходимости и наличием таких респираторных симптомов, как свистящие хрипы, одышка, кашель, заложенность в груди, которые варьируют по времени и интенсивности [1]. Патогенетической основой БА служит хроническое аллергическое воспаление дыхательных путей, ассоциированное с бронхиальной гиперреактивностью. Целью терапии БА на современном этапе является достижение контроля над симптомами, течением и факторами риска обострения болезни, реализуемое в ходе базовой противовоспалительной терапии. Считается, что контроль БА может быть достигнут у всех пациентов [1, 2], однако некоторые авторы показывают, что до 56% больных не имеют должного уровня контроля заболевания [3].
Существенным препятствием для достижения контроля БА является наличие коморбидных состояний [4–8]. В списке распространенных вариантов коморбидности особое внимание уделяется сочетанию БА и ожирения [9–11]. Существует мнение, что это сочетание может способствовать взаимному отягощению течения данных болезней [12]. В настоящее время активно изучаются потенциальные механизмы негативной модификации БА под влиянием ожирения, включая неблагоприятное воздействие избыточной массы тела на параметры внешнего дыхания [13, 14].
Приоритетным методом изучения функциональных особенностей респираторного тракта признается метод спирометрии. Данный метод включен в современные рекомендации по ведению больных БА и является «золотым стандартом» оценки бронхиальной проходимости/бронхиальной обструкции [1, 15–17]. В качестве основного критерия оценки нутритивного статуса как у взрослых пациентов, так и у детей ВОЗ рекомендует использовать индекс массы тела (масса тела/рост2 — ИМТ) [11].
Имеющиеся современные данные о влиянии избыточной массы тела и ожирения на спирометрические параметры, характеризующие бронхиальную проходимость у пациентов с БА, весьма противоречивы. E. Forno и J.C. Celedón [18, 19] на основании выполненного метаанализа сообщили, что связь между ИМТ и таким важнейшим спирометрическим индексом, характеризующим бронхиальную проходимость, как объем форсированного выдоха за 1 с (ОФВ1) в процентах от долженствующих величин (% predicted — %дв), в настоящее время нельзя считать установленной. В исследовании, проведенном M.J. Kasteleyn с соавт. [20], показано, что ожирение отрицательно влияет на функцию легких у взрослых пациентов с БА. У таких пациентов отмечено снижение ОФВ1 и форсированной жизненной емкости легких (ФЖЕЛ) по сравнению с больными БА без ожирения. Аналогичные результаты получены А.R. Somashekar и A.N. Sowmya [21], которые обнаружили значительную обратную корреляцию между значениями ОФВ1 и ИМТ у пациентов с астмой в возрасте 7–12 лет. В то же время в работе R. Wang с соавт. [22] были получены парадоксальные результаты. Авторы обнаружили, что более высокий ИМТ был статистически значимо напрямую связан с увеличением ОФВ1 и ФЖЕЛ, но только у девочек. В исследовании K. Tantisira и соавт. [23] также установлено, что у детей с БА в возрасте от 5 до 12 лет рост показателей ИМТ сопровождается увеличением ОФВ1 и ФЖЕЛ, но снижением индекса ОФВ1/ФЖЕЛ. В работе Т.С. Yao с соавт. [13] повышение ИМТ было связано с увеличением ОФВ1 и ФЖЕЛ, но имело отрицательную связь с индексом Тиффно (ОФВ1/ФЖЕЛ).
Таким образом, у детей с БА характер взаимосвязи ожирения и спирометрических параметров бронхиальной проходимости нельзя считать установленным. Существующие противоречия могут быть обусловлены тем, что в основной массе исследований, посвященных изучению влияния ожирения на спирометрические показатели у детей с БА, в качестве критерия оценки состояния питания в соответствии с рекомендациями ВОЗ используется ИМТ. Однако очевидно, что одни и те же значения ИМТ могут соответствовать различным типам нутритивного статуса у детей разного возраста и пола [11]. Так, например, у мальчика 11 лет со средним физическим развитием (рост 143 см) ИМТ, равный 17,0, будет соответствовать медианным популяционным значениям данного показателя по критериям ВОЗ. У девочки 5 лет при росте 110 см такие же значения ИМТ будут соответствовать критериям избыточной массы тела (+1Z по шкале Z-score), а у 17-летней девочки, имеющей рост 163 см, — белково-энергетической недостаточности (–2Z по шкале Z-score). Это усложняет формирование унифицированных баз данных для изучения взаимосвязи между состоянием питания и респираторными параметрами у пациентов в детском возрасте и может быть одной из причин получения противоречивых результатов. Чтобы преодолеть эти трудности, мы предложили метод изучения нутритивного статуса у детей с введением параметра ОИМТ (относительный ИМТ), который рассчитывается как отношение ИМТ пациента к медианным значениям ИМТ для данного возраста и пола, опубликованным ВОЗ [11, 24].
Кроме того, очевидно, что ИМТ будет не полностью отражать избыточное содержание жира в организме, поскольку увеличение массы тела может быть обусловлено, например, приростом мышечной массы у спортсменов, увеличением минеральной плотности костей, другими факторами [25, 26]. В связи с этим представляется целесообразным изучить взаимосвязь параметров внешнего дыхания не только с ИМТ, который, по сути, служит удобным скрининговым методом оценки состояния питания, но и с прямыми показателями содержания жира в организме. Исследования такого рода единичны и выполнены главным образом в когорте взрослых пациентов. Результаты представлены, в частности, в публикациях T.J. Sutherland с соавт. [27], R. Kamal с соавт. [28], N. Alaagib с соавт. [29], C.R. McLachlan с соавт. [30], J. Myung с соавт. [31].
У детей эта проблема еще менее изучена. Нами найдено две публикации по исследованию потенциального влияния содержания жира в организме на бронхиальную проходимость у пациентов детского возраста. Исследование L. Kongkiattikul и соавт. [32] продемонстрировало отрицательное влияние избыточного содержания жира на функциональную остаточную емкость легких у детей. В работе S. Mukherjee и D.K. Mukhopadhyay [33] значимая разница в значениях ФЖЕЛ и ОФВ1 была получена между субъектами с недостаточной массой тела, нормальной и избыточной массой тела. При этом процент жира в организме коррелировал со спирометрическими параметрами сильнее, чем ИМТ.
Таким образом, влияние статуса питания на бронхиальную проходимость у детей с БА нельзя считать установленным. Это затрудняет понимание механизмов негативного влияния ожирения на течение БА у детей. В связи с этим целью настоящего исследования явилось изучение взаимосвязи спирометрических параметров, отражающих бронхиальную проходимость, с показателями, характеризующими статус питания у детей с БА, включая индекс массы тела, относительный индекс массы тела и содержание жира в организме.
Материалы и методы
Формирование когорты пациентов. Исследование выполнено в соответствии с Хельсинкской декларацией (2013) и одобрено Этическим комитетом Приволжского исследовательского медицинского университета. Информированное согласие было получено от пациентов в возрасте от 15 до 17 лет и от родителей пациентов в возрасте до 15 лет в соответствии с Федеральным законом №323 от 21.11.2011 г. «Основы законодательства Российской Федерации об охране здоровья граждан».
Обследовано 54 ребенка и подростка в возрасте от 8 до 17 лет (33 мальчика (61,1%) и 21 девочка (38,9%)), находившихся на лечении по поводу атопической БА в Детской городской клинической больнице №1 Н. Новгорода в 2018–2019 гг.
Критерием включения в исследование служил диагноз БА, поставленный в соответствии с действующими международными и национальными согласительными документами (GINA report «Global strategy for asthma management and prevention», 2016–2019 гг.) [1, 34]. Критериями исключения являлись наличие острых инфекционных заболеваний и лихорадки, сахарного диабета, аутоиммунных расстройств, первичных иммунодефицитов и онкологических заболеваний; пероральный прием глюкокортикоидов [35]. Диагноз БА и тяжесть заболевания были установлены лечащим врачом в соответствии с имеющимися на тот период рекомендациями. Лечение БА проводилось согласно существующим согласительным документам с учетом современных терапевтических стратегий [1, 2, 34].
Объективные измерения. Всем детям выполнены общеклиническое обследование и оценка сенсибилизации методом проведения кожных тестов на основные аллергены, сенсибилизация к которым характерна для Волго-Вятского региона России [36]. У всех пациентов также оценены основные антропометрические показатели (рост, масса тела). Массу тела измеряли без обуви и без верхней одежды, используя весы с чувствительностью до 0,01 кг. Измерения роста выполняли с помощью ростомера с делением шкалы до 0,1 см. Оценку антропометрических параметров (роста, массы тела и ИМТ) проводили в соответствии с критериями ВОЗ [11], оценку ИМТ выполняли, учитывая пол и возраст детей, с использованием критериев шкалы Z-score по рекомендациям ВОЗ [37]. В соответствии с данными оценки ИМТ в настоящей работе дети были разделены на четыре группы с разным нутритивным статусом:
к 1-й группе — со сниженной массой тела — отнесены дети со значениями ИМТ в диапазоне единиц от –1Z и менее по шкале Z-score;
ко 2-й группе — с нормальной массой тела — отнесены дети с медианными значениями ИМТ в диапазоне единиц от –1Z до +1Z;
в 3-ю группу — с избыточной массой тела — вошли дети, ИМТ которых превышал медианные значения на диапазон единиц выше +1Z, но ниже +2Z;
в 4-й группе — с ожирением — пациенты имели превышение ИМТ на +2Z и более.
Был также рассчитан дополнительный показатель — относительный ИМТ (ОИМТ), предложенный нами ранее [24]. Он представляет собой отношение полученного индивидуального ИМТ к медианному ИМТ для данного возраста и пола, взятому из материалов ВОЗ. ОИМТ в отличие от ИМТ является показателем, который уже содержит поправку на пол и возраст ребенка.
Процентное содержание жира в организме измеряли с помощью монитора состава тела Omron BF-214 (Omron, Япония).
Для количественной оценки уровня контроля БА использовали тест Asthma Сontrol Qquestionnaire-5 (ACQ-5). Значения теста менее 0,75 балла соответствовали достигнутому уровню контроля, от 0,75 до 1,5 балла — частичному уровню контроля, более 1,5 балла — отсутствию контроля заболевания [38].
Оценка функции внешнего дыхания. Спирометрические исследования проводили с использованием спирометра MasterScreen Pneumo (Jaeger, Германия) в соответствии с международными рекомендациями. Оценивали ФЖЕЛ, объем ОФВ1, МОС 25 петли «поток–объем». Данные регистрировали как в абсолютных значениях показателей, так и в относительных единицах (%дв) с учетом пола, возраста и антропометрических показателей ребенка. Также проводили оценку индекса Тиффно, который рассчитывали по формуле ИТ=ОФВ1/ФЖЕЛ [39].
Статистический анализ. Исследование было пилотным, в связи с чем расчета необходимого объема выборки не проводилось. Статистический анализ был выполнен с использованием программного пакета Statgraphics Centurion v. 16.1.17. Данные представлены в виде Мe [Q1; Q3], где Мe — медиана, [Q1; Q3] — интерквартильный размах.
При проверке выборки на нормальность для количественных признаков выборки были рассчитаны стандартизированная асимметрия (standardized skewness) и стандартизированный эксцесс (standardized kurtosis). Если эти рассчитанные значения стандартизированной асимметрии и стандартизированного эксцесса выходили за пределы диапазона от –2 до +2, то рассматриваемые количественные выборки считали отличными от нормальных. Различия между двумя группами определяли с использованием t-критерия Стьюдента для сравнения средних значений двух выборок (для выборок, имевших нормальное распределение) и с использованием W-критерия Уилкоксона (Манна–Уитни) для сравнения медиан двух выборок (для выборок, имевших распределение, отличное от нормального). Для сравнения средних значений нескольких групп (выборки с нормальным распределением) применяли дисперсионный анализ ANOVA (критерий F), для сравнения медиан нескольких групп (выборки с распределением, отличным от нормального) использовали тест Краскела–Уоллиса (критерий KWT). Взаимосвязь между спирометрическими параметрами и показателями, отражающими нутритивный статус пациентов (ИМТ, ОИМТ, процентное содержание жира в организме), оценивали с использованием ранговой корреляции Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты
Клиническая характеристика пациентов. Анализ проводили как в общей когорте, так и отдельно у мальчиков и девочек. Медианный возраст детей составил 13,41 [12,67; 14,14] лет, мальчики и девочки были сопоставимы по возрасту и показателям теста ACQ-5 (табл. 1). Антропометрические параметры мальчиков, включая рост и массу тела, были статистически значимо выше, чем у девочек. При этом косвенные индексы, характеризующие нутритивный статус, включая ИМТ и ОИМТ, у девочек и мальчиков в исследуемой выборке были сопоставимы. Следует также отметить, что у девочек показатели процентного содержания жира в организме были больше, чем у мальчиков, в силу, по-видимому, полового диморфизма. Известно, что у мальчиков в увеличении массы тела большее значение имеет масса мышечной ткани, тогда как у девочек — доля жировой ткани [40].
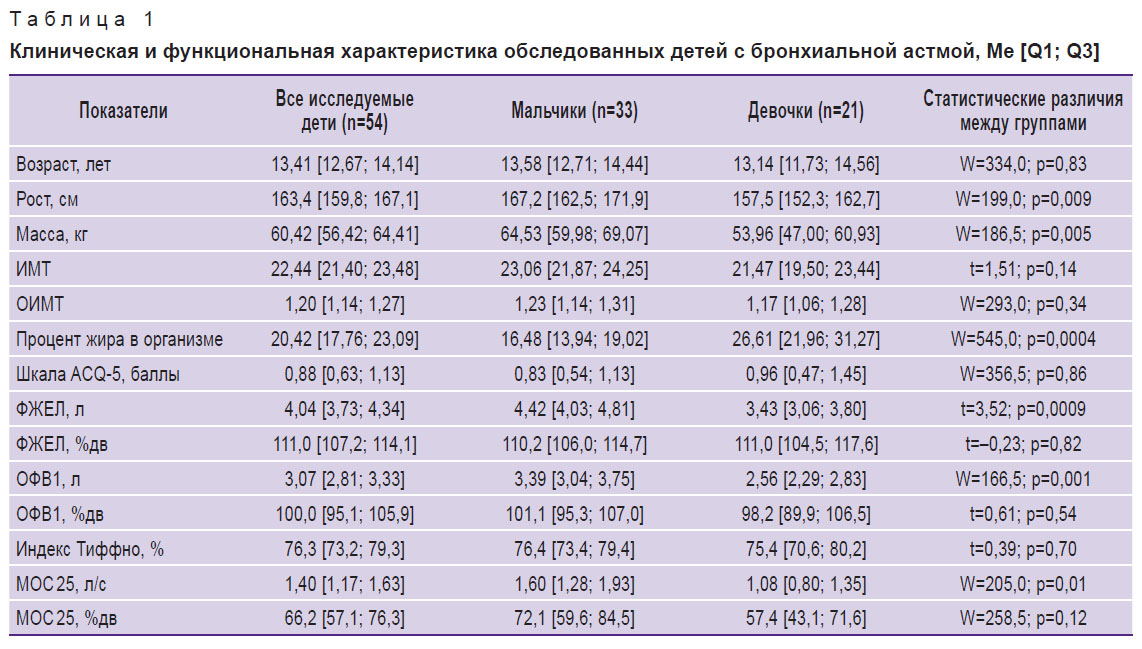
|
Таблица 1. Клиническая и функциональная характеристика обследованных детей с бронхиальной астмой, Мe [Q1; Q3] |
Параметры спирометрии, отражающие абсолютные величины внешнего дыхания, включая ФЖЕЛ (л), ОФВ1 (л), МОС 25 (л/с), у мальчиков были выше, чем у девочек. В то же время данные показатели спирометрии в относительных величинах (%дв) не имели значимых гендерных различий, что свидетельствует о сопоставимости бронхиальной проходимости в сравнении с долженствующими показателями у девочек и мальчиков в рассматриваемой выборке.
Содержание жира в организме и величина ОИМТ у детей, сгруппированных в соответствии с оценкой ИМТ по системе оценок Z-score (ВОЗ), ожидаемо прогредиентно статистически значимо возрастали по мере увеличения ИМТ как в целом в выборке, так и в группах мальчиков и девочек (табл. 2).
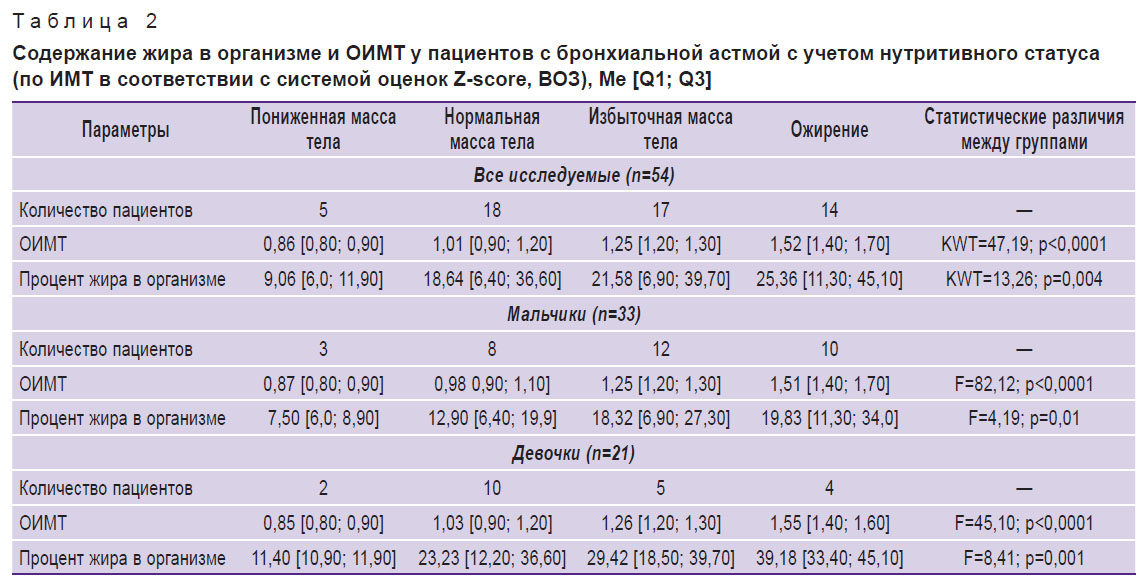 |
Таблица 2. Содержание жира в организме и ОИМТ у пациентов с бронхиальной астмой с учетом нутритивного статуса (по ИМТ в соответствии с системой оценок Z-score, ВОЗ), Мe [Q1; Q3] |
Спирометрические показатели, характеризующие бронхиальную проходимость, у детей с бронхиальной астмой с учетом их нутритивного статуса. Установлено, что в общей когорте пациентов с БА по мере увеличения ИМТ наблюдается прогредиентное статистически значимое снижение индекса Тиффно и МОС 25 (табл. 3, рис. 1). Кроме того, прослеживается тенденция к увеличению ФЖЕЛ и снижению ОФВ1 по мере увеличения ИМТ, однако эти различия не являются статистически значимыми.
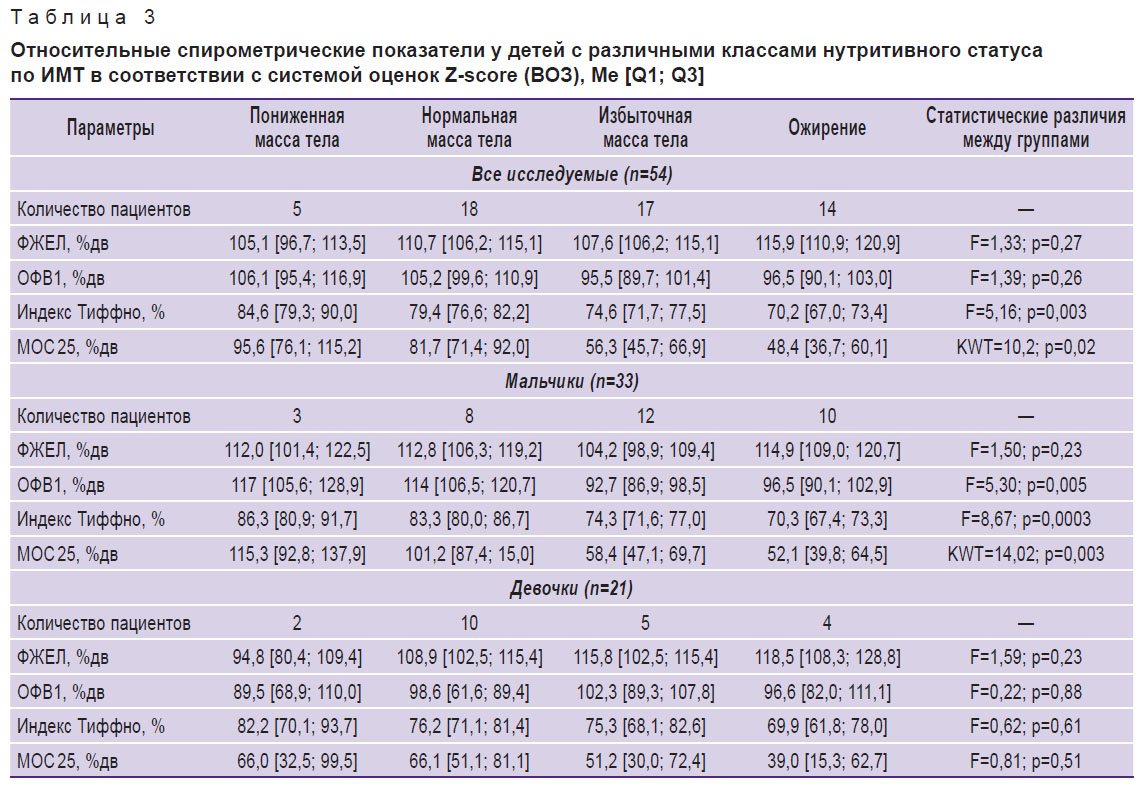
|
Таблица 3. Относительные спирометрические показатели у детей с различными классами нутритивного статуса по ИМТ в соответствии с системой оценок Z-score (ВОЗ), Мe [Q1; Q3] |
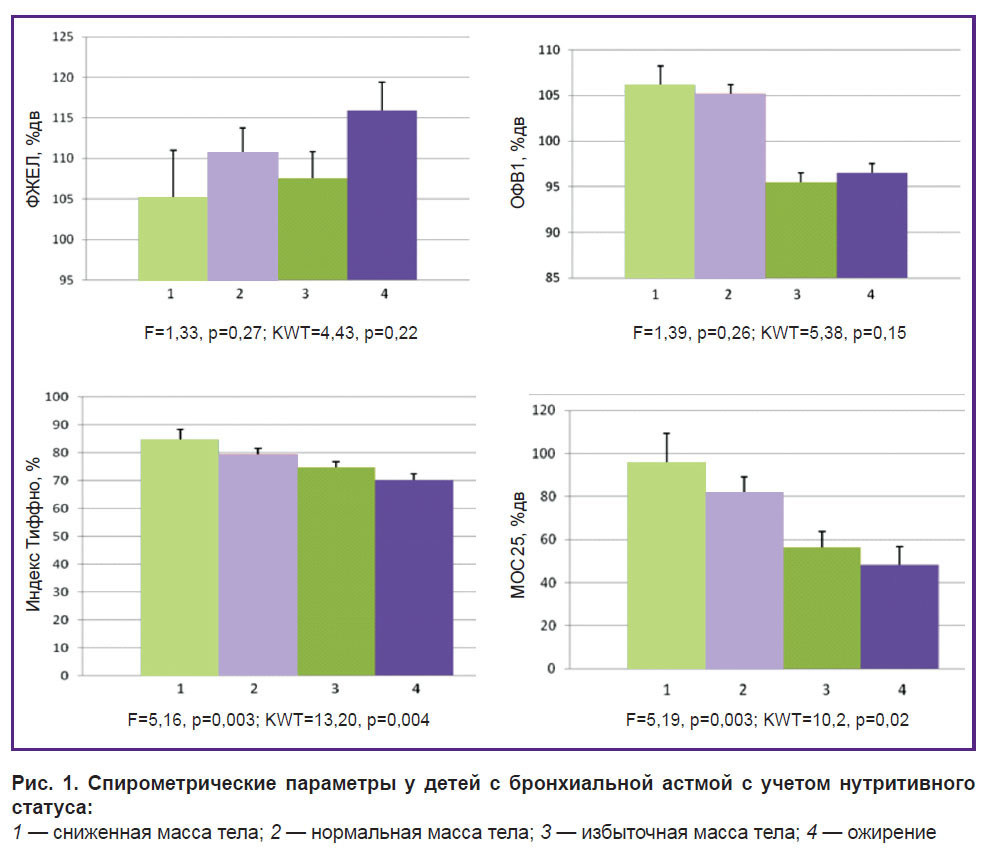
|
Рис. 1. Спирометрические параметры у детей с бронхиальной астмой с учетом нутритивного статуса:
1 — сниженная масса тела; 2 — нормальная масса тела; 3 — избыточная масса тела; 4 — ожирение |
У мальчиков по мере увеличения ИМТ выявлено статистически значимое снижение индекса Тиффно и относительных значений МОС 25 и ОФВ1. У девочек статистически значимых изменений ФЖЕЛ, ОФВ1, МОС 25 и индекса Тиффно в группах, выделенных с учетом величины ИМТ, не установлено, хотя тренды их изменения в целом соответствуют таковым как в общей когорте, так и у мальчиков (см. табл. 3).
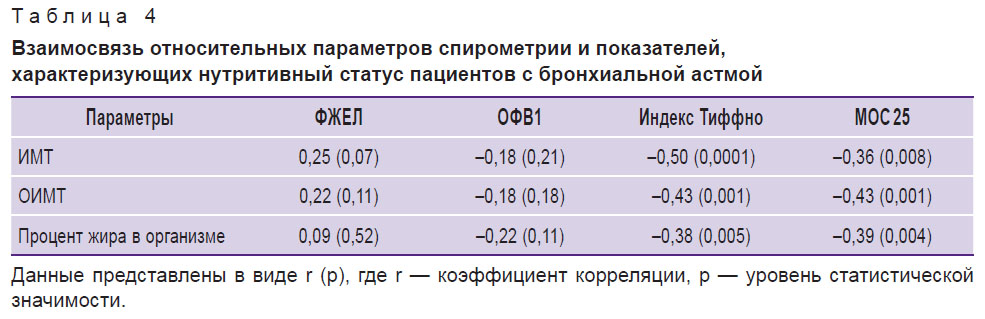
Взаимосвязь нутритивного статуса и бронхиальной проходимости у детей с бронхиальной астмой. Была проведена оценка корреляции параметров спирометрии, отражающих бронхиальную проходимость, и показателей, характеризующих нутритивный статус пациентов (табл. 4). Взаимосвязи относительных значений ФЖЕЛ и ОФВ1 с параметрами, характеризующими нутритивный статус пациентов, включая ИМТ, ОИМТ и процент содержания жира в организме, в данной выборке пациентов с БА не установлено. Однако по мере увеличения ИМТ отмечена тенденция к увеличению показателей ФЖЕЛ (%дв), p=0,07.
|
Таблица 4. Взаимосвязь относительных параметров спирометрии и показателей, характеризующих нутритивный статус пациентов с бронхиальной астмой |
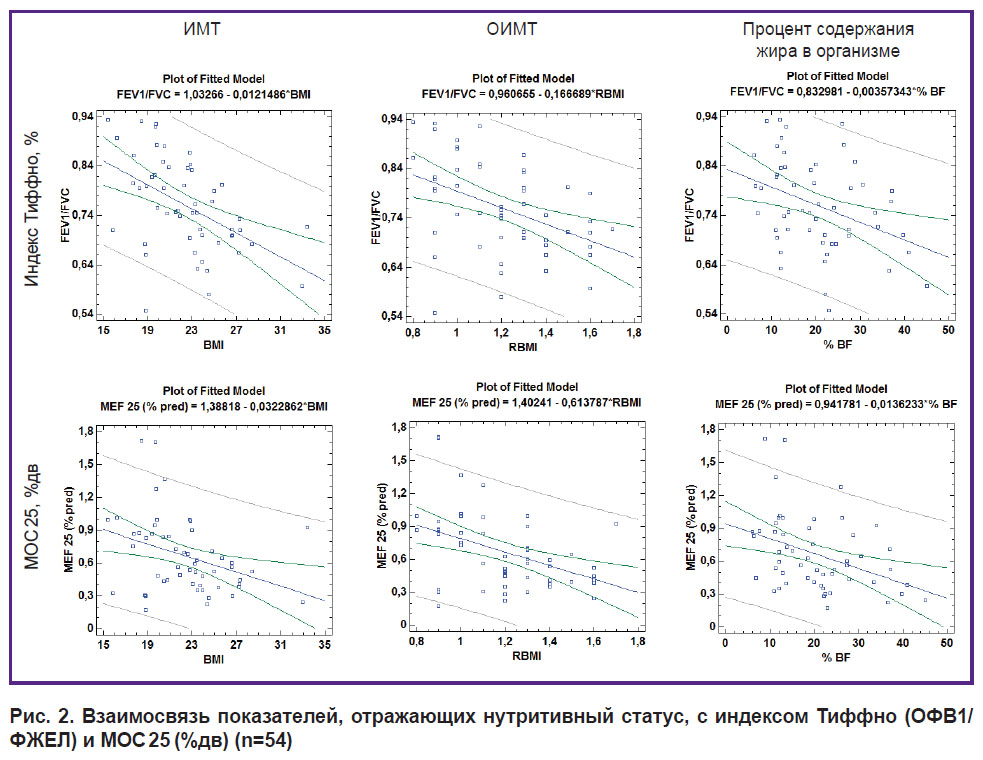
Кроме того, выявлена статистически значимая отрицательная взаимосвязь параметров, характеризующих нутритивный статус, с относительными значениями МОС 25 и с индексом ОФВ1/ФЖЕЛ (см. табл. 4, рис. 2). Учитывая, что индекс ОФВ1/ФЖЕЛ в настоящее время рассматривается в качестве основного спирометрического маркера, характеризующего бронхиальную проходимость, а МОС 25 (%дв) — в качестве косвенного маркера проходимости мелких бронхов, можно полагать, что по мере увеличения ИМТ, ОИМТ и содержания жира в организме происходит снижение бронхиальной проходимости, включая проходимость по мелким бронхам. Полученные результаты представляются нам очень важными с клинической точки зрения.
|
Рис. 2. Взаимосвязь показателей, отражающих нутритивный статус, с индексом Тиффно (ОФВ1/ФЖЕЛ) и МОС 25 (%дв) (n=54) |
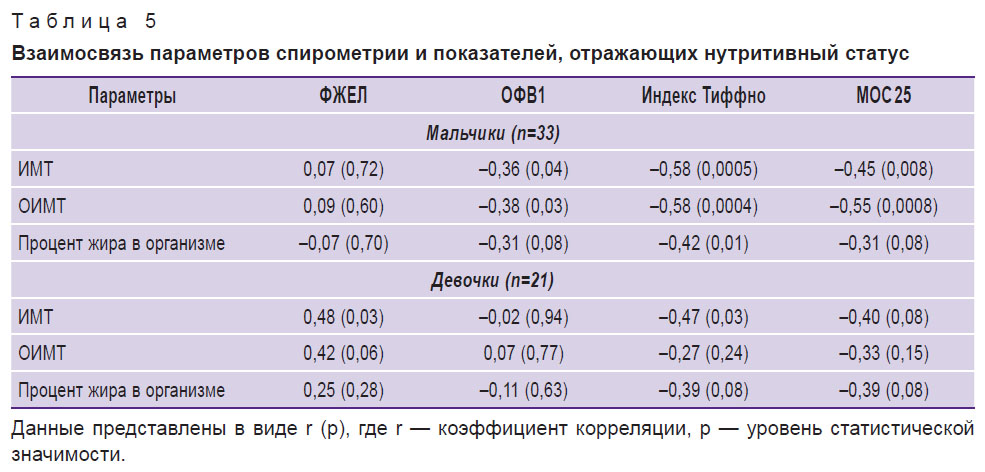
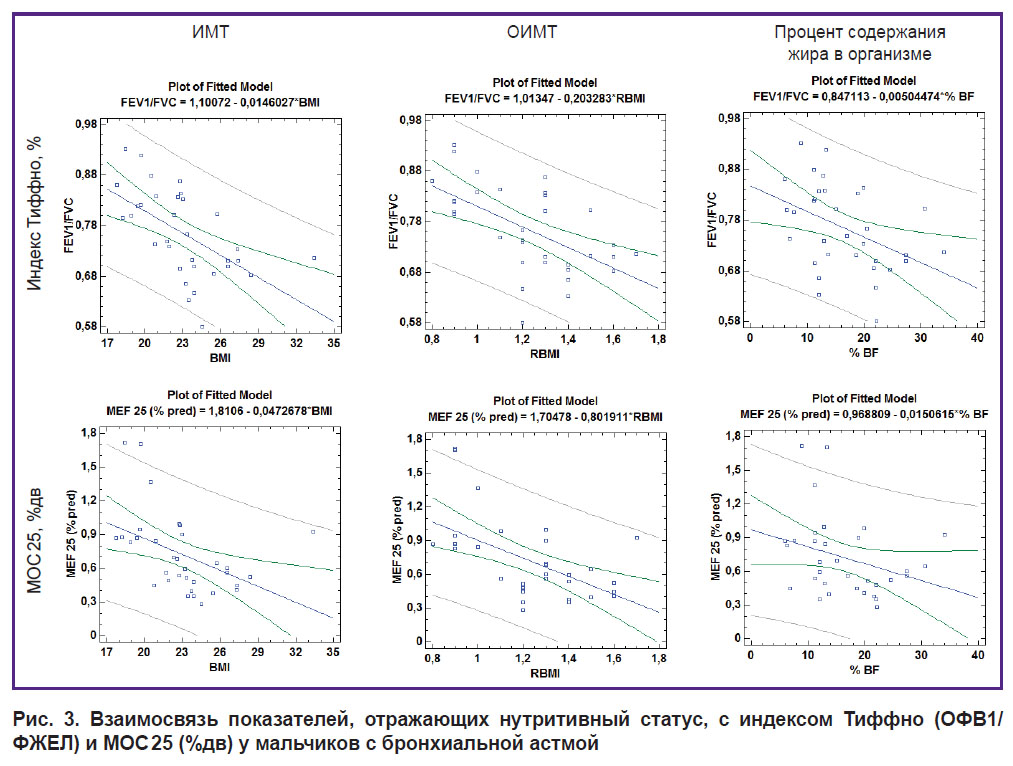
При рассмотрении взаимосвязи спирометрических параметров и нутритивного статуса детей с БА с учетом гендерных различий установлено следующее (табл. 5, рис. 3, 4). У мальчиков все показатели, характеризующие нутритивный статус, демонстрируют статистически значимую обратную корреляционную зависимость с индексом Тиффно. ИМТ и ОИМТ у мальчиков также отрицательно взаимосвязаны с МОС 25 (%дв), а ОИМТ — с ОФВ1 (%дв).
|
Таблица 5. Взаимосвязь параметров спирометрии и показателей, отражающих нутритивный статус |
|
Рис. 3. Взаимосвязь показателей, отражающих нутритивный статус, с индексом Тиффно (ОФВ1/ФЖЕЛ) и МОС 25 (%дв) у мальчиков с бронхиальной астмой |
|
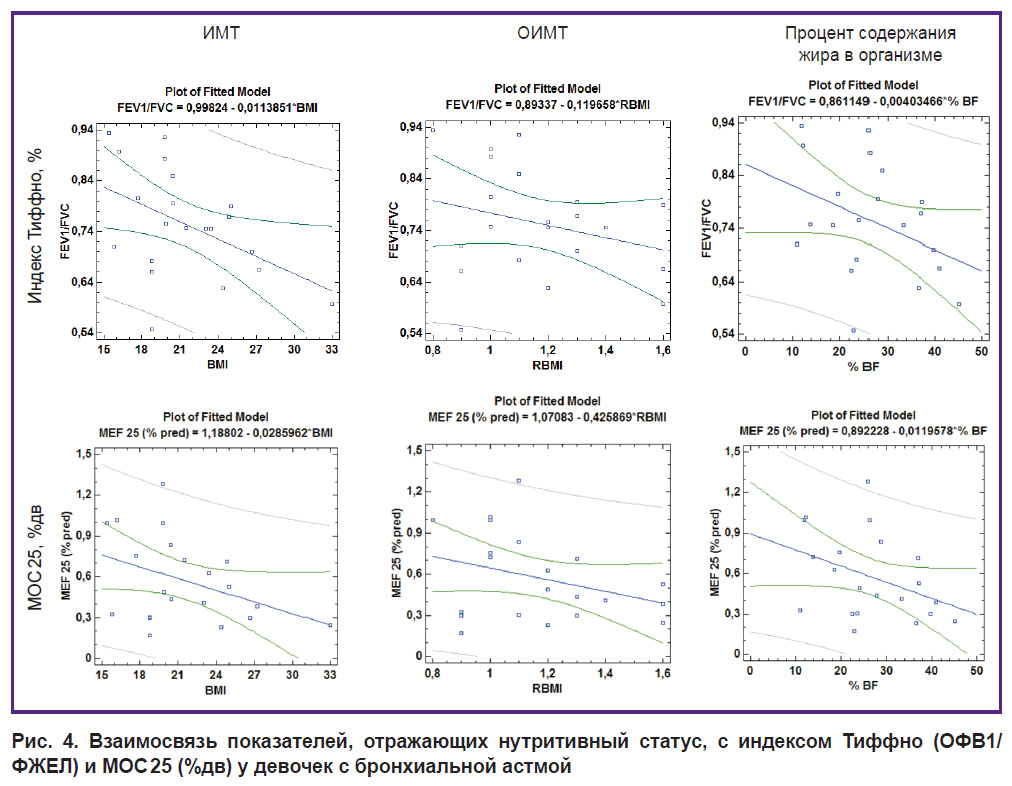
Рис. 4. Взаимосвязь показателей, отражающих нутритивный статус, с индексом Тиффно (ОФВ1/ФЖЕЛ) и МОС 25 (%дв) у девочек с бронхиальной астмой |
У девочек, в отличие от мальчиков, была выявлена прямая взаимосвязь ИМТ и ОИМТ с ФЖЕЛ (%дв). Кроме того, у них, как и у мальчиков, была установлена отрицательная корреляционная взаимосвязь ИМТ с индексом Тиффно (r=–0,47; p=0,03). Статистически значимых взаимосвязей содержания жира в организме с анализируемыми спирометрическими параметрами у девочек не выявлено, однако отмечена тенденция к наличию обратной корреляционной связи между содержанием жира в организме с индексом Тиффно (r=–0,39; p=0,08) и с МОС 25 (%дв) (r=–0,39; p=0,08) (см. рис. 4). Это совпадает с трендами, характерными как для мальчиков, так и для выборки в целом.
Обсуждение
В исследовании впервые проведено сопоставление нескольких характеристик нутритивного статуса, включая оценку ИМТ, ОИМТ и содержания жира в организме, со спирометрическими параметрами, характеризующими бронхиальную проходимость, у детей с БА.
Установлены четкие отрицательные взаимосвязи между ИМТ и индексом Тиффно — важнейшим спирометрическим индексом, характеризующим бронхиальную проходимость. Данные закономерности были характерны как для общей когорты пациентов (r=–0,50; р=0,0001), что согласуется с данными T.C. Yao с соавт. [13], G.S.J. Duncan с соавт. [41], так и отдельно для мальчиков (r=–0,58; р=0,0005) и для девочек (r=–0,47; р=0,03). Эти данные указывают на то, что увеличение ИМТ, являющееся косвенным признаком избыточной массы тела и ожирения, может рассматриваться в качестве предиктора ухудшения бронхиальной проходимости у пациентов с БА независимо от пола ребенка.
Важно отметить, что негативное влияние избыточной массы тела и ожирения на показатели бронхиальной проходимости в общей когорте пациентов в нашем исследовании продемонстрировано также и при использовании таких показателей оценки нутритивного статуса, как ОИМТ и определение содержания жира в организме. Полученные нами данные о наличии статистически значимой обратной взаимосвязи между процентным содержанием жира в организме и ОФВ1/ФЖЕЛ в общей когорте детей с БА не совсем согласуются с некоторыми литературными данными. Так, в работе R. Wang и соавт. [22] статистически значимой взаимосвязи между содержанием жира в организме и функцией легких не выявлено. Однако следует заметить, что в их исследовании анализ взаимосвязи спирометрических параметров с ИМТ и процентом жира в организме проводился в популяции в целом, не был выполнен отдельный анализ для пациентов с БА. Мы считаем, что для глубокого изучения вопроса о влиянии ожирения, в частности содержания жира в организме, на функцию легких у пациентов с астмой следует рассматривать не общую популяцию, а именно пациентов с БА. Возможно, что в условиях персистирующего аллергического воспаления в дыхательных путях у пациентов с астмой модуляция системного воспалительного ответа жировой тканью может избирательно приводить к негативной модификации бронхиальной проходимости [42], что требует дальнейшего детального исследования.
Очевидно, что могут иметь место различные патогенетические механизмы влияния ожирения на физиологию легких, включающие в том числе дисбаланс про- и противовоспалительных цитокинов. Известно, что адипокины могут принимать участие в воспалении и гиперреактивности бронхов [43], а это также может ухудшать течение БА. С другой стороны, имеются косвенные данные, свидетельствующие о возможном влиянии самой БА на изменение нутритивного статуса. Увеличение массы тела у пациентов с неконтролируемой астмой может быть обусловлено потенциальным снижением уровня физической активности. Кроме того, у больных БА описана возможность локального синтеза альфа-меланоцит-стимулирующего гормона и его предшественника — адренокортикотропного гормона (АКТГ), что также может способствовать увеличению массы тела [44]. Роль локального синтеза АКТГ и возможность развития на этом фоне гиперкортизолемии еще предстоит оценить, особенно учитывая развивающуюся на фоне ожирения резистентность к глюкокортикоидам [45]. В нашем предыдущем исследовании уже была отмечена тенденция к увеличению доли детей с избыточной массой тела по мере утяжеления течения астмы [24].
Важно отметить, что в нашей работе в общей когорте пациентов выявлена отрицательная взаимосвязь между процентным содержанием жира в организме и показателем МОС 25 (%дв), который рассматривается в качестве важной характеристики проходимости мелких бронхов [46]. Можно предположить, что увеличение вероятности обструкции мелких бронхов по мере повышения процентного содержания жира в организме следует рассматривать в качестве одной из потенциальных причин, препятствующих достижению контроля у пациентов с БА, которая ассоциирована с избыточной массой тела и ожирением.
В нашей работе не выявлено статистически значимой зависимости между нутритивным статусом пациентов и ФЖЕЛ. Однако заслуживает внимания тот факт, что в целом в исследуемой выборке прослеживается тренд к повышению ФЖЕЛ по мере увеличения ИМТ. Это несколько противоречит имеющимся данным о том, что для пациентов с ожирением характерным является снижение ФЖЕЛ, обусловленное механическими причинами вследствие ограничивающего влияния жировой прослойки на легочные объемы [47, 48], но согласуется с результатами других авторов. Так, например, R. Wang с соавт. [22] установили, что более высокий ИМТ статистически значимо связан с увеличением ФЖЕЛ у девочек. Дальнейшие исследования, в том числе анализ спирометрических показателей у детей с БА с учетом динамики массы тела и ожирения, могут помочь уточнить это противоречие. В работе F.G. Real с соавт. [49] продемонстрировано, что ФЖЕЛ может возрастать у женщин синхронно с ИМТ до ИМТ=25 (граница нормальной и избыточной массы тела у взрослых женщин), но при дальнейшем его увеличении было зафиксировано снижение ФЖЕЛ. Авторы даже делают вывод, что ИМТ, равный 24–25, является оптимальным для легочной функции [50]. Возможным объяснением кажущегося парадоксальным увеличения жизненной емкости легких по мере увеличения ИМТ может служить потенциальное увеличение скелетно-мышечной массы, также вносящей вклад в повышение ИМТ у некоторых пациентов, особенно у детей-спортсменов [51].
Следует отметить, что прямая взаимосвязь увеличения ИМТ с увеличением ФЖЕЛ отмечена в нескольких исследованиях. Так, в работе T.C. Yao и соавт. [13] показано, что увеличение ИМТ у детей статистически значимо связано с увеличением ФЖЕЛ и ОФВ1, но с уменьшением индекса Тиффно. Авторы объясняют это следствием дисанапсиса — диспропорционального роста дыхательных путей относительно паренхимы легких. При этом размер легких у детей с ожирением больше, чем у детей с нормальной массой тела, но размер дыхательных путей еще не вырос пропорционально размерам легких [52]. Было проведено еще несколько исследований, оценивающих связь ожирения с функцией легких в разных популяциях здоровых детей [53–55]. Y.Y. Han c соавт. [53] продемонстрировали, что увеличение ИМТ связано с более высоким ФЖЕЛ и ОФВ1 и более низким индексом Тиффно среди выборочной популяции детей без астмы [53]. Точно так же F. Cibella с соавт. [54] показали, что масса тела положительно коррелирует с ФЖЕЛ и ОФВ1, но отрицательно коррелирует с индексом Тиффно у школьников. Подобные результаты были зарегистрированы и у детей с астмой [23].
Данных о связи между показателями ожирения и функции легких у детей в других исследованиях либо не удалось найти, либо сообщалось о противоречивых результатах [56, 57].
Из всего вышеизложенного складывается впечатление, что избыточная масса тела и ожирение могут формировать особый фенотип внешнего дыхания как у детей с БА, так и у здоровых, заключающийся в диспропорциональном повышении ФЖЕЛ в сочетании со снижением бронхиальной проходимости, фиксируемой по уменьшению индекса Тиффно. Однако у пациентов с БА, по всей вероятности, это может усугублять нарушения бронхиальной проходимости, свойственные данному заболеванию.
Незначительные гендерные различия взаимосвязи бронхиальной проходимости и нутритивного статуса, полученные в нашей работе, могут быть объяснены как количеством исследуемых мальчиков и девочек, так и различными законами распределения у них жировой ткани. При эквивалентном ИМТ в предпубертатном периоде девочки имеют более высокое содержание жира в организме, чем мальчики. Также стоит отметить, что на результаты могут повлиять колебания в уровнях прогестерона и эстрогена во время менархе [58].
Ограничением нашего исследования является отсутствие анализа полового развития подростков и менструального цикла у девушек. В литературе имеются данные о связи более тяжелого течения астмы с ИМТ у девочек с ранним менархе [59]. F.G. Real с соавт. [49, 50] показали синергичное действие на ФЖЕЛ и ОФВ1 олигоменореи и ИМТ.
Таким образом, у детей с БА наблюдается статистически значимая отрицательная взаимосвязь спирометрических параметров, характеризующих бронхиальную проходимость, особенно индекса Тиффно, как с расчетными показателями, характеризующими нутритивный статус пациентов, включая ИМТ и ОИМТ, так и с процентным содержанием жира в организме. Поэтому мы считаем, что при ведении пациентов с БА детского возраста расчет ИМТ и определение содержания жира в организме должны рассматриваться как необходимый компонент объективного обследования.
Заключение
Избыточная масса тела и ожирение у детей с БА, оцениваемые как расчетными методами с определением ИМТ и ОИМТ, так и прямым определением содержания жира в организме, сопровождаются статистически значимым снижением бронхиальной проходимости, оцениваемой по индексу Тиффно, а также ее снижением на уровне мелких бронхов, оцениваемой по показателям МОС 25 (%дв). Фенотип детей, страдающих БА и ожирением, требует более глубокого изучения для решения практических вопросов, связанных с диагностикой, лечением и эффективным контролем этого заболевания. Увеличение ИМТ, косвенного показателя ожирения, является предиктором ухудшения бронхиальной проходимости у пациентов с БА независимо от пола ребенка.
Финансирование исследования и конфликт интересов. Исследование не финансировалось никакими источниками, и конфликты интересов, связанные с данным исследованием, отсутствуют.
Литература
- GINA. Global strategy for asthma management and prevention. 2019. URL: https://ginasthma.org.
- Eliseeva Т.I., Balabolkin I.I. Modern technologies of bronchial asthma control in children (review). Sovremennye tehnologii v medicine 2015; 7(2): 168–184, https://doi.org/10.17691/stm2015.7.2.21.
- Braido F., Brusselle G., Guastalla D., Ingrassia E., Nicolini G., Price D., Roche N., Soriano J.B., Worth H.; LIAISON Study Group. Determinants and impact of suboptimal asthma control in Europe: the international cross-sectional and longitudinal assessment on asthma control (LIAISON) study. Respir Res 2016; 17(1): 51, https://doi.org/10.1186/s12931-016-0374-z.
- Veenendaal M., Westerik J.A.M., van den Bemt L., Kocks J.W.H., Bischoff E.W., Schermer T.R. Age- and sex-specific prevalence of chronic comorbidity in adult patients with asthma: a real-life study. NPJ Prim Care Respir Med 2019; 29(1): 14, https://doi.org/10.1038/s41533-019-0127-9.
- Majellano E.C., Clark V.L., Winter N.A., Gibson P.G., McDonald V.M. Approaches to the assessment of severe asthma: barriers and strategies. J Asthma Allergy 2019; 12: 235–251, https://doi.org/10.2147/JAA.S178927.
- Bousquet J.J., Schunemann H.J., Togias A., Erhola M., Hellings P.W., Zuberbier T., Agache I., Ansotegui I.J., Anto J.M., Bachert C., Becker S., Bedolla-Barajas M., Bewick M., Bosnic-Anticevich S., Bosse I., Boulet L.P., Bourrez J.M., Brusselle G., Chavannes N., Costa E., Cruz A.A., Czarlewski W., Fokkens W.J., Fonseca J.A., Gaga M., Haahtela T., Illario M., Klimek L., Kuna P., Kvedariene V., Le L.T.T., Larenas-Linnemann D., Laune D., Lourenco O.M., Menditto E., Mullol J., Okamoto Y., Papadopoulos N., Pham-Thi N., Picard R., Pinnock H., Roche N., Roller-Wirnsberger R.E., Rolland C., Samolinski B., Sheikh A., Toppila-Salmi S., Tsiligianni I., Valiulis A., Valovirta E., Vasankari T., Ventura M.T., Walker S., Williams S., Akdis C.A., Annesi-Maesano I., Arnavielhe S., Basagana X., Bateman E., Bedbrook A., Bennoor K.S., Benveniste S., Bergmann K.C., Bialek S., Billo N., Bindslev-Jensen C., Bjermer L., Blain H., Bonini M., Bonniaud P., Bouchard J., Briedis V., Brightling C.E., Brozek J., Buhl R., Buonaiuto R., Canonica G.W., Cardona V., Carriazo A.M., Carr W., Cartier C., Casale T., Cecchi L., Cepeda Sarabia A.M., Chkhartishvili E., Chu D.K., Cingi C., Colgan E., de Sousa J.C., Courbis A.L., Custovic A., Cvetkosvki B., D’Amato G., da Silva J., Dantas C., Dokic D., Dauvilliers Y., Dedeu A., De Feo G., Devillier P., Di Capua S., Dykewickz M., Dubakiene R., Ebisawa M., El-Gamal Y., Eller E., Emuzyte R., Farrell J., Fink-Wagner A., Fiocchi A., Fontaine J.F., Gemicioglu B., Schmid-Grendelmeir P., Gamkrelidze A., Garcia-Aymerich J., Gomez M., Gonzalez Diaz S., Gotua M., Guldemond N.A., Guzman M.A., Hajjam J., O’B Hourihane J., Humbert M., Iaccarino G., Ierodiakonou D., Ivancevich J.C., Joos G., Jung K.S., Jutel M., Kaidashev I., Kalayci O., Kardas P., Keil T., Khaitov M., Khaltaev N., Kleine-Tebbe J., Kowalski M.L., Kritikos V., Kull I., Leonardini L., Lieberman P., Lipworth B., Lodrup Carlsen K.C., Loureiro C.C., Louis R., Mair A., Marien G., Mahboub B., Malva J., Manning P., de Manuel Keenoy E., Marshall G.D., Masjedi M.R., Maspero J.F., Mathieu-Dupas E., Matricardi P.M., Melen E., Melo-Gomes E., Meltzer E.O., Mercier J., Miculinic N., Mihaltan F., Milenkovic B., Moda G., Mogica-Martinez M.D., Mohammad Y., Montefort S., Monti R., Morais-Almeida M., Mosges R., Munter L., Muraro A., Murray R., Naclerio R., Napoli L., Namazova-Baranova L., Neffen H., Nekam K., Neou A., Novellino E., Nyembue D., O’Hehir R., Ohta K., Okubo K., Onorato G., Ouedraogo S., Pali-Scholl I., Palkonen S., Panzner P., Park H.S., Pepin J.L., Pereira A.M., Pfaar O., Paulino E., Phillips J., Plavec D., Popov T.A., Portejoie F., Price D., Prokopakis E.P., Pugin B., Raciborski F., Rajabian-Soderlund R., Reitsma S., Rodo X., Romano A., Rosario N., Rottem M., Ryan D., Salimaki J., Sanchez-Borges M.M., Sisul J.C., Sole D., Somekh D., Sooronbaev T., Sova M., Spranger O., Stellato C., Stelmach R., Suppli Ulrik C., Thibaudon M., To T., Todo-Bom A., Tomazic P.V., Valero A.A., Valenta R., Valentin-Rostan M., van der Kleij R., Vandenplas O., Vezzani G., Viart F., Viegi G., Wallace D., Wagenmann M., Wang Y., Waserman S., Wickman M., Williams D.M., Wong G., Wroczynski P., Yiallouros P.K., Yorgancioglu A., Yusuf O.M., Zar H.J., Zeng S., Zernotti M., Zhang L., Zhong N.S., Zidarn M.; ARIA Study Group; MASK Study Group. Next-generation ARIA care pathways for rhinitis and asthma: a model for multimorbid chronic diseases. Clin Transl Allergy 2019; 9: 44, https://doi.org/10.1186/s13601-019-0279-2.
- Eliseeva T.I., Krasilnikova S.V., Babaev S.Y., Novozhilov A.A., Ovsyannikov D.Y., Ignatov S.K., Kubysheva N.I., Shakhov A.V. Dependence of anterior active rhinomanometry indices on nasal obstructive disorders in children with atopic bronchial asthma complicated by nasal symptoms. Biomed Res Int 2018: 1869613, https://doi.org/10.1155/2018/1869613.
- Eliseeva T.I., Krasilnikova S.V., Geppe N.A., Babaev S.Y., Tush E.V., Khaletskaya O.V., Ovsyannikov D.Y., Balabolkin I.I., Ignatov S.K., Kubysheva N.I. Effect of nasal obstructive disorders on sinonasal symptoms in children with different levels of bronchial asthma control. Can Respir J 2018: 4835823, https://doi.org/10.1155/2018/4835823.
- Jiang D., Wang L., Bai C., Chen O. Association between abdominal obesity and asthma: a meta-analysis. Allergy Asthma Clin Immunol 2019; 15: 16, https://doi.org/10.1186/s13223-019-0333-6.
- GINA. The Global Asthma Report 2018. Auckland, New Zealand: Global Asthma Network; 2018. URL: http://www.globalasthmareport.org/Global %20Asthma%20Report%202018.pdf.
- World Health Organization. Obesity and overweight. 2020. URL: https://www.who.int/news-room/fact -sheets/detail/obesity-and-overweight.
- Salome C.M., King G.G., Berend N. Physiology of obesity and effects on lung function. J Appl Physiol (1985) 2010; 108(1): 206–211, https://doi.org/10.1152/japplphysiol.00694.2009.
- Yao T.C., Tsai H.J., Chang S.W., Chung R.H., Hsu J.Y., Tsai M.H., Liao S.L., Hua M.C., Lai S.H., Chen L.C., Yeh K.W., Tseng Y.L., Lin W.C., Chang S.C., Huang J.L.; Prediction of Allergies in Taiwanese Children (PATCH) Study Group. Obesity disproportionately impacts lung volumes, airflow and exhaled nitric oxide in children. PloS One 2017; 12(4): e0174691, https://doi.org/10.1371/journal.pone.0174691.
- Melo L.C., Silva M.A., Calles A.C. Obesity and lung function: a systematic review. Einstein (Sao Paulo) 2014; 12(1): 120–125, https://doi.org/10.1590/s1679-45082014rw2691.
- Pijnenburg M.W., Baraldi E., Brand P.L., Carlsen K.H., Eber E., Frischer T., Hedlin G., Kulkarni N., Lex C., Mäkelä M.J., Mantzouranis E., Moeller A., Pavord I., Piacentini G., Price D., Rottier B.L., Saglani S., Sly P.D., Szefler S.J., Tonia T., Turner S., Wooler E., Lødrup Carlsen K.C. Monitoring asthma in children. Eur Respir J 2015; 45(4): 906–925, https://doi.org/10.1183/09031936.00088814.
- Eliseeva Т.I., Knyazeva Е.V., Bochkova Y.S., Kononova S.V., Geppe N.A., Balabolkin I.I. Spirographic parameters and their change in bronchial patency variability tests in control level assessment of bronchial asthma in children. Sovremennye tehnologii v medicine 2013; 5(4): 94–101.
- Eliseeva Т.I., Knyazeva Е.V., Geppe N.A., Balabolkin I.I. The relationship of spirographic parameters and bronchial responsiveness with asthma control level in children (according to ACQ-5 and АСТ-С data). Sovremennye tehnologii v medicine 2013; 5(2): 47–52.
- Forno E., Celedón J.C. The effect of obesity, weight gain, and weight loss on asthma inception and control. Curr Opin Allergy Clin Immunol 2017; 17(2): 123–130, https://doi.org/10.1097/ACI.0000000000000339.
- Forno E., Han Y.Y., Mullen J., Celedón J.C. Overweight, obesity, and lung function in children and adults — a meta-analysis. J Allergy Clin Immunol Pract 2018; 6(2): 570–581.e10, https://doi.org/10.1016/j.jaip.2017.07.010.
- Kasteleyn M.J., Bonten T.N., de Mutsert R., Thijs W., Hiemstra P.S., le Cessie S., Rosendaal F.R., Chavannes N.H., Taube C. Pulmonary function, exhaled nitric oxide and symptoms in asthma patients with obesity: a cross-sectional study. Respir Res 2017; 18(1): 205, https://doi.org/10.1186/s12931-017-0684-9.
- Somashekar A.R., Sowmya A.N. Co-relation of body mass index with the prevalence and severity of asthma in urban children aged 7–12 years. J Pediatr Care 2016; 2: 2, https://doi.org/10.21767/2471-805X.100012.
- Wang R., Custovic A., Simpson A., Belgrave D.C., Lowe L.A., Murray C.S. Differing associations of BMI and body fat with asthma and lung function in children. Pediatr Pulmonol 2014; 49(11): 1049–1057, https://doi.org/10.1002/ppul.22927.
- Tantisira K.G., Litonjua A.A., Weiss S.T., Fuhlbrigge A.L. Association of body mass with pulmonary function in the Childhood Asthma Management Program (CAMP). Thorax 2003; 58(12): 1036–1041, https://doi.org/10.1136/thorax.58.12.1036.
- Eliseeva Т.I., Geppe N.A., Ignatov S.K., Soodaeva S.K., Tush Е.V., Khaletskaya O.V., Potemina T.E., Malakhov A.B., Kubysheva N.I., Solovyov V.D. Relative body mass index as a new tool for nutritional status assessment in children and adolescents with bronchial asthma. Sovremennye tehnologii v medicine 2017; 9(1): 135–148, https://doi.org/10.17691/stm2017.9.1.18.
- Pruszkowska-Przybylska P., Sitek A., Rosset I., Żądzińska E., Sobalska-Kwapis M., Słomka M., Strapagiel D. The association between socioeconomic status, duration of breastfeeding, parental age and birth parameters with BMI, body fat and muscle mass among prepubertal children in Poland. Anthropol Anz 2019; 76(5): 409–419, https://doi.org/10.1127/anthranz/2019/0955.
- Lele R.D. Fat and muscle component of body mass index (BMI): relation with hyperinsulinemia. J Assoc Physicians India 2007; 55: 203–210.
- Sutherland T.J., McLachlan C.R., Sears M.R., Poulton R., Hancox R.J. The relationship between body fat and respiratory function in young adults. Eur Respir J 2016; 48(3): 734–747, https://doi.org/10.1183/13993003.02216-2015.
- Kamal R., Kesavachandran C.N., Bihari V., Sathian B., Srivastava A.K. Alterations in lung functions based on BMI and body fat % among obese indian population at national capital region. Nepal J Epidemiol 2015; 5(2): 470–479, https://doi.org/10.3126/nje.v5i2.12829.
- Alaagib N., Sukkar M.Y. Effect of body composition on ventilation parameters in a group of young Sudanese females. Sudan Journal of Medical Sciences 2017; 12: 78, https://doi.org/10.18502/sjms.v12i2.918.
- McLachlan C.R., Poulton R., Car G., Cowan J., Filsell S., Greene J.M., Taylor D.R., Welch D., Williamson A., Sears M.R., Hancox R.J. Adiposity, asthma, and airway inflammation. J Allergy Clin Immunol 2007; 119(3): 634–639, https://doi.org/10.1016/j.jaci.2006.10.029.
- Myung J., Lee H., Kim T.H., Han E. Relationships between self-reported asthma and pulmonary function and various measures of obesity. J Asthma 2018; 55(7): 741–749, https://doi.org/10.1080/02770903.2017.1362701.
- Kongkiattikul L., Sritippayawan S., Chomtho S., Deerojanawong J., Prapphal N. Relationship between obesity indices and pulmonary function parameters in obese thai children and adolescents. Indian J Pediatr 2015; 82(12): 1112–1116, https://doi.org/10.1007/s12098-015-1777-4.
- Mukherjee S., Mukhopadhyay D.K. Association between body mass index (BMI), body fat percentage and pulmonary functions in obese, overweight and normal weight adolescents. Journal of Evolution of Medical and Dental Sciences 2018; 7(44): 5589–5593, https://doi.org/10.14260/jemds/2018/1068.
- GINA. Global strategy for asthma management and prevention. Global Initiative for Asthma (GINA); 2016.
- Овсянников Д.Ю., Кузьменко Л.Г., Назарова Т.И., Халед М., Фролов П.А., Нгуен Б.В., Илларионова Т.Ю., Семятов С.М., Елисеева Т.И. Клинические и лабораторные маркеры бактериальной инфекции у детей разного возраста. Педиатрия 2019; 98(1): 186–192, https://doi.org/10.24110/0031-403X-2019-98-1-186-192.
- Нилова М.Ю., Туш Е.В., Елисеева Т.И., Красильникова C.В., Халецкая О.В., Попов К.С., Новикова Н.А. Структура сенсибилизации к аэроаллергенам у детей с атопической бронхиальной астмой. Аллергология и иммунология в педиатрии 2019; 2: 17–23.
- Natale V., Rajagopalan A. Worldwide variation in human growth and the World Health Organization growth standards: a systematic review. BMJ Open 2014; 4(1): e003735, https://doi.org/10.1136/bmjopen-2013-003735.
- Juniper E.F., Bousquet J., Abetz L., Bateman E.D.; GOAL Committee. Identifying ‘well-controlled’ and ‘not well-controlled’ asthma using the asthma control questionnaire. Respir Med 2006; 100(4): 616–621, https://doi.org/10.1016/j.rmed.2005.08.012.
- Miller M.R., Hankinson J., Brusasco V., Burgos F., Casaburi R., Coates A., Crapo R., Enright P., van der Grinten C.P., Gustafsson P., Jensen R., Johnson D.C., MacIntyre N., McKay R., Navajas D., Pedersen O.F., Pellegrino R., Viegi G., Wanger J.; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J 2005; 26(2): 319–338, https://doi.org/10.1183/09031936.05.00034805.
- Wells J.C. Sexual dimorphism of body composition. Best Pract Res Clin Endocrinol Metab 2007; 21(3): 415–430, https://doi.org/10.1016/j.beem.2007.04.007.
- Duncan G.S.J., Gharbawi N.T., Viskaduraki M., Gaillard E.A., Beardsmore C.S. P90. How does BMI status influence spirometry and respiratory muscle strength in children? Thorax 2017; 72(Suppl 3): A132, https://doi.org/10.1136/thoraxjnl-2017-210983.232.
- Cvejoska-Cholakovska V., Kocova M., Velikj-Stefanovska V., Vlashki E. The association between asthma and obesity in children — inflammatory and mechanical factors. Open Access Maced J Med Sci 2019; 7(8): 1314–1319, https://doi.org/10.3889/oamjms.2019.310.
- Sood A., Shore S.A. Adiponectin, leptin, and resistin in asthma: basic mechanisms through population studies. J Allergy (Cairo) 2013; 2013: 785835, https://doi.org/10.1155/2013/785835.
- Webering S., Lunding L.P., Vock C., Schroder A., Gaede K.I., Herzmann C., Fehrenbach H., Wegmann M. The alpha-melanocyte-stimulating hormone acts as a local immune homeostasis factor in experimental allergic asthma. Clin Exp Allergy 2019; 49(7): 1026–1039, https://doi.org/10.1111/cea.13400.
- Sutherland E.R., Goleva E., Strand M., Beuther D.A., Leung D.Y. Body mass and glucocorticoid response in asthma. Am J Respir Crit Care Med 2008; 178(7): 682–687, https://doi.org/10.1164/rccm.200801-076OC.
- Xiong X.F., Fan L.L., Wu H.X., Zhu M., Cheng D.Y. Effects of tiotropium combined with theophylline on stable COPD patients of group B, D and its impact on small airway function: a randomized controlled trial. Adv Ther 2018; 35(12): 2201–2213, https://doi.org/10.1007/s12325-018-0831-9.
- Sin D.D., Man S.F. Impaired lung function and serum leptin in men and women with normal body weight: a population based study. Thorax 2003; 58(8): 695–698, https://doi.org/10.1136/thorax.58.8.695.
- Jones R.L., Nzekwu M.M. The effects of body mass index on lung volumes. Chest 2006; 130(3): 827–833, https://doi.org/10.1378/chest.130.3.827.
- Real F.G., Svanes C., Omenaas E.R., Anto J.M., Plana E., Janson C., Jarvis D., Zemp E., Wjst M., Leynaert B., Sunyer J. Menstrual irregularity and asthma and lung function. J Allergy Clin Immunol 2007; 120(3): 557–64, https://doi.org/10.1016/j.jaci.2007.04.041.
- Real F.G., Svanes C., Macsali F., Omenaas E.R. Hormonal factors and respiratory health in women — a review. Clin Respir J 2008; 2(Suppl 1): 111–119, https://doi.org/10.1111/j.1752-699X.2008.00093.x.
- Jensen M.E., Wood L.G., Gibson P.G. Obesity and childhood asthma — mechanisms and manifestations. Curr Opin Allergy Clin Immunol 2012; 12(2): 186–192, https://doi.org/10.1097/ACI.0b013e3283508df5.
- Forno E., Weiner D.J., Mullen J., Sawicki G., Kurland G., Han Y.Y., Cloutier M.M., Canino G., Weiss S.T., Litonjua A.A., Celedón J.C. Obesity and airway dysanapsis in children with and without asthma. Am J Respir Crit Care Med 2017; 195(3): 314–323, https://doi.org/10.1164/rccm.201605-1039OC.
- Han Y.Y., Forno E., Celedon J.C. Adiposity, fractional exhaled nitric oxide, and asthma in U.S. children. Am J Respir Crit Care Med 2014; 190(1): 32–39, https://doi.org/10.1164/rccm.201403-0565OC.
- Cibella F., Bruno A., Cuttitta G., Bucchieri S., Melis M.R., De Cantis S., La Grutta S., Viegi G. An elevated body mass index increases lung volume but reduces airflow in Italian schoolchildren. PloS One 2015; 10(5): e0127154, https://doi.org/10.1371/journal.pone.0127154.
- Spathopoulos D., Paraskakis E., Trypsianis G., Tsalkidis A., Arvanitidou V., Emporiadou M., Bouros D., Chatzimichael A. The effect of obesity on pulmonary lung function of school aged children in Greece. Pediatr Pulmonol 2009; 44(3): 273–280, https://doi.org/10.1002/ppul.20995.
- Bekkers M.B., Wijga A.H., de Jongste J.C., Kerkhof M., Postma D., Gehring U., Smit H.A., Brunekreef B. Waist circumference, BMI, and lung function in 8-year-old children: the PIAMA birth cohort study. Pediatr Pulmonol 2013; 48(7): 674–82, https://doi.org/10.1002/ppul.22722.
- Davidson W.J., Mackenzie-Rife K.A., Witmans M.B., Montgomery M.D., Ball G.D., Egbogah S., Eves N.D. Obesity negatively impacts lung function in children and adolescents. Pediatr Pulmonol 2014; 49(10): 1003–1010, https://doi.org/10.1002/ppul.22915.
- Forbes L. Do exogenous oestrogens and progesterone influence asthma? Thorax 1999; 54(3): 265–267, https://doi.org/10.1136/thx.54.3.265.
- Varraso R., Siroux V., Maccario J., Pin I., Kauffmann F.; Epidemiological Study on the Genetics and Environment of Asthma. Asthma severity is associated with body mass index and early menarche in women. Am J Respir Crit Care Med 2005; 171(4): 334–339, https://doi.org/10.1164/rccm.200405-674OC.










