Лабораторные маркеры патологии эритропоэза в ранней диагностике периоперационных анемий
Цель исследования — оценить диагностическую значимость показателей, отражающих содержание гемоглобина в ретикулоцитах, для раннего выявления склонности к развитию периоперационных анемий при нормальных значениях общего гемоглобина крови.
Материалы и методы. Выполнено наблюдательное ретроспективное одноцентровое сплошное поперечное исследование потребности в проведении трансфузии эритроцитосодержащих компонентов (ЭСК) в зависимости от значений гемоглобина ретикулоцитов (Ret-He) и дельты гемоглобина (Delta-He) на фоне неизмененных (в границах референсных интервалов) значений общего гемоглобина. Группы сравнения были сформированы с использованием графического диагностического алгоритма Hema-Plot, согласно которому при анемиях разной природы для значений Ret-He и Delta-He характерны отклонения от референсных интервалов в большую или меньшую сторону.
Результаты. Среди пациентов, формально не подпадающих под критерии анемии ВОЗ на момент госпитализации, в 26% случаев наблюдались отклонения от референсных интервалов значений Ret-He и Delta-He. Показания к трансфузионной терапии ЭСК с большей вероятностью возникали у пациентов, изменения Ret-He и Delta-He которых согласно алгоритму Hema-Plot соответствовали признакам анемий разного генеза.
Заключение. Значения Ret-He и Delta-He при физиологических нормах общего гемоглобина позволяют сориентироваться относительно потребности пациентов в трансфузионной терапии ЭКС в послеоперационном периоде.
Различия между группами, сформированными на основании отклонений Ret-He и Delta-He от референсных значений, «перекликаются» с диагностическими признаками анемий разной природы, позволяют обсуждать варианты расстройств эритропоэза на самых ранних этапах их формирования и риск развития анемии при формально неизмененном уровне общего гемоглобина.
Введение
Необходимость преодоления периоперационных анемий для хирургического стационара, несмотря на многолетнюю историю вопроса, продолжает оставаться актуальной проблемой. Анемии, не скорректированные к моменту оперативного вмешательства, сопряжены с развитием осложнений как в ходе самой операции, так и в ходе послеоперационного лечения с повышенным риском интра- и послеоперационной летальности [1–6].
Трансфузия эритроцитсодержащих компонентов крови (ЭСК), необходимая в ряде случаев как жизнеспасающая тактика, влечет за собой, однако, дополнительные риски [1–4, 6]. Единственной одновременно эффективной и безопасной стратегией в отношении анемий международная клиническая практика признает их диагностику и лечение на дооперационном (желательно — на догоспитальном) этапе [2–5, 7, 8].
Анемии у пациентов, нуждающихся в хирургическом лечении, — не только источник грозных осложнений, но и достаточно распространенное явление [4, 5, 9, 10]. Это вполне объяснимо: патогенетические механизмы хирургических заболеваний и анемий часто пересекаются, у онкологических пациентов они усугубляются спецификой неопластического и паранеопластических процессов, а также рядом терапевтических факторов [4, 5, 10–12]. При этом природа анемий в комплексе патологических процессов далеко не всегда очевидна, железодефицитные состояния среди них — частая, но далеко не единственная причина [4, 6, 10, 13]. Дифференциальная диагностика анемий совершенствуется на протяжении десятилетий, однако патогенетический фон воспаления и/или неопластических процессов накладывает определенные ограничения на интерпретацию лабораторных данных, снижает их специфичность и затрудняет процедуру постановки окончательного диагноза [6, 14–16], при этом основное заболевание часто может требовать быстрого хирургического вмешательства.
Таким образом, с целью коррекции анемии у пациентов хирургического стационара на дооперационном этапе сохраняет актуальность создание алгоритма обследования, позволяющего максимально быстро и просто не только диагностировать анемию, но и установить или по крайней мере предположить ее причину. С этой точки зрения обращает на себя внимание графический диагностический алгоритм Hema-Plot, позволяющий сориентироваться в происхождении анемии на основании одного лишь гематологического анализа, без привлечения дополнительных лабораторных исследований [15]. Согласно этому алгоритму, дифференциальная диагностика строится на сопоставлении содержания гемоглобина в ретикулоцитах (Ret-He) и расчетного показателя Delta-He. Последний представляет собой разницу между Ret-He и содержанием гемоглобина в эритроцитах и характеризует таким образом эффективность включения гемоглобина в клетки эритроидного ряда на момент наблюдения. Результаты исследования, выполненного нами ранее [17], позволили предположить, что использование этого алгоритма оправдано не только для оценки природы уже установленной анемии [18], но и в тех случаях, когда концентрация гемоглобина еще остается в пределах референсных интервалов. Ранее в литературе уже высказывалось предположение, что формальное соблюдение критериев первичной диагностики анемии (120 г/л для женщин и 130 г/л для мужчин) не гарантирует клинического благополучия [4].
Цель исследования — оценить возможности использования упомянутого алгоритма для выявления пациентов со склонностью к развитию периоперационной анемии среди тех, у кого традиционный скрининг не позволяет заподозрить патологию.
Материалы и методы
Ретроспективно рассматривались истории болезни пациентов, прошедших хирургическое лечение в Национальном медицинском исследовательском центре нейрохирургии имени академика Н.Н. Бурденко Минздрава РФ. В исследование включены 8216 пациентов (3680 мужчин и 4536 женщин) нейрохирургического профиля разных нозологий: новообразования головного мозга (глиомы, менингиомы, невриномы, метастатические поражения); травматические повреждения головного и спинного мозга; стенозы позвоночного канала и аномалии сосудов головного мозга. Критериями включения служили необходимость в проведении планового хирургического вмешательства и отсутствие анемии по критериям ВОЗ на момент госпитализации (значения общего гемоглобина для женщин — выше 120 г/л, для мужчин — 130 г/л) [4, 18]. Критериями исключения являлись тяжелые сопутствующие заболевания в стадии декомпенсации; хронические инфекционные процессы в стадии обострения; онкологические заболевания, не связанные с поражением ЦНС; гемоглобинопатии.
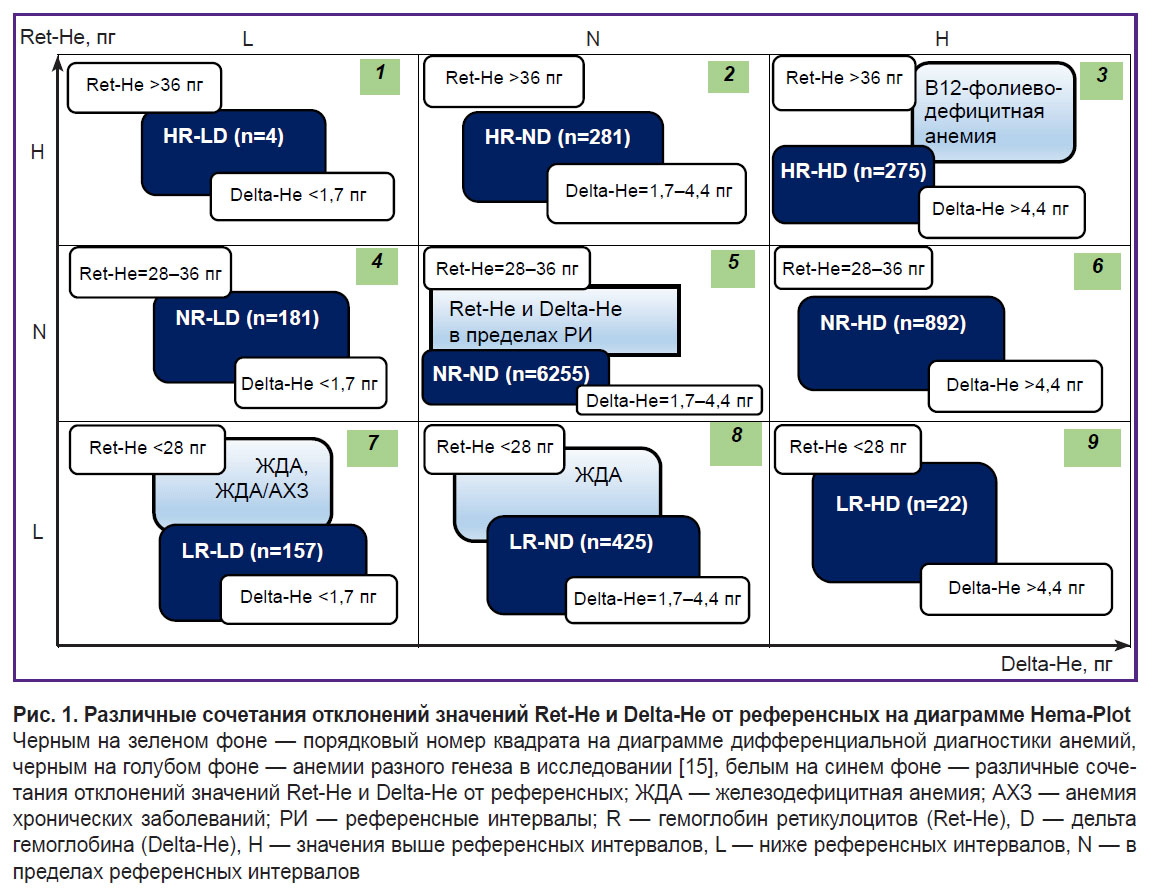
На основании результатов общего анализа крови на момент госпитализации все обследованные пациенты были разделены на 9 групп в зависимости от значений Ret-He и Delta-He (рис. 1) [15, 17]. Согласно алгоритму Hema-Plot, оси абсцисс и ординат соответствуют этим значениям. Каждая ось включает интервалы низких, средних (в пределах референсного диапазона) и высоких значений, область диаграммы таким образом оказывается разделенной на 9 квадратов, в результате чего, согласно исследованию A. Weimann с соавт. [15], анемии разного происхождения также «располагаются» в разных квадратах. В наименовании групп были приняты следующие обозначения: R — гемоглобин ретикулоцитов (Ret-He), D — Delta-He, Н — значения выше референсных интервалов, L — ниже референсных интервалов, N — в пределах референсных интервалов. Соответственно группы с относительно высоким Ret-He обозначались как HR, c относительно низким — как LR, NR — в пределах референсных значений. Аналогично для Delta-He: HD — высокие значения, LD — низкие значения, ND — в пределах референсных интервалов, которые для этих показателей составляли: Ret-He — 28–36 пг, Delta-He — 1,7–4,4 пг.
Затем сравнивали количество трансфузий ЭСК крови, выполненных в интра- и послеоперационном периоде в каждой из сформированных таким образом групп.
Общий анализ крови выполняли на гематологическом анализаторе Sysmex-XN-1000 (Sysmex, Япония) с оптическим определением Ret-He и расчетом Delta-He. Проанализированы результаты общих анализов крови, взятых на момент госпитализации, до выполнения любых диагностических и лечебных мероприятий
Статистическая обработка данных выполнена с помощью языка статистического программирования R (v. 4.2.1) в интегрированной среде разработки RStudio Server (v. 1.3.1093). Соответствие выборки нормальному распределению определяли с помощью теста Шапиро–Уилка. Тестирование статистических гипотез о различии в распределении количественных переменных проводили с помощью метода Манна–Уитни. Результаты представлены в виде диаграмм размаха, нулевую гипотезу в статистических тестах отклоняли при уровне значимости p<0,05.
Результаты
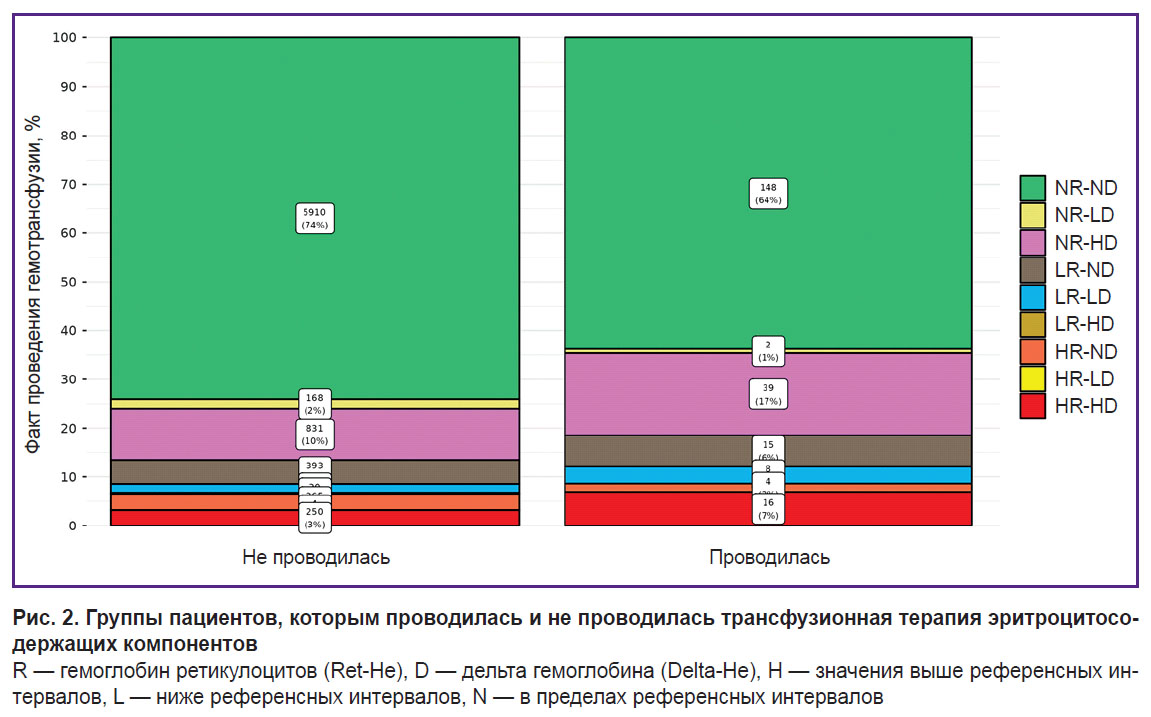
Среди 8216 пациентов, включенных в исследование, по данным общего анализа крови, значения концентрации гемоглобина составили не ниже 120 г/л для женщин и 130 г/л для мужчин. Трансфузия ЭСК в ходе лечения в стационаре потребовалась 232 пациентам и не потребовалась в 7984 случаях. Результаты Ret-He и Delta-He в пределах соответствующих референсных интервалов оказались у 6058 из 8216 пациентов (74%), и в 2158 случаях (26%) наблюдались их отклонения в большую или меньшую сторону по одному или по обоим показателям.
При этом среди тех, кому проводилась трансфузия ЭСК (рис. 2), пациенты, у которых значения Ret-He и Delta-He находились в пределах референсных интервалов (квадрат NR-ND алгоритма Hema-Plot, см. рис. 1), составили 64%. Среди пациентов, которым трансфузия ЭСК не потребовалась, значения в референсных пределах (NR-ND) наблюдались у 74%.
Среди пациентов, у которых значения Ret-He либо Delta-He или обоих показателей отличались от референсных, доля тех, кому потребовалась трансфузия ЭСК, составила 36%, а доля тех, кому не потребовалась трансфузия ЭСК, — 26%.
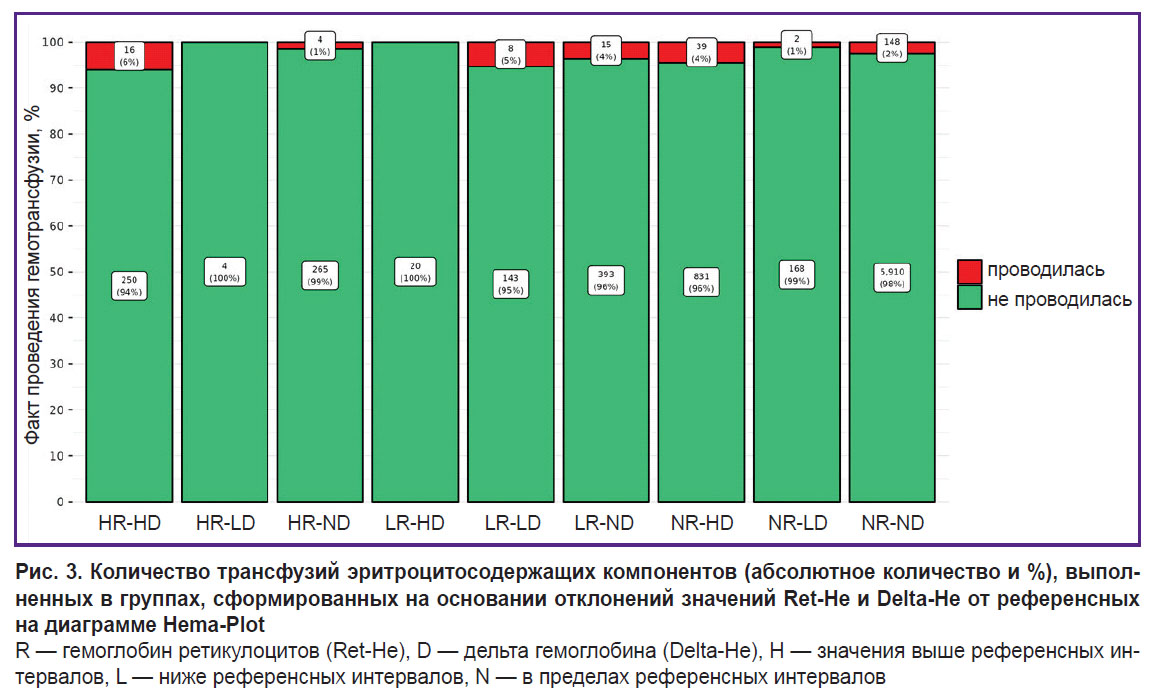
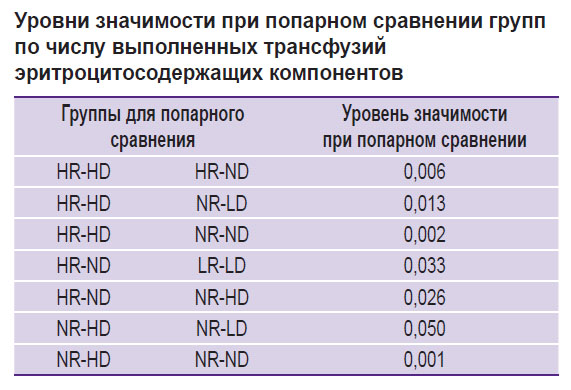
Сравнение групп, сформированных на основании отклонений значений Ret-He и Delta-He от референсных, по количеству выполненных трансфузий представлено на рис. 3. Максимальное (в процентном отношении) число трансфузий ЭСК (6%) приходится на группу HR-HD (квадрат 3 алгоритма Hema-Plot), что статистически значимо в ходе сравнения с группой NR-ND при p=0,002 (см. рис. 3, таблицу). В группе LR-LD (квадрат 8) необходимость в проведении трансфузий составила 5%, в группах NR-HD и LR-ND (квадраты 7 и 9) — по 4%. В группе NR-ND (квадрат 6, все показатели — в пределах референсных интервалов) частота трансфузий составила 2% (статистически значимо при сравнении с группами HR-HD и NR-HD). Минимальное число трансфузий (1%) насчитывалось в группе HR-ND (квадрат 2). Две группы, в которых трансфузий ЭСК не зарегистрировано, по количеству пациентов оказались нерелевантными: HR-LD и LR-HD (соответственно 4 и 20 пациентов из 8216).
|
Уровни значимости при попарном сравнении групп по числу выполненных трансфузий эритроцитосодержащих компонентов |
Обсуждение
Результаты проведенного исследования показывают, что среди пациентов, имеющих на момент госпитализации, по данным общего анализа крови, уровень гемоглобина в пределах референсного интервала и формально не подпадающих под критерии анемии ВОЗ, в четверти случаев (26%) наблюдаются отклонения от референсных значений показателей Ret-He и Delta-He (см. рис. 1). При этом выясняется, что за время госпитализации показания к трансфузионной терапии ЭСК у таких пациентов возникали с большей вероятностью (суммарно 36%) по сравнению с пациентами, у которых эти показатели оказывались в пределах референсного диапазона (суммарно 26%).
Различия между 9 группами, сформированными на основании алгоритма Hema-Plot [15], количественно невелики и не всегда статистически значимы (см. таблицу), однако логичны: большее число трансфузий ЭСК потребовалось в группах, в которых, согласно алгоритму, встречаются анемии разной природы. Так, максимальное число трансфузий (6%) насчитывается в группе HR-HD (квадрат 3); согласно алгоритму, он соответствует В12-фолиеводефицитным анемиям (В12А). 5% трансфузий ЭСК насчитывается в группе LR-LD (квадрат 7), в которую, согласно алгоритму, включаются анемии хронических воспалительных заболеваний (АХЗ) и их сочетания с железодефицитными анемиями (ЖДА). В группе LR-ND (квадрат 8, согласно алгоритму — ЖДА без АХЗ) вероятность трансфузий в нашем исследовании составляет 4%. Для сравнения: среди пациентов, у которых Ret-He и Delta-He находились в пределах референсных значений (отсутствие анемии), частота трансфузий ЭСК составила 2% (статистически значимо при сравнении с группой HR-ND).
Таким образом, есть основания предположить, что отклонения от референсных интервалов значений Ret-He и Delta-He могут быть самыми ранними признаками расстройств эритропоэза и указывать на близость развития анемии еще при неизмененном уровне гемоглобина. В таком случае мы можем считать, что при традиционном скрининге общего анализа крови (на основании концентрации гемоглобина) 5,2% от общего числа прооперированных пациентов госпитализировались со склонностью к развитию ЖДА (группа LR-ND) и 3,3% — со склонностью к развитию В12А (группа HR-HD). Это предположение должно быть проверено с использованием традиционных биохимических маркеров анемий.
Согласно логике алгоритма Hema-Plot, группа LR-LD (квадрат 7) должна представлять пациентов, склонных к развитию АХЗ. При этом воспалительный процесс подразумевается при онкологических и ряде других заболеваний, требующих хирургического лечения [19–21]. Поэтому, возможно, именно в группе LR-LD воспаление вносит существенный вклад в развитие патологического процесса и в большей мере способно повлиять на системный статус железа. Представляется целесообразным в дальнейшем более детально проанализировать нозологический состав и особенности течения заболеваний в сформированных группах. Необходимость в трансфузии ЭСК для группы LR-LD в нашем исследовании относительно велика — 5%.
Среди проанализированных нами данных обращают на себя внимание отклонения в значениях Ret-He и Delta-He, которые в исследовании A. Weimann с соавт. [15] не представлены: НR-ND, NR-HD и NR-LD (квадраты 2, 4 и 6). В вышеупомянутом исследовании эти квадраты остаются незаполненными. В нашем случае таких пациентов насчитывается значительное количество: HR-ND — 3,4%, NR-LD — 2,2% и NR-HD — 10,9% от общего числа пациентов. Особенно интересна последняя группа (квадрат 6) — наиболее многочисленная после группы NR-ND (Ret-He и Delta-He в пределах референсных значений). Смещение Delta-He в сторону высоких значений на фоне Ret-He в пределах референсного интервала может свидетельствовать об ускоренном разрушении эритроцитов. Это предположение «перекликается» с относительно высокой потребностью в трансфузиях ЭСК в этой группе (4%) так же, как в группе с предполагаемой склонностью к ЖДА (LR-ND, квадрат 8). Группы НR-ND и NR-HD отличаются относительно малой потребностью в проведении трансфузий ЭСК — по 1%, что даже меньше, чем в группе NR-ND. Возможно, их объединяет тенденция к большему содержанию гемоглобина в ретикулоцитах по сравнению с эритроцитами, что можно интерпретировать как компенсацию гипоксии, сопряженной с основной патологией. Все эти предположения, безусловно, требуют отдельной проверки.
Таким образом, применительно к пациентам, для которых запланировано оперативное вмешательство, отклонения в значениях Ret-He и Delta-He могут иметь самостоятельное диагностическое значение, позволяя сориентироваться в отношении необходимости трансфузии ЭСК. Для пациентов, не имеющих (согласно традиционным критериям) патологии эритропоэза, эти отклонения могут указывать на большую вероятность развития периоперационных анемий.
Заключение
Среди пациентов нейрохирургического стационара, у которых уровень гемоглобина, по данным общего анализа крови, находится в пределах референсного интервала и которые не подпадают под критерии анемии ВОЗ, в 26% случаев наблюдаются отклонения от референсных значений показателей, отражающих содержание гемоглобина в ретикулоцитах, — Ret-He и Delta-He.
Показания к трансфузионной терапии эритроцитосодержащих компонентов с большей вероятностью возникают у пациентов, изменения Ret-He и Delta-He которых соответствуют диагностическим признакам анемий разного генеза в соответствии с графическим алгоритмом Hema-Plot.
Результаты исследования позволяют поставить вопрос о необходимости раннего выявления склонности к развитию периоперационных анемий у пациентов, у которых традиционный скрининг не позволяет заподозрить патологию, а также о возможности определения природы анемии на основании изменения показателей Ret-He и Delta-He без привлечения других лабораторных тестов.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Goodnough L.T., Maniatis A., Earnshaw P., Benoni G., Beris P., Bisbe E., Fergusson D.A., Gombotz H., Habler O., Monk T.G., Ozier Y., Slappendel R., Szpalski M. Detection, evaluation, and management of preoperative anaemia in the elective orthopaedic surgical patient: NATA guidelines. Br J Anaesth 2011; 106(1): 13–22, https://doi.org/10.1093/bja/aeq361.
- Desai N., Schofield N., Richards T. Perioperative patient blood management to improve outcomes. Anesth Analg 2018; 127(5): 1211–1220, https://doi.org/10.1213/ANE.0000000000002549.
- Mosieri C., Chandler D., Reed D.S., Craig M.K., Hyatali F., Kallurkar A., Cornett E.M., Urman R.D., Kaye A.D. Managing preoperative anemia: evolving concepts and strategies for improving patient outcomes. Best Pract Res Clin Anaesthesiol 2020; 34(2): 183–197, https://doi.org/10.1016/j.bpa.2020.04.005.
- Warner M.A., Shore-Lesserson L., Shander A., Patel S.Y., Perelman S.I., Guinn N.R. Perioperative anemia: prevention, diagnosis, and management throughout the spectrum of perioperative care. Anesth Analg 2020; 130(5): 1364–1380, https://doi.org/10.1213/ANE.0000000000004727.
- Hofmann A., Aapro M., Fedorova T.A., Zhiburt Y.B., Snegovoy A.V., Kaganov O.I., Ognerubov N.A., Lyadov V.K., Moiseenko V.M., Trofimova O.P., Ashrafyan L.A., Khasanov R.S., Poddubnaya I.V. Patient blood management in oncology in the Russian Federation: resolution to improve oncology care. J Cancer Policy 2022; 31: 100315, https://doi.org/10.1016/j.jcpo.2021.100315.
- Hoenemann C., Ostendorf N., Zarbock A., Doll D., Hagemann O., Zimmermann M., Luedi M. Reticulocyte and erythrocyte hemoglobin parameters for iron deficiency and anemia diagnostics in patient blood management. A narrative review. J Clin Med 2021; 10(18): 4250, https://doi.org/10.3390/jcm10184250.
- Leahy M.F., Hofmann A., Towler S., Trentino K.M., Burrows S.A., Swain S.G., Hamdorf J., Gallagher T., Koay A., Geelhoed G.C., Farmer S.L. Improved outcomes and reduced costs associated with a health-system-wide patient blood management program: a retrospective observational study in four major adult tertiary-care hospitals. Transfusion 2017; 57(6): 1347–1358, https://doi.org/10.1111/trf.14006.
- Althoff F.C., Neb H., Herrmann E., Trentino K.M., Vernich L., Füllenbach C., Freedman J., Waters J.H., Farmer S., Leahy M.F., Zacharowski K., Meybohm P., Choorapoikayil S. Multimodal patient blood management program based on a three-pillar strategy: a systematic review and meta-analysis. Ann Surg 2019; 269(5): 794–804, https://doi.org/10.1097/SLA.0000000000003095.
- Shander A., Knight K., Thurer R., Adamson J., Spence R. Prevalence and outcomes of anemia in surgery: a systematic review of the literature. Am J Med 2004; 116(Suppl 7A): 58S–69S, https://doi.org/10.1016/j.amjmed.2003.12.013.
- Aapro M., Beguin Y., Bokemeyer C., Dicato M., Gascón P., Glaspy J., Hofmann A., Link H., Littlewood T., Ludwig H., Österborg A., Pronzato P., Santini V., Schrijvers D., Stauder R., Jordan K., Herrstedt J.; ESMO Guidelines Committee Management of anaemia and iron deficiency in patients with cancer: ESMO Clinical Practice Guidelines. Ann Oncol 2018; 29(Suppl 4): iv96–iv110, https://doi.org/10.1093/annonc/mdx758.
- Dharmajaya R., Sari D.K. Role and value of inflammatory markers in brain tumors: a case controlled study. Ann Med Surg (Lond) 2021; 63: 102107, https://doi.org/10.1016/j.amsu.2021.01.055.
- Воробьев П.А. Анемический синдром в клинической практике. М: Ньюдиамед; 2001.
- Muñoz M., Acheson A.G., Bisbe E., Butcher A., Gómez-Ramírez S., Khalafallah A.A., Kehlet H., Kietaibl S., Liumbruno G.M., Meybohm P., Rao Baikady R., Shander A., So-Osman C., Spahn D.R., Klein A.A. An international consensus statement on the management of postoperative anaemia after major surgical procedures. Anaesthesia 2018; 73(11): 1418–1431, https://doi.org/10.1111/anae.14358.
- Schoorl M., Schoorl M., van Pelt J., Bartels P.C. Application of innovative hemocytometric parameters and algorithms for improvement of microcytic anemia discrimination. Hematol Rep 2015; 7(2): 5843, https://doi.org/10.4081/hr.2015.5843.
- Weimann A., Cremer M., Hernáiz-Driever P., Zimmermann M. Delta-He, Ret-He and a new diagnostic plot for differential diagnosis and therapy monitoring of patients suffering from various disease-specific types of anemia. Clin Lab 2016; 62(4): 667–677, https://doi.org/10.7754/clin.lab.2015.150830.
- Теряева Н.Б., Кван О.К., Гаджиева О.А., Баширян Б.А. Динамический контроль лабораторных показателей при коррекции железодефицитных состояний у нейрохирургических больных. Гематология и трансфузиология 2022; 67(4): 500–509, https://doi.org/10.35754/0234-5730-2022-67-4-500-509.
- Теряева Н.Б., Кван О.К., Данилов Г.В., Струнина Ю.В. Ранние маркеры патологии эритропоэза в отсутствие анемии. Клиническая медицина 2025; 2 (в печати).
- World Health Organization. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity. Geneva; 2011. URL: http://www.who.int/vmnis/indicators/haemoglobin/en/.
- Singh N., Baby D., Rajguru J.P., Patil P.B., Thakkannavar S.S., Pujari V.B. Inflammation and cancer. Ann Afr Med 2019; 18(3): 121–126, https://doi.org/10.4103/aam.aam_56_18.
- Zhao H., Wu L., Yan G., Chen Y., Zhou M., Wu Y., Li Y. Inflammation and tumor progression: signaling pathways and targeted intervention. Signal Transduct Target Ther 2021; 6(1): 263, https://doi.org/10.1038/s41392-021-00658-5.
- Saxena S., Kruys V., Vamecq J., Maze M. The role of microglia in perioperative neuroinflammation and neurocognitive disorders. Front Aging Neurosci 2021; 13: 671499, https://doi.org/10.3389/fnagi.2021.671499.