Роль макрофагов в реализации эффектов секретома мезенхимных стромальных клеток в нише сперматогониальной стволовой клетки
Постнатальные стволовые клетки в окружении ниши на протяжении жизни поддерживают обновление и регенерацию тканей и органов. Дисфункция компонентов ниши может привести к развитию трудноизлечимых заболеваний. Ранее мы показали, что инъекция секретома мезенхимных стромальных клеток (МСК) под белочную оболочку яичка грызунов способствует восстановлению ниши сперматогониальных стволовых клеток, однако механизмы этого процесса до конца не выяснены.
Цель исследования — изучение влияния секретома МСК на резидентные макрофаги при повреждении ниши сперматогониальных стволовых клеток и на перитонеальные макрофаги у интактных животных.
Материалы и методы. Для изучения влияния секретома МСК на макрофаги у мышей моделировали токсическое повреждение сперматогенеза путем внутрибрюшинных инъекций доксорубицина в дозе 1 мг/кг с периодичностью раз в два дня до достижения суммарной дозы 10 мг/кг. В качестве второй модели использовали модель крипторхизма у крыс. Секретом МСК вводили под белочную оболочку яичка. Были сформированы группы: «интактные», «повреждение», «секретом МСК». У животных выделяли семенники и оценивали количество макрофагов с помощью иммуногистохимического анализа. Для изучения фагоцитарной активности макрофагов проводили внутримышечную инъекцию секретома МСК в бедро мыши, а затем выделяли перитонеальные макрофаги и анализировали их способность поглощать латексные частицы FITC.
Результаты. В модели крипторхизма мы показали значимое увеличение числа CD163+ М2-макрофагов в интерстициальном пространстве семенников. Инъекция секретома МСК под белочную оболочку яичка приводила к снижению количества CD163+ М2-макрофагов. В модели токсического повреждения сперматогенеза доксорубицином количество CD163+ М2-макрофагов в интерстициальном пространстве увеличивалось, однако не изменилось в группе с инъекцией секретома МСК. Число М2-макрофагов в данной модели, положительных по другому классическому маркеру CD206, также возрастало, при этом введение секретома МСК не уменьшало их количество как на ранних, так и на поздних сроках повреждения. Исследование влияния секретома МСК на перитониальные макрофаги показало, что его однократное внутримышечное введение здоровым мышам в дозах меньшей и большей, чем терапевтическая, не снижает, а, наоборот, увеличивает фагоцитарную активность макрофагов.
Заключение. Полученные результаты указывают на влияние этиологии и патогенеза повреждения на вовлеченность М2-макрофагов в реализацию эффектов секретома МСК, а также на отсутствие системной иммунотоксичности секретома МСК.
Введение
Острое или хроническое повреждение органов и тканей может приводить к развитию тяжелых заболеваний, для многих из которых в настоящее время не существует эффективных методов лечения. За восстановление поврежденных структур во взрослом организме ответственны главным образом постнатальные стволовые клетки. Однако при разрушении их специфического микроокружения (ниша стволовых клеток) эти клетки либо гибнут, либо не могут в полной мере выполнять свою функцию. Восстановление ниши — ключевой этап для успешной регенерации ткани. Активным участником поддержания и регенерации ниши в организме являются мезенхимные стромальные клетки (МСК), которые обнаружены в составе ниш стволовых клеток практически во всех тканях, в том числе у человека. Механизмы, благодаря которым МСК оказывают регенераторные эффекты на нишу, очень разнообразны: от регуляторных сигналов, передаваемых резидентным клеткам ниши, и рекрутирования функциональных клеток в нишу до прямой дифференцировки в необходимые типы клеток [1]. Показано, что чаще всего регенераторное действие МСК осуществляется за счет секреции комплекса паракринных факторов (секретома): факторов роста, хемокинов, цитокинов, молекул в составе внеклеточных везикул, компонентов внеклеточного матрикса [2]. На животных моделях повреждения ниши сперматогониальных стволовых клеток (ССК) было показано, что введение секретома МСК под белочную оболочку яичка способствует восстановлению функциональности ниши ССК и, как следствие, восстановлению сперматогенеза [3, 4]. Показанные регенераторные свойства секретома МСК представляют собой перспективную основу для разработки биологического лекарственного препарата на его основе для лечения мужского бесплодия необструктивного генеза.
При изучении механизмов действия секретома МСК установлено его влияние на основные резидентные клетки ниши: ССК, клетки Сертоли и клетки Лейдига. Однако зачастую важнейшим партнером МСК в самых различных тканеспецифичных нишах являются макрофаги [5]. МСК и макрофаги взаимно влияют друг на друга посредством межклеточных контактов, переноса органелл и секреции ряда растворимых факторов [6]. Известно, что макрофаги часто играют ключевую роль в реализации регенераторного потенциала МСК. Элиминация макрофагов в моделях повреждения легких, кишечника, почек, кожи значимо снижает положительный эффект введенного экзогенно секретома МСК [7–9]. Таким образом, несмотря на доказанное прямое действие МСК на отдельные резидентные клетки в нишах, эффекты в отношении макрофагов также могут быть значимы.
Резидентные макрофаги присутствуют в норме во многих нишах стволовых клеток. По своему фенотипу данные макрофаги близки к М2-типу, к которому традиционно относят макрофаги, обладающие противовоспалительными свойствами. При повреждениях, сопровождающихся асептическим воспалением, из кровеносного русла привлекаются моноциты, которые также могут дифференцироваться в М2-макрофаги [10]. Повышение числа макрофагов является необходимым этапом для успешного разрешения воспаления. Однако длительное поддержание числа М2-макрофагов на высоком уровне может приводить к развитию хронического воспаления и дальнейшему патологическому ремоделированию тканей [11, 12].
Гипотеза настоящего исследования состоит в том, что одним из регенераторных механизмов секретома МСК может быть снижение количества М2-макрофагов в нише ССК. В исследовании были использованы две модели повреждения сперматогенеза: токсическое повреждение доксорубицином у мышей и двусторонний абдоминальный крипторхизм у крыс. Преимуществом данных моделей является комплексное и обратимое повреждение ниши ССК, что позволяет оценить регенераторное действие секретома МСК на разные компоненты ниши ССК, включая макрофаги [13].
Несмотря на то, что локальное снижение избыточной иммунной активности в органе-мишени является важным условием успешной регенерации, уменьшение физиологического уровня активности иммунной системы организма (иммунотоксичность) может привести к нежелательным побочным эффектам. В данной работе мы также изучили влияние секретома МСК на фагоцитарную активность перитонеальных макрофагов у здоровых мышей, что необходимо для оценки безопасности секретома МСК как основы для биологического лекарственного препарата.
Цель исследования — изучение влияние секретома мезенхимных стромальных клеток на резидентные макрофаги на моделях повреждения ниши сперматогониальных стволовых клеток и на перитонеальные макрофаги.
Материалы и методы
Выделение мезенхимных стромальных клеток из жировой ткани человека
Мезенхимные стромальные клетки жировой ткани человека получены из биобанка Института регенеративной медицины Московского государственного университета им. М.В. Ломоносова, ID коллекции: MSU_MSC_AD (https://human.depo.msu.ru). Клетки культивировали в среде (Mesenchymal Stem Cell maintenance medium; AdvanceSTEM, США) с 10% питательных добавок (Stem Cell Growth Supplement; AdvanceSTEM, США). Среду меняли через 3 или 4 сут. Пассирование клеток выполняли до 4–5-го пассажа при достижении около 80% конфлюэнта.
Получение секретома мезенхимных стромальных клеток человека
Мезенхимные стромальные клетки жировой ткани, достигшие 80% конфлюентности, на 4–5-м пассаже трехкратно промывали раствором Хэнкса («ПанЭко», Россия). Затем к клеткам добавляли среду DMEM с низкой концентрацией глюкозы (DMEM-LG; Thermo Fisher Scientific, США) и культивировали на протяжении 7 сут. Кондиционированную среду (секретом) собирали и центрифугировали 10 мин при 300 g для очистки от клеточного дебриса.
Концентрирование секретома мезенхимных стромальных клеток
Концентрирование проводили на фильтрах для центрифуги Vivaspin turbo 15 (Sartorius, Великобритания), имеющих размер пор, отсекающий молекулы размером меньше 10 кДа. Фильтры трижды промывали пропусканием через них 2% раствора пенициллина–стрептомицина в фосфатно-солевом буфере. Секретом МСК помещали в промытые фильтры и центрифугировали при температуре +4°С и скорости 3000 g до уменьшения объема раствора в 50 раз по сравнению с изначальным. Полученный концентрат собирали для дальнейших экспериментов.
Животные
Животных содержали в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, а также с ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур».
Моделирование двустороннего абдоминального крипторхизма. Работа была выполнена на взрослых крысах-самцах возрастом 3,5–4,0 мес. Для моделирования крипторхизма использовали отработанную ранее методику [3]. Данная модель является подходящей для создания обратимого повреждения ниши ССК [14]. Яички через паховый канал поднимали из мошонки в брюшную полость, затем фиксировали узловым швом к брюшной стенке в области латеральных каналов с помощью атравматической нити Prolene 4/0. Нить проходила через дистальный полюс яичка для предотвращения возможного блокирования сообщения между выносящим придатком яичка и семенными канальцами. Особое внимание уделяли исключению возможности захватывания швом кровеносных сосудов и семявыносящего протока. На 15-й день после начала эксперимента (через 2 нед) яички низводили в мошонку с помощью удаления фиксирующей лигатуры с последующим их смещением в паховый канал и параллельным введением испытуемого образца или препарата сравнения. Таким образом было сформировано 3 группы животных: «интактные» (без манипуляций), «повреждение» (с моделированным крипторхизмом, без инъекции), «секретом МСК» (введение животным с крипторхизмом секретома МСК в дозе 10 УЕ/животное). Секретом МСК вводили параллельно с низведением яичек крысам под белочную оболочку яичка в объеме 100 мкл в яичко. Перед введением секретом МСК смешивали с коллагеновым гелем «Аппликолл» (коллаген очищенный свиной I типа; «МакМеди», Россия) в соотношении 1:4. Через 1 мес или через 3 мес животных подвергали эвтаназии с помощью диоксида углерода (СО2) с последующим контролем наступления смерти. Такие сроки выведения выбраны исходя из длительности цикла сперматогенеза, который у крыс составляет 54 дня. Выбранные сроки эвтаназии 1 мес (30 дней) и 3 мес (90 дней) позволяют оценить сперматогенез до и после прохождения полного цикла [15]. После эвтаназии у самцов выделяли яички для дальнейшего анализа.
Моделирование токсического повреждения сперматогенеза доксорубицином. Работа была выполнена на взрослых мышах-самцах линии C57Bl/6 возрастом 8–10 нед. В качестве повреждающего агента использовали доксорубицин. Основным механизмом воздействия доксорубицина является подавление синтеза ДНК и РНК: интеркаляция в двойную спираль ДНК между парами азотистых оснований, вследствие чего нарушается матрица и изменяется пространственная структура нуклеиновых кислот. В связи с этим доксорубицин повреждает быстро делящиеся клетки, в том числе ССК, вызывая мужское бесплодие [16]. Преимуществом доксорубицина для моделирования по сравнению с другими химиотерапевтическими агентами является воздействие на разные клетки ниши, что обеспечивает комплексность повреждения и возможность отразить плейотропность действия секретома МСК. Кроме того, действие доксорубицина является обратимым [13].
В пилотных исследованиях был выполнен подбор оптимальной дозы доксорубицина. В результате гистологического анализа и анализа спермограммы установлено, что достаточным, но в то же время обратимым повреждением является доза 1 мг/кг. Препарат доксорубицина гидрохлорид вводили внутрибрюшинно в дозе 1 мг/кг с периодичностью раз в два дня. Суммарная доза введенного препарата составила 10 мг/кг. Таким образом было сформировано 3 группы животных: «интактные» (без манипуляций), «повреждение» (с токсическим повреждением, без инъекции), «секретом МСК» (введение животным с токсическим повреждением секретома МСК в дозе 10 УЕ/животное). Секретом МСК вводили после курса доксорубицина под белочную оболочку яичка в объеме 50 мкл в яичко. Перед введением его смешивали с коллагеновым гелем «Аппликолл» в соотношении 1:4. Через 5 нед или через 5 мес животные подвергались эвтаназии с помощью диоксида углерода (СО2) с последующим контролем наступления смерти. Такие сроки выбраны исходя из длительности цикла сперматогенеза, который у мышей составляет 5 нед (35 дней). Выбранные сроки эвтаназии соответствуют 1 циклу (35 дней) и 4–5 циклам (5 мес) сперматогенеза [14]. После эвтаназии у самцов выделяли яички для дальнейшего анализа.
Оценка фагоцитоза частиц латекса перитонеальными макрофагами мышей. Оценку влияния в группе «секретом МСК» на фагоцитарную активность перитонеальных макрофагов проводили в соответствии с рекомендациями по оценке иммунотоксических свойств лекарственных средств [17]. Работа была выполнена на здоровых взрослых мышах-самцах линии C57Bl/6 («СМК СТЕЗАР», Россия) возрастом 8–10 нед и массой 16–25 г. Было сформировано 3 экспериментальные группы: «интактные», «интактные + секретом МСК 250 УЕ/кг», «интактные + секретом МСК 416,5 УЕ/кг». Дозы в соответствии с требованиями ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур» были рассчитаны таким образом, чтобы находиться ниже и выше терапевтической дозы (10 УЕ/животное), и составляли 7,5 и 12,5 УЕ/животное. При пересчете на массу тела мыши массой 30 г дозы для внутримышечного введения секретома МСК составляли: 250 УЕ/кг (7,5 УЕ/животное/30 г·1000 г) и 416,5 УЕ/кг (12,5 УЕ/животное/30 г·1000 г). Пересчет на массу животного в данном эксперименте необходим в связи с системным внутримышечным введением секретома МСК. Затем животным с введением секретома МСК однократно дробно (тремя частями с интервалом между введениями 1 ч) внутрибрюшинно на 8-й день исследования вводили 3 мл 3% тиогликолевой среды (ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии», Россия) с целью увеличения количества выделяемых макрофагов.
На 11-й день эксперимента проводили отбор перитонеального экссудата. Для этого мышей на начальном этапе эвтаназировали с помощью диоксида углерода (CO2) с последующей цервикальной дислокацией (конечный этап). Последующие процедуры осуществляли под ламинарным потоком воздуха для достижения максимально стерильных условий. Брюшную стенку обрабатывали 70% этанолом, затем на передней брюшной стенке срезали кожу. В брюшную полость с помощью шприца вводили 10 мл физиологического раствора комнатной температуры. Брюшную полость массировали, затем шприцем отбирали экссудат в пробирки объемом 15 мл. Процедуру повторяли 5–6 раз, только при этом вводимый объем физиологического раствора составлял 5 мл. Пробирки с экссудатом центрифугировали на центрифуге СМ-6МТ (ELMI SIA, Латвия) в течение 10 мин при 300 g.
Изучение фагоцитарной активности макрофагов
Осадок ресуспендировали в среде DMEM с L-глутамином (серия ДМ-21-02 HS; «Биолот», Россия), содержащей 10% FBS (серия RE0000002; HyClone, США) в объеме 10 мл. Используя гематологический анализатор Mythic 18 Vet (Orphee, Швейцария), определяли абсолютное количество макрофагов. В среднем у мышей выделяли около 30 млн макрофагов. Для дальнейших процедур в стерильных условиях выкладывали по два покровных стекла на дно чашек Петри. Суспензию клеток от каждого животного в объеме 10 мл переливали в чашки Петри (от каждого животного по 1 чашке Петри) и помещали в CO2-инкубатор в условия 37°С и 5% CO2 на 2 ч. Во время инкубации готовили среду DMEM с содержанием частиц латекса диаметром 1 мкм, конъюгированных с FITC (серия MKCL6564; Sigma-Aldrich, США), из расчета 100 частиц латекса на 1 макрофаг. Неадгезированные клетки сливали. Оставшиеся клетки промывали четырежды 10 мл физиологического раствора, затем добавляли 10 мл среды с латексными частицами и инкубировали 3 ч при температуре 37ºС и 5% СO2. После инкубации чашки Петри промывали 4 раза физиологическим раствором в объеме 10 мл. Покровные стекла окрашивали по методу Романовского–Гимзе (для удобства окраску проводили непосредственно в чашке) и высушивали при комнатной температуре.
Для флуоресцентного анализа в чашки Петри добавляли 5 мл раствора трипанового синего (0,8 мг/мл), инкубировали в течение 1 мин для устранения флуоресценции частиц, оказавшихся снаружи клеток. После процедуры инактивирования флуоресценции покровное стекло помещали на предметное и проводили микроскопический анализ с использованием флуоресцентной (поглощение 495 нм, испускание 517 нм) и световой микроскопии (микроскоп Axio Lab.A1; Carl Zeiss Microscopy GmbH, Германия).
Подсчитывали количество частиц, поглощенных 100 макрофагами. Учитывали количество частиц для каждого проанализированного макрофага. Вычисляли индекс фагоцитарной активности, равный отношению общего количества поглощенных частиц латекса и количества макрофагов.
Иммуногистохимические методы
Яички, полученные от животных после эвтаназии, фиксировали в 10% растворе формалина, выдерживали 24 ч, а затем заливали в парафин. После делали поперечные срезы толщиной 1 мкм, депарафинизировали последовательным перемещением в более разбавленный спиртовой раствор. Демаскирование проводили в 0,1 М цитратном буфере, выдерживая образцы 20 мин при температуре 98°C. Мечение ткани осуществляли анителами в соответствии с протоколами производителей. В эксперименте использованы следующие красители и антитела: DAPI (Sigma, Германия) — маркер ДНК; CD206 (ab64693; Abcam, США) и CD163 (ab182422; Abcam, США) — маркеры М2-макрофагов.
Микроскопическое исследование проводили с помощью микроскопа Leica DM600Β, снабженного камерой Leica DFC 420Х (Leica Microsystems, Германия). Для обсчета получали не менее 5 репрезентативных фотографий с одного препарата. Обработку и анализ изображений выполняли с использованием программного обеспечения LasX (Leica Microsystems, Германия) и FiJi.
Статистический анализ
В соответствии с описательной статистикой данные проверены на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка (Shapiro-Wilk’s W test). При нормальном распределении рассчитывали среднее значение (M) и стандартную ошибку среднего (SEM). Для данных, не соответствующих нормальному распределению, были посчитаны медиана (Ме) и квартильный размах [Q1; Q3]. Межгрупповые сравнения проводили параметрическими или непараметрическими методами после получения данных о типе распределения. Однофакторный дисперсионный анализ (ANOVA) с последующим межгрупповым сравнением (post hoc) с использованием теста Тьюки применяли для оценки данных с нормальным распределением. Для данных, не соответствующих нормальному распределению, осуществляли попарное сравнение с использованием критерия Манна–Уитни и критерия Краскела–Уоллиса. Различия считали значимыми при p<0,05. Для статистического анализа использовали программное обеспечение Statistica 10.0 (StatSoft, США).
Результаты
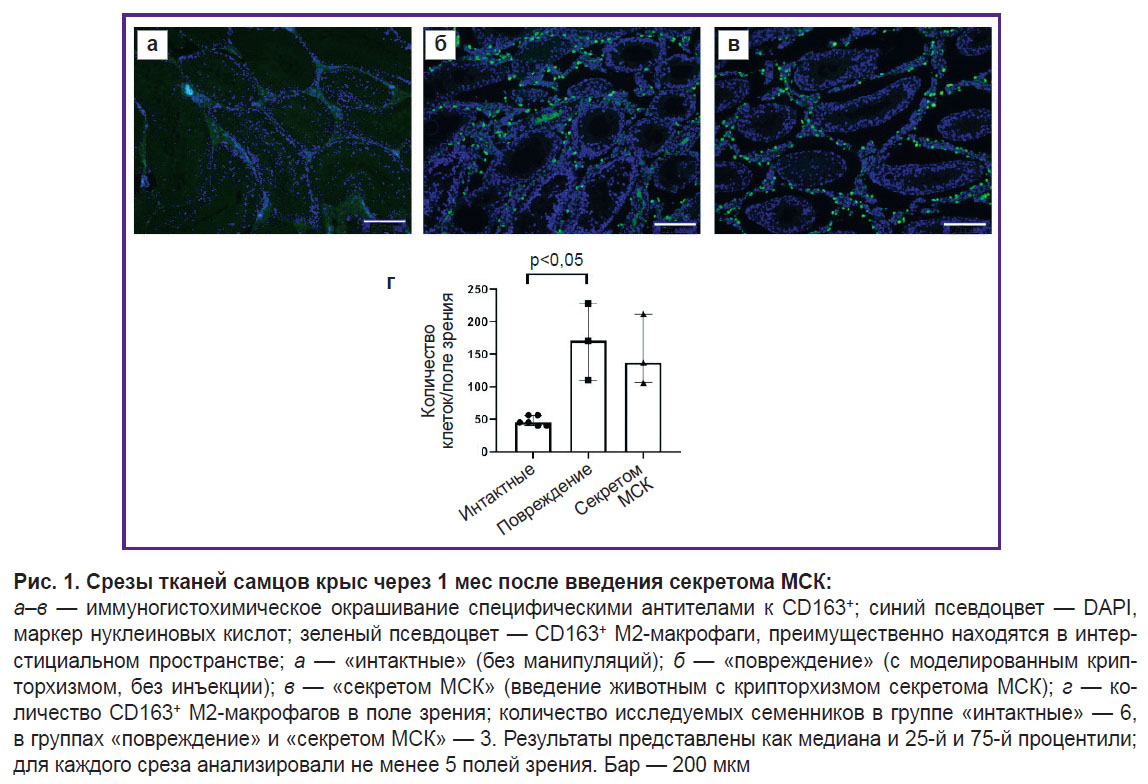
Секретом МСК не влияет на количество CD163+ М2-макрофагов в интерстициальном пространстве в модели крипторхизма на ранних сроках повреждения через 1 мес после инъекции секрето-ма МСК.
Для изучения влияния секретома МСК на содержание макрофагов в семенниках при повреждении у крыс моделировали двусторонний абдоминальный крипторхизм. Подъем яичек в брюшную полость на 2 нед приводил к существенному нарушению сперматогенного эпителия, гиперплазии интерстиция и значимому увеличению числа CD163+ М2-макрофагов в интерстициальном пространстве. Ранее мы показали, что введение секретома МСК под белочную оболочку яичка способствует восстановлению структуры и функции ниши ССК [3]. На ранних сроках количество CD163+ М2-макрофагов в семенниках животных с крипторхизмом, которым локально вводили секретом МСК, значимо не снижается (рис. 1).
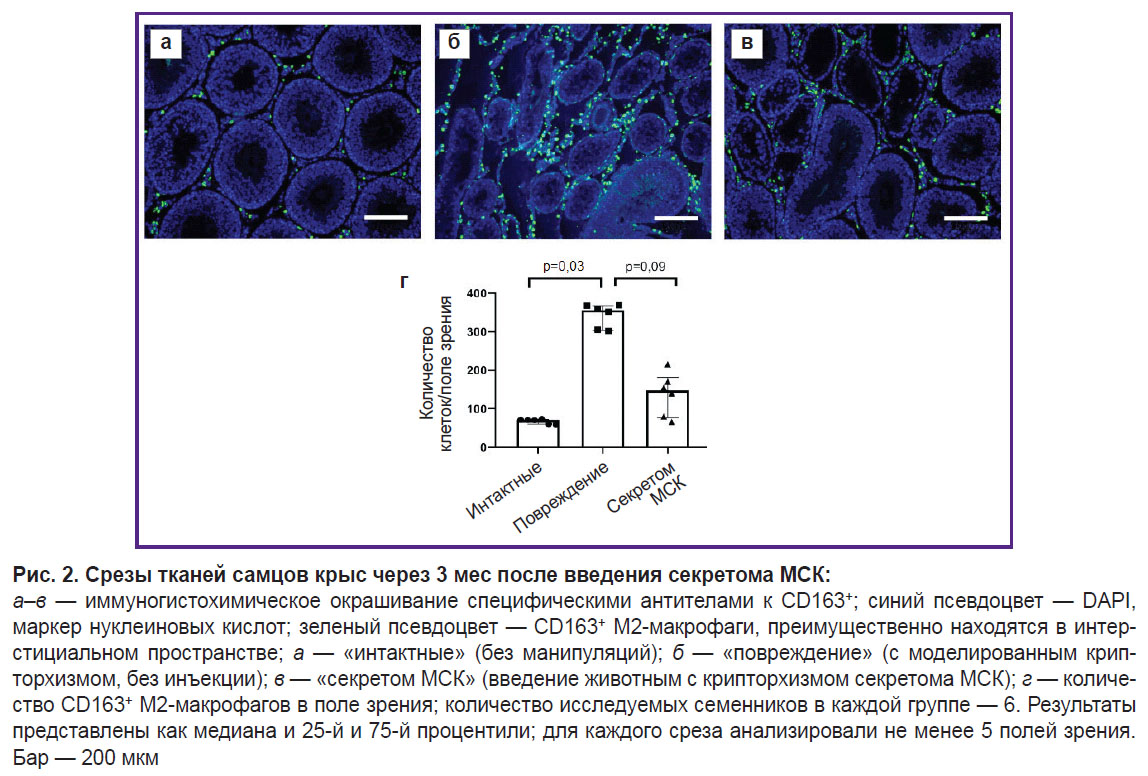
Секретом МСК способствует снижению числа CD163+ М2-макрофагов в интерстициальном пространстве в модели крипторхизма на поздних сроках через 3 мес после инъекции секретома МСК.
На поздних сроках в модели крипторхизма через 3 мес после введения секретома МСК мы наблюдали снижение количества CD163+ М2-макрофагов в семенниках животных, что может являться значимым механизмом действия секретома МСК, опосредующим стимуляцию восстановления ниши (рис. 2).
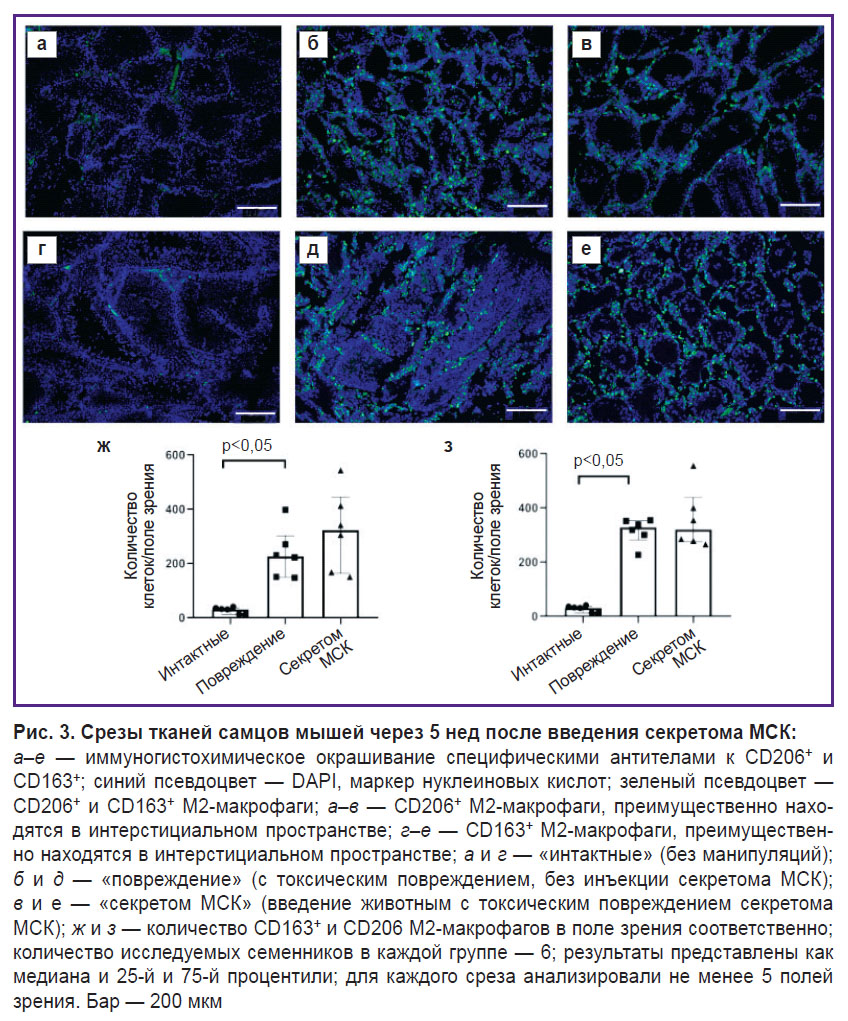
Секретом МСК не влияет на количество М2-макрофагов в интерстициальном пространстве в модели токсического повреждения доксорубицином на ранних сроках повреждения через 5 нед после инъекции секретома МСК.
Для подтверждения нашей гипотезы о влиянии секретома МСК на содержание М2-макрофагов в поврежденной нише ССК мы смоделировали токсическое повреждение сперматогенеза доксорубицином у мышей. После курса инъекций доксорубицина количество CD163+ М2-макрофагов через 5 нед в интерстиции яичек значимо увеличилось. Однако локальное введение секретома МСК не повлияло на количество макрофагов (рис. 3, ж). Мы также проанализировали содержание М2-макрофагов в семенниках, используя другой классический маркер М2-макрофагов — CD206, и получили аналогичные результаты: при повреждении доксорубицином количество CD206+ М2-макрофагов также значимо увеличилось, а введение секретома МСК не изменяло число CD206+ М2-макрофагов (рис. 3, з).
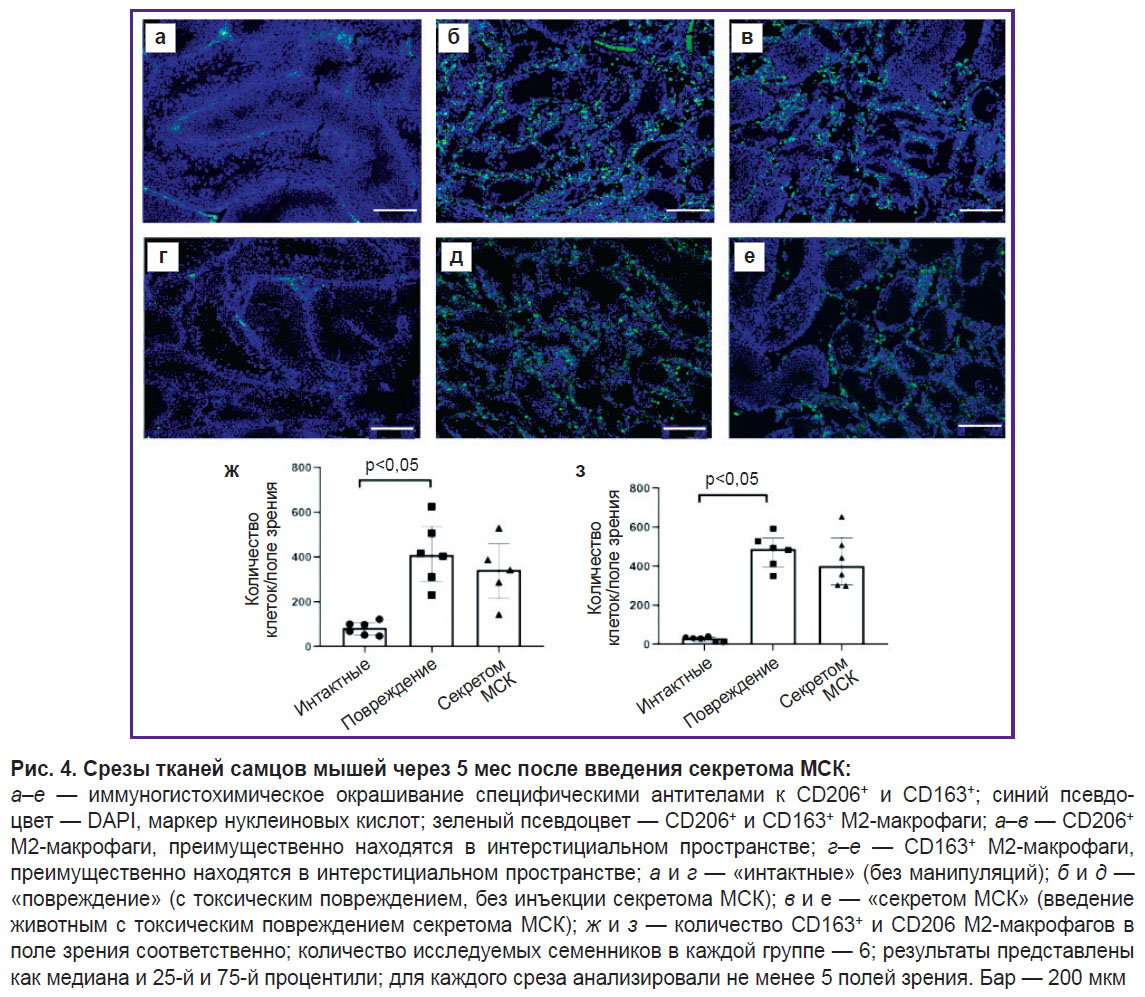
Секретом МСК не влияет на количество М2-макрофагов на поздних сроках повреждения в модели токсического повреждения доксорубицином.
Для того чтобы убедиться, что введение секретома МСК под белочную оболочку яичка мышам с моделью токсического повреждения сперматогенеза не оказывает влияния на содержание М2-макрофагов на более поздних сроках, мы проанализировали срезы семенников через 5 мес после его локального введения. Обнаружено, что количество М2-макрофагов в поврежденной нише ССК было также значимо выше по сравнению с интактными животными, однако введение секретома МСК значимо не влияло на их количество (рис. 4).
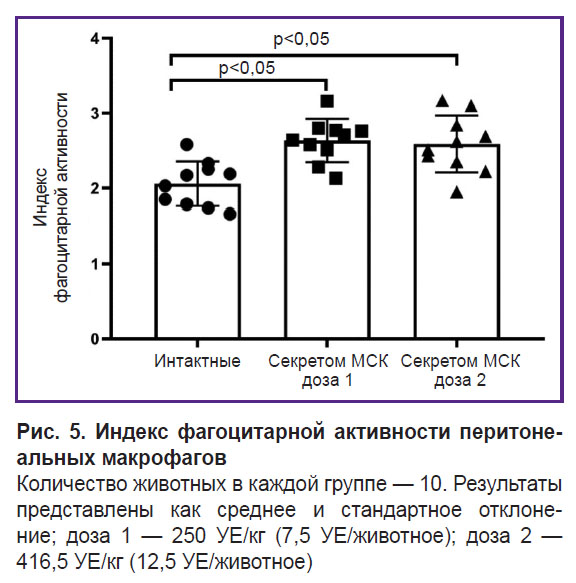
Секретом МСК не обладает иммунотоксичностью по отношению к макрофагам.
Изучение фагоцитарной активности макрофагов было проведено с помощью классического теста для оценки неспецифического звена иммунного ответа с использованием поглощения частиц латекса, конъюгированных с FITC. Установлено, что однократное внутримышечное введение секретома МСК в дозах 250 УЕ/кг (7,5 УЕ/животное) и 416,5 УЕ/кг (12,5 УЕ/животное) не снижало активность системных перитонеальных макрофагов, а, наоборот, увеличивало их фагоцитарную активность (рис. 5).
Обсуждение
Макрофаги являются важными поддерживающими клетками во многих нишах стволовых клеток. В нише ССК также обнаружены М2-макрофаги, ведущая роль которых состоит в регуляции других клеток и обеспечении иммунопривилегированности ниши ССК [18]. На двух различных моделях повреждения ниши ССК мы показали, что при повреждении количество М2-макрофагов, положительных по маркерам CD163 и CD206, в интерстициальном пространстве значимо возрастает. Наши данные хорошо согласуются с данными других авторов, которые утверждают, что количество М2-макрофагов в других моделях повреждения сперматогенеза также значительно увеличивается по сравнению с интактными животными [19–21]. При этом показано, что при введении секретома МСК под белочную оболочку яичка в модели крипторхизма у крыс снижается число CD163+ М2-макрофагов на поздних сроках, что ассоциировано с восстановлением структуры ниши и репродуктивной функции самцов [3]. Однако в модели токсического повреждения у мышей количество CD163+ и CD206+ М2-макрофагов значимо не меняется как на ранних, так и на поздних сроках. Отсутствие эффекта на М2-макрофаги может быть связано с отличиями моделей и патогенеза повреждения ниши ССК при используемых воздействиях. Так, при введении доксорубицина повреждение семенных канальцев оказалось более выраженным, чем при крипторхизме. В нашей предыдущей работе [4] показано, что в модели токсического повреждения сперматогенеза, несмотря на то что после введения секретома МСК количест-
во сперматозоидов значимо увеличивается, количество нормальных и восстанавливающихся канальцев значимо не отличается от группы животных без лечения. В то же время в модели крипторхизма при введении секретома МСК количество поврежденных канальцев снижается, а число нормальных и восстанавливающихся значимо возрастает [3]. Таким образом, две модели показывают разный уровень восстановления ниши ССК, а следовательно, клеточные механизмы восстановления ниши под действием секретома МСК, по-видимому, также могут различаться, что требует дальнейшего изучения.
Макрофаги могут быть не только прямой мишенью секретома МСК, но и посредниками в реализации его эффектов на другие клетки ниши ССК. Рядом авторов [22–24] было показано ингибирующее действие макрофагов in vitro на секреторную активность и устройство цитоскелета клеток Лейдига. Так, снижение числа макрофагов после введения секретома МСК может способствовать увеличению секреторной активности клеток Лейдига, что также важно для нормального функционирования ниши ССК.
В данном исследовании продемонстрировано, что секретом МСК не снижает функциональную активность перитонеальных макрофагов. Более того, их фагоцитарная активность значимо возрастала в группах животных, получающих секретом МСК. Поскольку секретом МСК в своем составе содержит компоненты человеческого происхождения, увеличение фагоцитарной активности перитонеальных макрофагов мыши может быть связано с естественной иммунной реакцией организма экспериментальных животных в ответ на введение чужеродных белков.
Заключение
Секретом МСК показал локальную активность в отношении М2-макрофагов на модели крипторхизма у крыс. В поврежденной нише ССК при локальном введении секретома МСК снижается количество М2-макрофагов, что может вносить значимый вклад в восстановление ниши. Однако этот эффект, по-видимому, зависит от генеза и степени повреждения ниши ССК. Важно отметить, что секретом МСК не ингибирует функциональную активность перитонеальных макрофагов, не оказывая токсичного действия на макрофагальный компонент иммунной системы. Полученные данные о влиянии секретома МСК на М2-макрофаги и отсутствии иммунотоксичности имеют важное значение для дальнейшей трансляции его в клиническую практику.
Финансирование. Работа выполнена в рамках государственного задания МГУ имени М.В. Ломоносова.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Sagaradze G.D., Basalova N.A., Efimenko A.Y., Tkachuk V.A. Mesenchymal stromal cells as critical contributors to tissue regeneration. Front Cell Dev Biol 2020; 8: 576176, https://doi.org/10.3389/fcell.2020.576176.
- Sagaradze G., Grigorieva O., Nimiritsky P., Basalova N., Kalinina N., Akopyan Z., Efimenko A. Conditioned medium from human mesenchymal stromal cells: towards the clinical translation. Int J Mol Sci 2019; 20(7): 1656, https://doi.org/10.3390/ijms20071656.
- Sagaradze G., Basalova N., Kirpatovsky V., Ohobotov D., Nimiritsky P., Grigorieva O., Popov V., Kamalov A., Tkachuk V., Efimenko A. A magic kick for regeneration: role of mesenchymal stromal cell secretome in spermatogonial stem cell niche recovery. Stem Cell Res Ther 2019; 10(1): 342, https://doi.org/10.1186/s13287-019-1479-3.
- Monakova A., Sagaradze G., Basalova N., Popov V., Balabanyan V., Efimenko A. Novel potency assay for MSC secretome-based treatment of idiopathic male infertility employed leydig cells and revealed vascular endothelial growth factor as a promising potency marker. Int J Mol Sci 2022; 23(16): 9414, https://doi.org/10.3390/ijms23169414.
- Pajarinen J., Lin T., Gibon E., Kohno Y., Maruyama M., Nathan K., Lu L., Yao Z., Goodman S.B. Mesenchymal stem cell-macrophage crosstalk and bone healing. Biomaterials 2019; 196: 80–89, https://doi.org/10.1016/j.biomaterials.2017.12.025.
- Lu D., Xu Y., Liu Q., Zhang Q. Mesenchymal stem cell-macrophage crosstalk and maintenance of inflammatory microenvironment homeostasis. Front Cell Dev Biol 2021; 9: 681171, https://doi.org/10.3389/fcell.2021.681171.
- Willis G.R., Fernandez-Gonzalez A., Anastas J., Vitali S.H., Liu X., Ericsson M., Kwong A., Mitsialis S.A., Kourembanas S. Mesenchymal stromal cell exosomes ameliorate experimental bronchopulmonary dysplasia and restore lung function through macrophage immunomodulation. Am J Respir Crit Care Med 2018; 197(1): 104–116, https://doi.org/10.1164/rccm.201705-0925OC.
- Galipeau J. Macrophages at the nexus of mesenchymal stromal cell potency: the emerging role of chemokine cooperativity. Stem Cells 2021; 39(9): 1145–1154, https://doi.org/10.1002/stem.3380.
- He X., Dong Z., Cao Y., Wang H., Liu S., Liao L., Jin Y., Yuan L., Li B. MSC-derived exosome promotes M2 polarization and enhances cutaneous wound healing. Stem Cells Int 2019; 2019: 7132708, https://doi.org/10.1155/2019/7132708.
- Koncz G., Jenei V., Tóth M., Váradi E., Kardos B., Bácsi A., Mázló A. Damage-mediated macrophage polarization in sterile inflammation. Front Immunol 2023; 14: 1169560, https://doi.org/10.3389/fimmu.2023.1169560.
- Wang M., Yang Y., Cansever D., Wang Y., Kantores C., Messiaen S., Moison D., Livera G., Chakarov S., Weinberger T., Stremmel C., Fijak M., Klein B., Pleuger C., Lian Z., Ma W., Liu Q., Klee K., Händler K., Ulas T., Schlitzer A., Schultze J.L., Becher B., Greter M., Liu Z., Ginhoux F., Epelman S., Schulz C., Meinhardt A., Bhushan S. Two populations of self-maintaining monocyte-independent macrophages exist in adult epididymis and testis. Proc Natl Acad Sci U S A 2021; 118(1): e2013686117, https://doi.org/10.1073/pnas.2013686117.
- Mahi-Brown C.A., Tung K.S. Activation requirements of donor T cells and host T cell recruitment in adoptive transfer of murine experimental autoimmune orchitis (EAO). Cell Immunol 1989; 124(2): 368–379, https://doi.org/10.1016/0008-8749(89)90138-x.
- Sagaradze G., Monakova A., Basalova N., Popov V., Balabanyan V., Efimenko A. Regenerative medicine for male infertility: a focus on stem cell niche injury models. Biomed J 2022; 45(4): 607–614, https://doi.org/10.1016/j.bj.2022.01.015.
- Sagaradze G.D., Basalova N.A., Kirpatovsky V.I., Ohobotov D.A., Grigorieva O.A., Balabanyan V.Y., Kamalov A.A., Efimenko A.Y. Application of rat cryptorchidism model for the evaluation of mesenchymal stromal cell secretome regenerative potential. Biomed Pharmacother 2019; 109: 1428–1436, https://doi.org/10.1016/j.biopha.2018.10.174.
- Perrard M.H., Sereni N., Schluth-Bolard C., Blondet A., D Estaing SG, Plotton I., Morel-Journel N., Lejeune H., David L., Durand P. Complete human and rat ex vivo spermatogenesis from fresh or frozen testicular tissue. Biol Reprod 2016; 95(4): 89, https://doi.org/10.1095/biolreprod.116.142802.
- Охоботов Д.А., Сагарадзе Г.Д., Монакова А.О., Басалова Н.А., Балабаньян В.Ю., Попов В.С., Кирпатовский В.И., Нестерова О.Ю., Ефименко А.Ю., Камалов А.А. Моделирование нарушений сперматогенеза химиотерапевтическими средствами — цисплатином и доксорубицином. Экспериментальная и клиническая урология 2021; 14(4): 95–101.
- Касторнова А.Е., Коротченко Е.С., Крышень К.Л., Ацапкина А.А., Бекетова Д.Д., Макарова М.Н. Рекомендации по оценке иммунотоксических свойств лекарственных средств. Фагоцитарная активность макрофагов. Международный вестник ветеринарии 2014; 1: 85–91.
- Mossadegh-Keller N., Sieweke M.H. Testicular macrophages: guardians of fertility. Cell Immunol 2018; 330: 120–125, https://doi.org/10.1016/j.cellimm.2018.03.009.
- Chen Q., Deng T., Han D. Testicular immunoregulation and spermatogenesis. Semin Cell Dev Biol 2016; 59: 157–165, https://doi.org/10.1016/j.semcdb.2016.01.019.
- Achua J.K., Chu K.Y., Ibrahim E., Khodamoradi K., Delma K.S., Iakymenko O.A., Kryvenko O.N., Arora H., Ramasamy R. Histopathology and ultrastructural findings of fatal COVID-19 infections on testis. World J Mens Health 2021; 39(1): 65–74, https://doi.org/10.5534/wjmh.200170.
- Zheng W., Zhang S., Jiang S., Huang Z., Chen X., Guo H., Li M., Zheng S. Evaluation of immune status in testis and macrophage polarization associated with testicular damage in patients with nonobstructive azoospermia. Am J Reprod Immunol 2021; 86(5): e13481, https://doi.org/10.1111/aji.13481.
- Sun X.R., Hedger M.P., Risbridger G.P. The effect of testicular macrophages and interleukin-1 on testosterone production by purified adult rat Leydig cells cultured under in vitro maintenance conditions. Endocrinology 1993; 132(1): 186–192, https://doi.org/10.1210/endo.132.1.8419122.
- Bhushan S., Meinhardt A. The macrophages in testis function. J Reprod Immunol 2017; 119: 107–112, https://doi.org/10.1016/j.jri.2016.06.008.
- Bilińska B., Kmicikiewicz I., Pierściński A., Sadowska J. The effect of testicular macrophages, macrophage-conditioned medium and interleukin-1 alpha on the cytoskeleton of bank vole Leydig cells. Exp Clin Endocrinol Diabetes 1999; 107(5): 281–287, https://doi.org/10.1055/s-0029-1212113.