Критерии атрофических изменений слизистой оболочки влагалища при генитоуринарном менопаузальном синдроме
Цель исследования — определение критериев атрофии слизистой оболочки влагалища при генитоуринарном менопаузальном синдроме (ГУМС) и возрастной нормы путем сопоставления данных метода оптической когерентной томографии (ОКТ) и гистологического исследования биопсийного материала.
Материалы и методы. В исследовании участвовали 25 пациентов с клиническими проявлениями ГУМС и 3 условно здоровые женщины (средний возраст — 56,7±1,4 года). В процессе гинекологического осмотра проведена кольповагиноскопия и рассчитан индекс вагинального здоровья. ОКТ-исследование выполнено в трех анатомических точках преддверия и верхнего отдела влагалища (данные области богаты рецепторами эстрогена и поражаются при ГУМС наиболее часто). Из правой точки преддверия влагалища осуществлена также биопсия с дальнейшим гистологическим исследованием и PAS-реакцией для выявления гликогена. Количественную оценку толщины эпидермиса проводили по ОКТ- и гистологическим изображениям. Определены уровни сигнала от эпителия и соединительной ткани с проведением эпителиально-стромальной стратификации.
Результаты. Нормальная слизистая оболочка влагалища на ОКТ-изображениях имеет слоистую структуру, включая эпителий толщиной 503 [467; 550] мкм с низкой интенсивностью ОКТ-сигнала и собственную пластинку слизистой оболочки с высоким ОКТ-сигналом. В результате разницы уровней сигнала от эпителия и собственной пластинки формируется контрастная граница между ними. Уровень сигнала от эпителия составил 54,1 [51,5; 56,3] у.е., а от соединительной ткани — 70,7 [65,9; 73,7] у.е. Слизистая оболочка имеет складки, что на ОКТ-изображениях выглядит как волнообразная граница эпителия и подслизистой оболочки.
На основании значений индекса вагинального здоровья и данных кольповагиноскопии пациенты с ГУМС были разделены на 2 группы: с атрофией слизистой оболочки легкой степени и атрофией тяжелой степени. У пациентов с атрофией легкой степени наблюдали снижение толщины эпителия до 261 [244; 289] мкм; уровень сигнала от эпителия увеличивался за счет снижения содержания гликогена и составлял 61,6 [55,0; 65,5] у.е., от соединительной ткани — 79,5 [77,2; 79,9] у.е. Складки слизистой оболочки не прослеживались. У пациентов с атрофией тяжелой степени наблюдали значительное снижение толщины эпидермиса до 158 [143; 191] мкм; уровень сигнала от эпителия составлял 69,7 [67,1; 72,4] у.е., что снижает контрастность границы эпителия и подслизистой основы (это объясняется отсутствием гликогена), а от соединительной ткани — 90,32 [80,90; 101,60] у.е. Складки слизистой оболочки не прослеживались. Индекс стратификации не изменился в связи с тем, что интенсивность сигнала при атрофии влагалища как от эпителия, так и от собственной пластинки (стромы) растет синхронно. Измерения толщины эпидермиса по гистологическим препаратам показали высокий уровень согласованности с ОКТ-измерениями (r=0,93; p<0,0001).
Заключение. Определены ОКТ-критерии возрастной нормы изменений слизистой оболочки влагалища и атрофии при ГУМС легкой и тяжелой степени выраженности, что позволит облегчить персонализацию лечебных подходов и оптимизировать ведение таких больных.
Введение
Перименопаузальный и постменопаузальный возраст является одним из важных периодов в жизни женщины. На фоне снижения функции яичников возникает дефицит половых гормонов (в том числе эстрогенов), который проявляется не только ухудшением общего состояния, но и локальными симптомами атрофии вульвы и влагалища. Клинические симптомы вульвовагинальной атрофии (сухость, зуд, жжение во влагалище, опущение стенок влагалища) в сочетании с сексуальными нарушениями (диспареунией, посткоитальными кровяными выделениями) и расстройствами мочеиспускания (гиперактивным мочевым пузырем, недержанием мочи, рецидивирующими инфекциями мочевых путей) объединяют в генитоуринарный менопаузальный синдром (ГУМС). Проявления ГУМС — достаточно частая проблема у женщин перименопаузального возраста. По разным источникам, с симптомами ГУМС сталкивается от 50 до 70% пациенток, но далеко не каждая сможет поделиться этим с гинекологом ввиду стыдливости, зачастую оправдывая происходящее возрастными изменениями [1, 2].
Стенка влагалища состоит из трех слоев: внутреннего — слизистой оболочки, среднего — гладкомышечного, наружного — адвентициального. Слизистая оболочка влагалища выстлана неороговевающим гликогенизированным многослойным плоским эпителием и состоит из клеток четырех типов: базальных, парабазальных, промежуточных и поверхностных, формирующих около 30–40 рядов. Под эпителием расположена собственная пластинка слизистой оболочки, которая представлена соединительной тканью и содержит коллагеновые, эластические волокна, фибробласты, кровеносные и лимфатические сосуды, а также нервные волокна. Рецепторы эстрогенов содержатся в эпителии влагалища (базальном и парабазальном слоях), гладкомышечных клетках сосудов, коже, поперечнополосатых мышцах промежности, уротелии, а также в эндотелии сосудов влагалища, в стенке мочевого пузыря и уретры. Эстрогены, воздействуя на рецепторы, находящиеся в слоях многослойного плоского эпителия, стимулируют пролиферацию и дифференцировку клеток. Активация рецепторов эстрогенов на кровеносных сосудах приводит к опосредованной стимуляции выработки оксида азота, вазодилатации и усилению микроциркуляции в тканях за счет увеличения скорости кровотока и уменьшения застойных явлений на уровне мелких сосудов, при активации рецепторов в фибробластах стромы влагалища происходит стимуляция синтеза коллагена [3, 4]. Стенки влагалища не содержат желез, поэтому вагинальный секрет образуется за счет транссудации из сосудов влагалищной стенки, а также секреции желез цервикального канала и преддверия влагалища [5].
На фоне эстрогенодефицита снижается кровообращение во влагалище, прекращаются пролиферативные процессы в слизистой оболочке (отмечается уменьшение доли поверхностных и промежуточных клеток), разрушается коллаген, вагинальный эпителий истончается, влагалище теряет эластичность и развивается вульвовагинальная атрофия [5]. Проявления ГУМС не всегда сопоставимы с тяжестью объективных признаков урогенитальной атрофии [6], но вызывают серьезные психосоциальные расстройства и оказывают существенное негативное влияние на качество жизни женщины.
В настоящее время диагностика ГУМС осуществляется на основе анамнеза (опросники King’s Health Questionnaire — KHQ, The Day-to-Day Impact of Vaginal Aging — DIVA, The Female Sexual Function Index — FSFI), визуальной оценки слизистой оболочки влагалища (индекс вагинального здоровья — ИВЗ), кольповагино- и вульвоскопии, а также цитологического исследования с расчетом индекса созревания эпителия; в отдельных случаях по показаниям выполняют биопсию стенки влагалища с последующим гистологическим исследованием. Однако субъективные данные опросников, гинекологического осмотра и результаты лабораторных методов не всегда коррелируют между собой, что в свою очередь затрудняет персонализацию лечебных подходов и оптимизацию ведения больных с ГУМС [7]. К тому же с учетом схожей с другими патологическими состояниями симптоматики необходимо проводить дифференциальную диагностику, например с дисплазией влагалищного эпителия, раком влагалища. С этой целью для гистологического исследования и подтверждения диагноза необходимо проводить биопсию стенки влагалища. При этом процедура забора биопсийного материала может вызвать кровотечение и воспаление стенки влагалища, что способно усугубить имеющуюся симптоматику у женщин.
Указанные факторы обусловливают целесообразность поиска нового способа оценки морфологии влагалища, не уступающего по чувствительности и специфичности гистологическому исследованию, но менее инвазивного и позволяющего производить периодический мониторинг (например, при длительном неэффективном лечении). Исходя из анатомии органов женской репродуктивной системы представляется возможным осуществлять доступ к объекту изучения (влагалищу) с применением современных технологий оптической визуализации, например оптической когерентной томографии (ОКТ). Это неинвазивный метод, использующий оптическое излучение ближнего инфракрасного диапазона и позволяющий получать изображения тканей с высоким разрешением в режиме реального времени. Метод ОКТ еще называют «оптической биопсией», поскольку он достаточно точно отражает морфологию ткани на основе различий рассеивающих свойств разных ее компонентов [8].
Метод ОКТ уже был успешно применен в диагностике некоторых гинекологических состояний. На ex vivo образцах и in vivo методом ОКТ и эластографии проведена оценка состояния эндометрия: выявлены критерии, по которым можно определить условно нормальный эндометрий, гиперплазию и рак [9–11]. Метод ОКТ позволил отличить кожу вульвы в нормальном состоянии от кожи, пораженной склеротическим лихеном вульвы, красным плоским лишаем, а также оценить разную степень поражения in vivo, в том числе с использованием ОКТ-ангиографии и лимфангиографии [12–14]. При подозрении на неопластические процессы метод ОКТ используется для оценки состояния шейки матки [15, 16]. Имеются также сообщения об изучении упругих свойств стенки влагалища при пролапсе тазовых органов (передней и задней стенки влагалища) ex vivo [17, 18]. На основании результатов успешного опыта применения метода ОКТ в диагностике ряда гинекологических состояний было решено использовать этот метод для изучения состояния слизистой оболочки влагалища, в частности эпителия, при ГУМС.
Большим преимуществом метода ОКТ является удобство применения в амбулаторных условиях — без дополнительной подготовки пациентки, что значительно упрощает и ускоряет диагностику, а также исключает риски возможных инвазивных вмешательств.
Цель исследования — оценка возможности использования ОКТ в качестве объективного (количественного) диагностического подхода к прижизненному изучению влагалища для оценки состояния слизистой оболочки и выявления ранних и поздних признаков атрофических изменений при ГУМС.
Материалы и методы
Пациенты и методы исследования
Исследование слизистой оболочки влагалища проводили в клинике современных технологий «Садко» (Н. Новгород) с февраля по декабрь 2023 г. на условно здоровых лицах (n=3) и пациентах с клиническими проявлениями ГУМС (n=15). Критерии отбора участников: возраст от 45 до 70 лет (средний возраст — 56,7±1,4 года); наличие симптоматики ГУМС. Критерии исключения: менопаузальная гормональная терапия и локальная терапия препаратами эстриола, проводимая в сроки менее 3 мес до вступления в исследование; активные системные аутоиммунные процессы; поливалентная аллергия; острые воспалительные и онкологические заболевания; наличие декомпенсированного сахарного диабета, миомы матки больших размеров, гиперпластических процессов эндометрия, опухолей яичников, нелеченых инфекций, передаваемых половым путем.
Объектом исследования явились преддверие и верхний отдел влагалища. ОКТ проводили в двух симметричных точках (слева и справа) преддверия влагалища и одной точке в верхних отделах влагалища, так как данные области являются наиболее поражаемыми из-за высоких концентраций в тканях рецепторов эстрогенов [19, 20]. Биопсию выполняли однократно из правой точки преддверия влагалища (рис. 1).
|
Рис. 1. Изображение влагалища во фронтальной проекции Крестами обозначены точки ОКТ-исследования |
Для клинической оценки состояния влагалища в процессе гинекологического осмотра использовали вычисление ИВЗ по специальной шкале Бохмана [21]. Проводили измерение ряда параметров: наличие выделений, величина pH влагалища, эластичность стенки, степень увлажненности, состояние эпителия, — каждый из которых оценивали в баллах. Сумма этих баллов составляла величину ИВЗ. Этот тест дает представление о функционировании слизистой оболочки влагалища. Принято считать, что условно здоровое состояние эпителия отмечается при высоких баллах (от 20 до 25), 15–20 баллов — атрофия легкой степени, 15 баллов и ниже — тяжелые атрофические изменения слизистой оболочки стенки влагалища. Для уточнения состояния эпителия использовали кольповагиноскопию — метод визуальной оценки эпителиального слоя влагалищной стенки. Кольповагиноскопическими признаками атрофии являются бледный истонченный эпителий, наличие субэпителиальных сосудов, петехиальные кровоизлияния, контактные кровотечения, слабое окрашивание при пробе с раствором Люголя (интенсивность положительного окрашивания отражает содержание гликогена в эпителии). Данный метод позволяет быстро визуально подтвердить наличие атрофических изменений при ГУМС, однако результаты анализа теста и стратификации по степени тяжести поражения весьма относительны, что определяется опытом доктора, владением навыком проведения кольповагиноскопии и субъективизмом трактовки полученных результатов.
Несмотря на все сложности, распределение пациентов по группам относительно степени тяжести состояния атрофических изменений эпителия должно коррелировать с данными ИВЗ и кольповагиноскопии. Однако в качестве «золотого стандарта» оценки атрофических изменений в слизистой оболочке влагалищной стенки служит гистологическое исследование биоптата.
Все пациенты подписывали информированное согласие на участие в исследовании и проведение биопсии слизистой оболочки стенки влагалища. Исследование одобрено Этическим комитетом Приволжского исследовательского медицинского университета (протокол №4 от 14.03.2022 г.).
Система оптической когерентной томографии
Исследования слизистой оболочки влагалища in vivo осуществляли на ОКТ-системе «ОКТ 1300-Е» («БиоМедТех», Н. Новгород, Россия; рег. удостоверение ФСР 2012/13479). Эта система оснащена гибким волоконно-оптическим зондом, который заканчивается торцевым объективом «карандашного» типа (длина — 8 см, диаметр — 1 см) и предназначен для контактного исследования ткани. Надежная фиксация зонда относительно исследуемого объекта происходит за счет использования специального держателя. ОКТ-система работает на центральной длине волны 1310 нм с шириной спектра 100 нм. Скорость визуализации составляет 20 000 А-сканов/с, разрешение по глубине — 10 мкм, поперечное разрешение — 15 мкм. Система создает набор 3D-данных размером 3,40×3,40×1,25 мм3 в режиме реального времени при длительности сканирования 26 с.
Из 3D-набора данных в режиме реального времени строятся структурные ОКТ-изображения поперечного сечения — В-сканы (рис. 2).
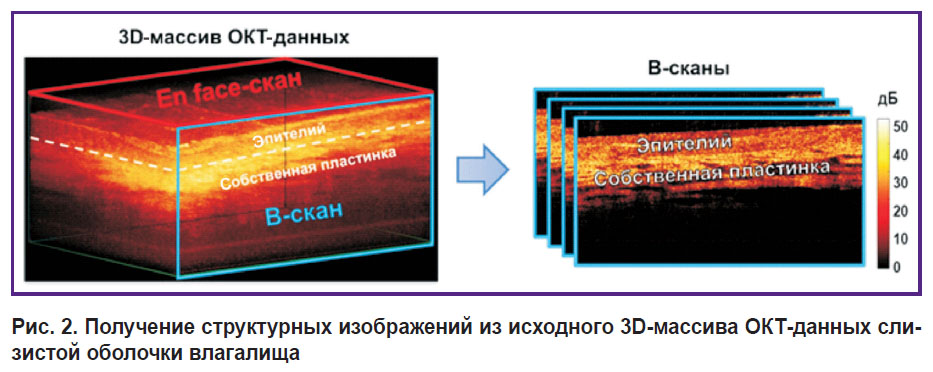
|
Рис. 2. Получение структурных изображений из исходного 3D-массива ОКТ-данных слизистой оболочки влагалища |
Анализ полученных ОКТ-данных
Анализ включал три этапа: 1) визуальный анализ структурных ОКТ-изображений для формулирования характерных для атрофии слизистой оболочки ОКТ-признаков; 2) количественная оценка толщины эпителия; 3) оценка интенсивности сигнала от эпителия и собственной пластинки слизистой оболочки, расчет индекса эпителиально-стромальной стратификации.
Толщину эпителия измеряли как длину отрезка от поверхности эпителия до перпендикулярной ей границы эпителия и собственной пластинки слизистой оболочки, затем рассчитывали среднее значение для девяти измерений. Далее выбирали три структурных изображения из 3D-массива (два крайних и центральный В-скан), на каждом из которых проводили три измерения. Для измерений использовали стандартные функции программы ImageJ (США).
Интенсивность ОКТ-сигнала в эпителии и собственной пластинке слизистой оболочки рассчитывали с помощью функции измерения среднего уровня серого по выделенной области программы ImageJ. При измерении интенсивности ОКТ-сигнала в собственной пластинке слизистой оболочки не учитывали щелевидные включения с низкой интенсивностью сигнала, которые соответствуют лимфатическим сосудам.
Индекс эпителиально-стромальной стратификации рассчитывали по формуле [22]:
Стратификация = I(э) – I(соб. пл.) / I(э) + I (соб. пл.),
где I — расчётная средняя интенсивность сигнала в эпителии (э) или собственной пластинке (соб. пл.).
Индекс стратификации позволяет оценить отношение уровня сигнала от эпителия к сигналу от собственной пластинки и принимает отрицательные значения в случае более высокого сигнала от собственной пластинки. Чем больше отклонения индекса от нуля (в положительную или отрицательную сторону), тем выше разность интенсивности сигналов и контрастность границы эпителия и собственной пластинки.
Гистологический анализ
Для интерпретации полученных ОКТ-изображений выполнена инцизионная биопсия под местной аппликационной анестезией (лидокаин 2%) сразу после ОКТ-исследования из правой точки преддверия влагалища. Резецированный образец помещали в гистологическую кассету с поролоновой подкладкой и погружали в 10% раствор забуференного формалина. Затем выполняли стандартную процедуру гистологической проводки и изготавливали гистологические препараты. Препараты окрашивали гематоксилином и эозином для оценки общей картины строения эпителия, собственной пластинки слизистой оболочки, соединительнотканных структур, для характеристики сосудистого компонента и компонентов воспалительного процесса. Трихромное окрашивание Пикро-Маллори выполняли для оценки состояния соединительной ткани (коллагеновые волокна окрашиваются в синий цвет, эластические волокна — от бледно-розового до желтого цвета). Проводили гистохимическую PAS-реакцию — для выявления гликогена в эпителии и исключения грибковых поражений (гликоген окрашивается в розово-красный цвет). Результаты были оцифрованы с применением системы визуализации EVOS M7000 (Thermo Fisher Scientific Inc., США) и детально описаны опытным патоморфологом. Толщину эпидермиса измеряли с помощью морфометрических функций программы ImageJ.
Статистический анализ
Статистический анализ выполнен в программе GraphPad Prism v. 9.0 (США). Количественные результаты представлены как медианное значение с 25-м и 75-м процентилями распределения (Me [Q1; Q3]). Проведена проверка на нормальное распределение с помощью критерия Шапиро–Уилка, которая продемонстрировала, что данные распределены не нормально. В связи с этим для статистической оценки использовали непараметрический критерий Манна–Уитни (для парных сравнений) и Краскела–Уоллиса (для множественных сравнений) с поправкой Бонферрони. Для расчета значения корреляции толщины эпителия слизистой оболочки влагалища, рассчитанной по данным ОКТ и гистологии, использован коэффициент корреляции Спирмена (r). Различия между группами считали статистически значимыми при p<0,05.
Результаты и обсуждение
Группа условной возрастной нормы
По результатам клинической оценки ИВЗ у пациенток составил 24 [24; 25] баллов, кольповагиноскопия признаков атрофии не выявила.
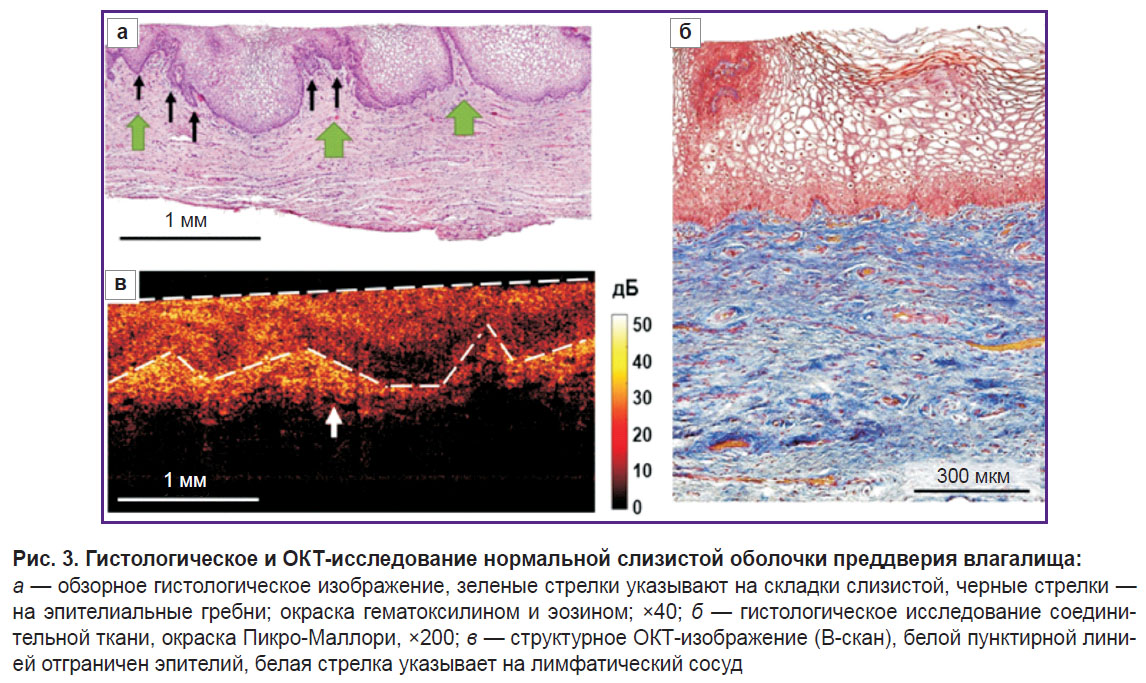
Гистологическое исследование демонстрирует многослойный гликогенированный неороговевающий плоский эпителий, состоящий из 40–50 слоев клеток, и подлежащую собственную пластинку слизистой оболочки, представленную соединительной тканью (рис. 3, а). Эпителий имеет гребни, вдающиеся в подслизистую основу, а подслизистая основа собрана в крупные складки. Собственная пластинка слизистой оболочки при окрашивании Пикро-Маллори состоит из тонких, рыхло расположенных коллагеновых пучков, ориентированных преимущественно параллельно эпителию (рис. 3, б). Наблюдаются умеренное полнокровие сосудов и слабая лимфоцитарная инфильтрация в собственной пластинке непосредственно под эпителием. PAS-реакция выявляет зерна гликогена в цитоплазме поверхностного и промежуточного слоев эпителия в виде непрерывного слоя.
Нормальная слизистая оболочка на структурных ОКТ-изображениях (рис. 3, в) имеет слоистое строение: первый (верхний) слой соответствует эпителию и характеризуется более низким уровнем ОКТ-сигнала; второй (нижний) слой является собственной пластинкой и обладает более высоким уровнем сигнала, так как содержит пучки коллагеновых волокон, которые обладают высоким рассеянием. Структурные ОКТ-изображения хорошо отражают границу эпителия и собственной пластинки, но не визуализируют эпителиальные гребни. Граница эпителиального слоя и подслизистой основы имеет волнообразную структуру (рис. 3, в, белый пунктир) за счет складок слизистой оболочки влагалища, которые образованы складками собственной пластинки. Поверхность первого слоя (эпителия) на В-сканах ровная, что обусловлено использованием контактного зонда. В собственной пластинке наблюдаются единичные продолговатые включения с низким уровнем ОКТ-сигнала, которые являются лимфатическими сосудами (3, в, белая стрелка).
Толщина эпителия на структурных ОКТ-изображениях равна 503 [467; 550] мкм. На гистологических изображениях она составляет 529 [462; 625] мкм. Полученные значения толщины эпителия на структурных ОКТ-изображениях сопоставимы со значениями его толщины на гистологических изображениях.
Структура слизистой оболочки стенки влагалища при атрофии
При сборе и анализе данных выявлено, что в группе пациентов с ГУМС наблюдается значительный разброс значений ИВЗ (от 5 до 19 баллов), выраженности клинических проявлений атрофии при кольповагиноскопии и значений толщины эпителия (от 100 до 400 мкм) по данным гистологического исследования. Кроме того, между вышеперечисленными параметрами отмечена высокая степень корреляции. С учетом этого мы разделили когорту пациентов на две группы: с атрофией легкой степени (n=7) и атрофией тяжелой степени (n=8).
У пациентов с атрофическими изменениями легкой степени ИВЗ составил 17 [16; 20] баллов, определяются легкие изменения по данным кольповагиноскопии (тонкий бледный эпителий, умеренное количество визуализируемых субэпителиальных сосудов, неравномерно слабое окрашивание при нанесении раствора Люголя).
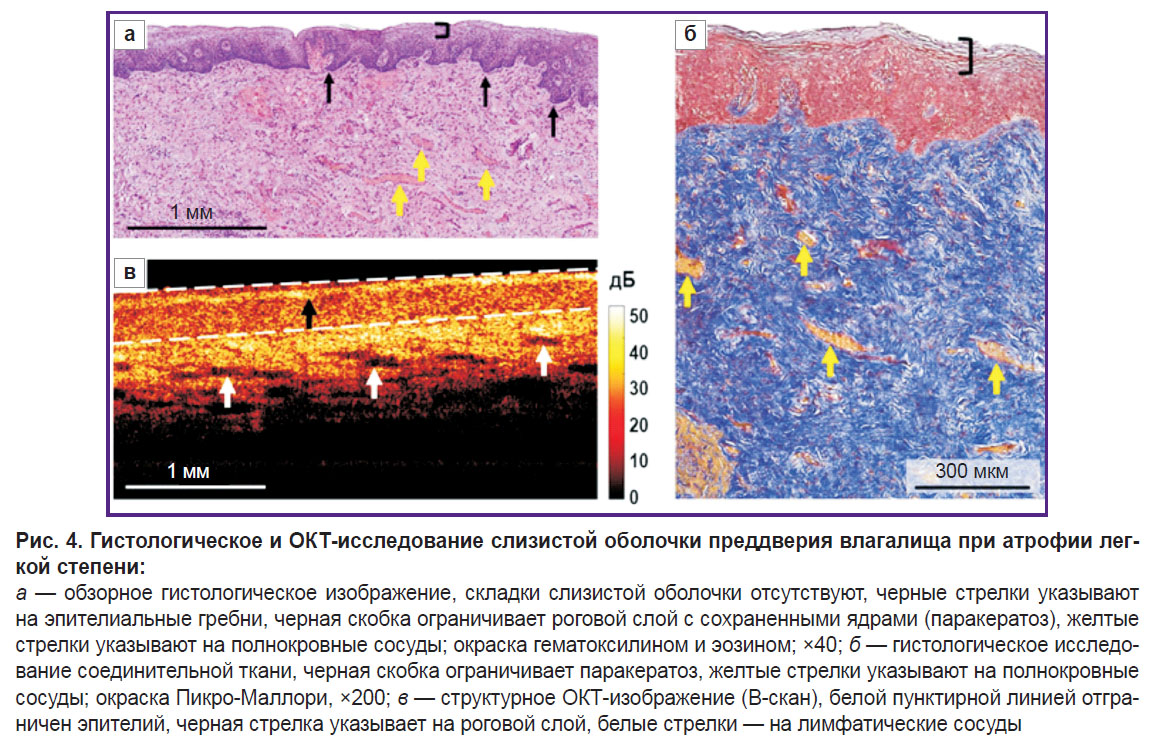
По результатам гистологического исследования (окрашивание гематоксилином и эозином) отмечается атрофия (истончение) эпителия за счет уменьшения слоев клеток до 20–25 и потери гликогена, на поверхности виден слой роговых клеток с сохраненными ядрами (паракератоз) (рис. 4, а). Количество эпителиальных сосочков снижено, складки собственной пластинки слизистой оболочки отсутствуют. Собственная пластинка при окрашивании Пикро-Маллори состоит из тонких, но плотно расположенных коллагеновых пучков, без преимущественной ориентации (рис. 4, б). Наблюдаются выраженное полнокровие сосудов и слабая лимфоцитарная инфильтрация в собственной пластинке. PAS-реакция выявляет зерна гликогена в цитоплазме промежуточного слоя в виде прерывистых участков.
Структурные ОКТ-изображения также позволяют хорошо детектировать слоистую структуру слизистой оболочки влагалища и границу эпителия и собственной пластинки (рис. 4, в). Эпителиальный слой лежит ровно, что связано с отсутствием складок влагалища, и имеет роговой слой с высоким уровнем сигнала (рис. 4, в, черная стрелка). Уровень сигнала от эпителия более высокий, чем в норме, что связано как с преждевременным созреванием эпителия и накоплением кератогиалина, так и со сниженным количеством гликогена. Наблюдается снижение толщины эпителия на всем протяжении пласта. Сигнал проникает в собственную пластинку более глубоко, так как не затухает в тонком эпителии. Уровень сигнала от соединительной ткани выше, чем в норме, что связано с более плотным и неупорядоченным расположением коллагеновых пучков. Наблюдаются множественные продолговатые включения с низким уровнем ОКТ-сигнала — лимфатические сосуды, которые при гистологическом исследовании выглядят спавшимися и плохо определяются. Выраженное полнокровие кровеносных сосудов позволяет сделать вывод о прижизненной активации лимфатического русла.
На гистологических изображениях толщина эпителия составляет 261 [244; 289] мкм, на структурных ОКТ-изображениях — 239 [237; 297] мкм. Это также свидетельствует о сопоставимости полученных значений толщины эпителия на гистологических и структурных ОКТ-изображениях.
При атрофии тяжелой степени ИВЗ составляет 7 [6; 11] баллов, определяются выраженные изменения по данным кольповагиноскопии (бледность слизистой оболочки, наличие множества субэпителиальных сосудов с петехиальными кровоизлияниями, контактная кровоточивость, слабое окрашивание раствором Люголя).
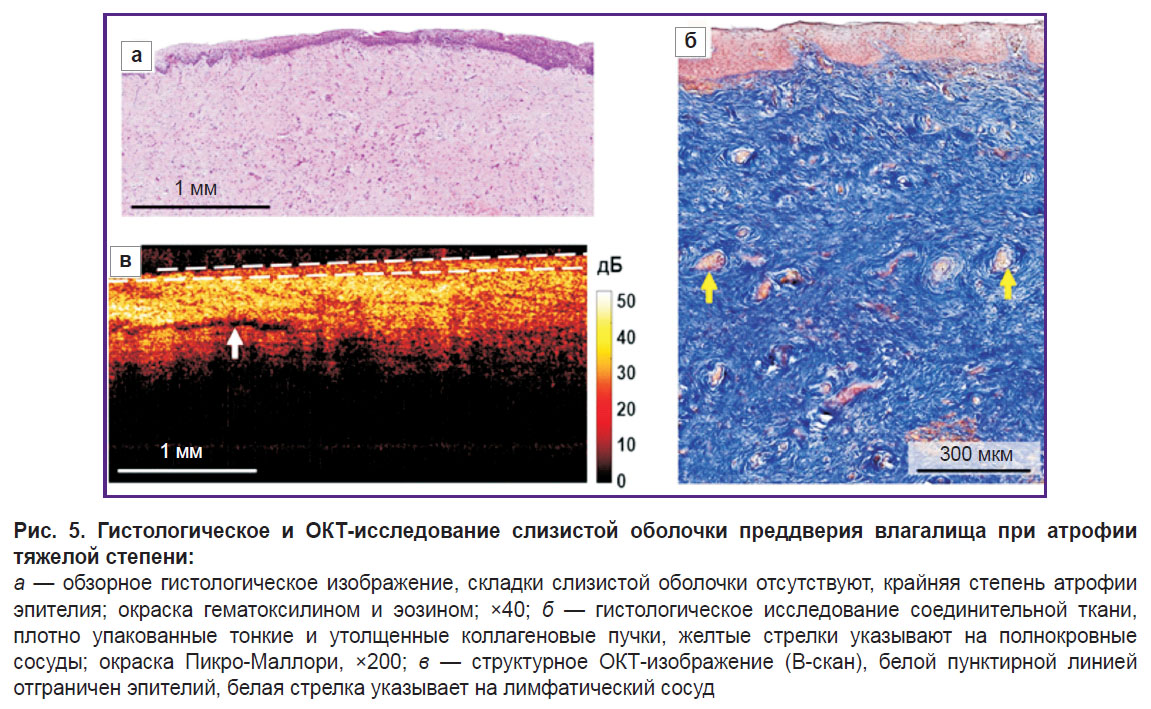
По данным гистологического исследования при окрашивании гематоксилином и эозином отмечается выраженная атрофия (истончение) эпителиального слоя за счет уменьшения количества клеточных слоев до 12–15, практически полной потери гликогена (рис. 5, а). Присутствует тонкий роговой слой. Эпителиальные гребни единичные, складки подслизистой основы отсутствуют. Собственная пластинка при окрашивании Пикро-Маллори состоит из тонких и утолщенных плотно расположенных коллагеновых пучков, без преимущественной ориентации (рис. 5, б). Наблюдаются полнокровие отдельных сосудов и слабая лимфоцитарная инфильтрация в собственной пластинке. PAS-реакция выявляет небольшое количество зерен гликогена в виде фокусов.
Структурные ОКТ-изображения также позволяют визуализировать слои влагалищной стенки, однако граница эпителия и собственной пластинки контрастирует хуже, чем при атрофии легкой степени (рис. 5, в). Это связано с повышенным уровнем сигнала от атрофичного, тонкого эпителия, бедного гликогеном и накапливающего кератогиалин. Сигнал проникает в собственную пластинку глубже, чем в норме, так как не затухает в тонком эпителии. Уровень сигнала от соединительной ткани выше, чем в норме, что связано с более плотным и неупорядоченным расположением коллагеновых пучков. В собственной пластинке наблюдаются единичные продолговатые включения с низким уровнем ОКТ-сигнала (лимфатические сосуды).
На структурных ОКТ-изображениях толщина эпителия составляет 158 [143; 191] мкм. На гистологических изображениях наблюдается резкое снижение толщины эпителия — до 140 [101; 168] мкм. Гистологические и ОКТ-данные также хорошо сопоставимы.
Все количественные и качественные ОКТ-признаки представлены в сводной таблице. Анализ полученных данных позволяет предложить использовать 4 критерия (3 количественных и 1 визуальный) для дифференциальной диагностики состояния слизистой оболочки влагалища: толщина эпителия, уровень ОКТ-сигнала от эпителия, уровень ОКТ-сигнала от собственной пластинки слизистой оболочки и наличие складок слизистой. Показатели индекса стратификации и контрастности границы эпителия и собственной пластинки слизистой оболочки не продемонстрировали статистической значимости.
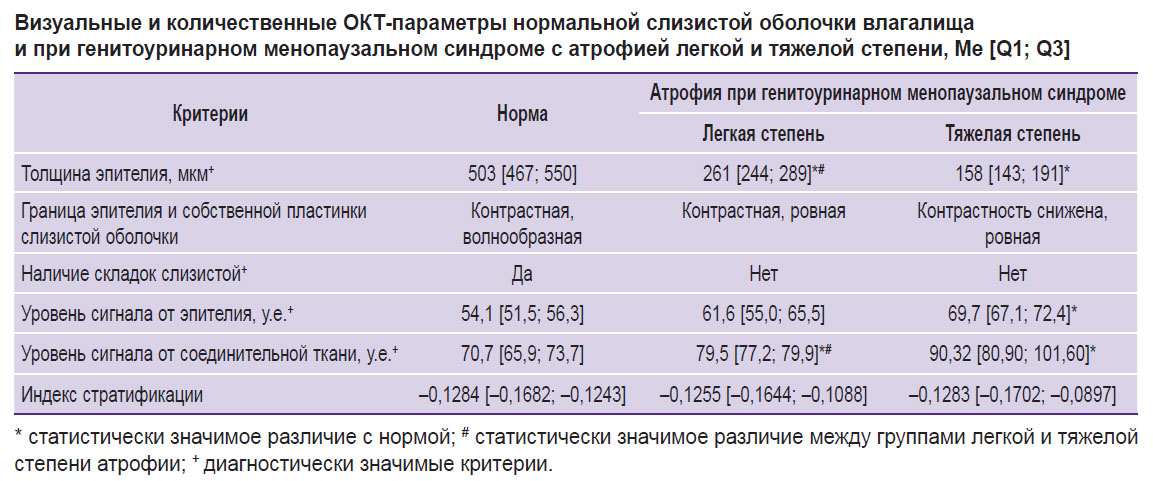
|
Визуальные и количественные ОКТ-параметры нормальной слизистой оболочки влагалища и при генитоуринарном менопаузальном синдроме с атрофией легкой и тяжелой степени, Me [Q1; Q3] |
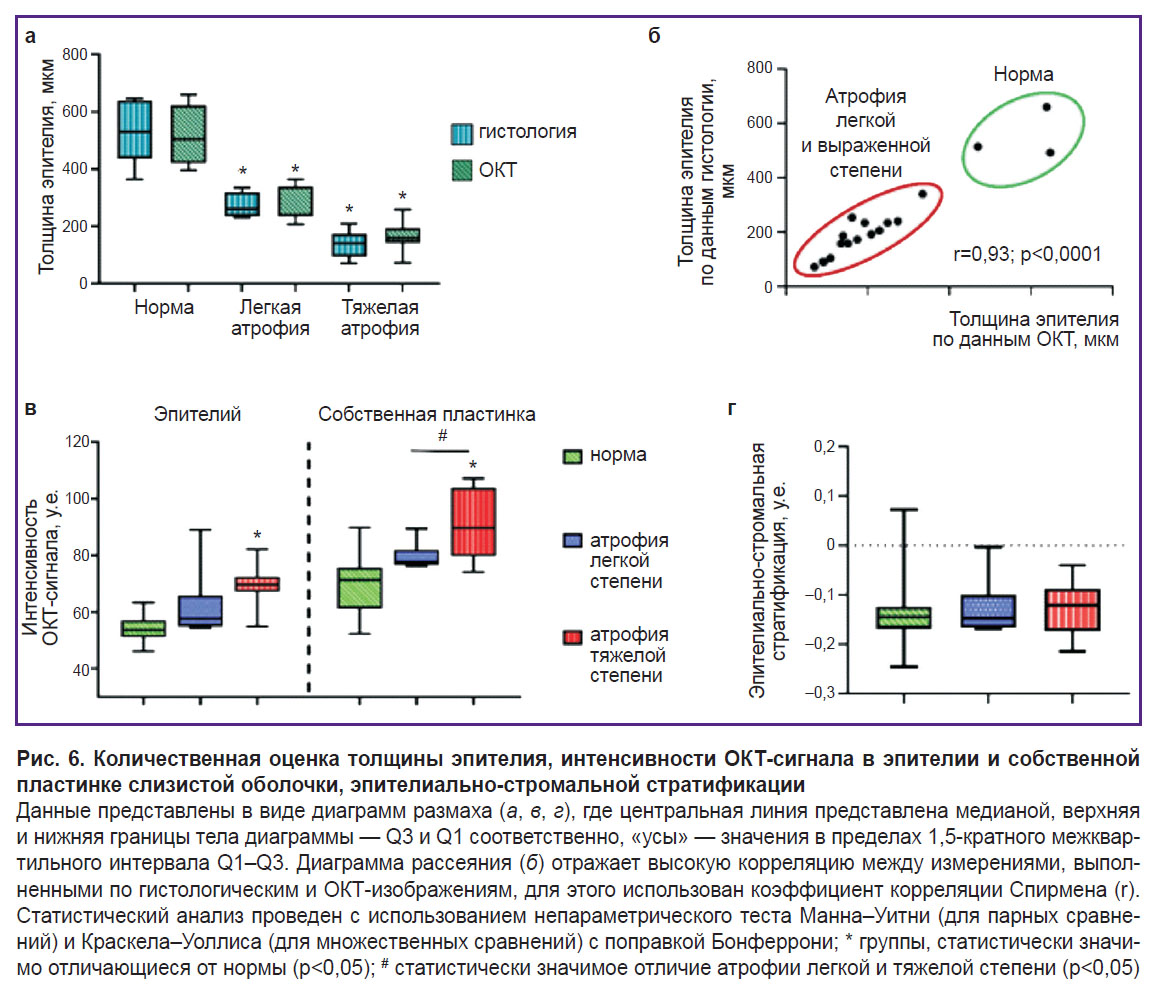
После обработки данных у лиц без патологии влагалища и пациентов с легкой и тяжелой атрофией получено статистически значимое различие показателей толщины эпителия, интенсивности ОКТ-сигнала от эпителия и собственной пластинки слизистой оболочки (рис. 6). Между группами с легкой и тяжелой атрофией наблюдалось статистически значимое различие только для показателей толщины эпителия, интенсивности ОКТ-сигнала от собственной пластинки. Индекс стратификации позволяет количественно оценить контрастность границы между эпителием и собственной пластинкой (стромой) стенки влагалища. Учитывая визуальное снижение контрастности границы при атрофии, мы предположили, что индекс в группах с атрофией будет изменяться. Однако расчёт эпителиально-стромальной стратификации (см. рис. 6) не продемонстрировал статистических различий между группами. Это связано с тем, что интенсивность сигнала как от эпителия, так и от собственной пластинки (стромы) при атрофии влагалища растет синхронно, что не приводит к смещению значений в какую-либо сторону, следовательно, стратификация не изменяется. Однако здесь следует иметь в виду малую выборку, что ограничивает возможность статистической оценки.
К настоящему времени в литературе уже опубликованы отчеты по исследованию слизистой оболочки влагалища методом ОКТ, однако они сосредоточены на описании технических устройств, способных получать ОКТ-массив данных на протяжении всего влагалища [23], или устройств, объединенных с фракционным СО2-лазером [24]. Пилотное исследование [19] описывает измерение толщины эпителия влагалища у пациентов с ГУМС до и после лечения фракционным СО2-лазером. Недостатком перечисленных исследований является отсутствие параллельного гистологического исследования и сравнительной интерпретации ОКТ-данных. Это сильно ограничивает медицинское значение данных работ, сводя их только к слепой оценке толщины эпителия.
В настоящей работе оценка ОКТ-структуры слизистой оболочки влагалища в норме и при ГУМС основывается на параллельном гистологическом исследовании, что позволило выявить четыре параметра, которые могут быть использованы для оценки атрофии. Установлено незначительное отклонение значений толщины эпителия по данным ОКТ от значений, измеренных по гистологическим препаратам (r=0,93). Впервые определены уровни сигнала от эпителия и стромы при ГУМС и в норме.
В настоящий момент в клинической практике диагностика атрофии влагалища при ГУМС осуществляется по анамнезу, визуальной оценке, ИВЗ, индексу созревания эпителия, кольповагиноскопии, однако современная медицина требует более объективной оценки состояния слизистой оболочки, особенно в случае исследования возможностей применения новых видов лечения, например неабляционных и фракционных лазеров [24], а также для персонализации терапии. Неинвазивная, быстрая и последовательная оценка структуры служит важным преимуществом ОКТ для оценки и сравнения эффективности разных методов лечения.
Снижение уровня эстрогена после менопаузы приводит к изменениям в соединительной ткани собственной пластинки слизистой оболочки, в мышечной оболочке, кровеносных сосудах, а также эпителии [25].
В данном исследовании сделан акцент на описании изменений эпителия как наиболее динамично изменяющегося и доступного для изучения. Впервые описана взаимосвязь уровня сигнала в эпителии от накопления гликогена внутри кератиноцитов. Гликоген играет ключевую роль в поддержании микрофлоры влагалища и оптимального уровня pH.
Нам удалось качественно и количественно описать изменения соединительной ткани и сосудистого русла. Так, исчезновение складок собственной пластинки наблюдается у пациентов с ГУМС как при гистологическом, так и при ОКТ-исследовании и служит одним из критериев, появляющихся уже при легкой атрофии. Изменение соединительной ткани, выраженное в увеличении плотности и толщины коллагеновых пучков в слизистой оболочке влагалища и в клиторе, было описано и ранее [25, 26]. Однако в нашем исследовании впервые продемонстрировано изменение интенсивности сигнала на структурных ОКТ-изображениях, связанное с изменениями соединительной ткани при ГУМС.
Выраженное полнокровие кровеносных сосудов при гистологическом исследовании и активацию лимфатического русла на ОКТ, наблюдаемые при атрофии легкой степени, можно объяснить венозным стазом. Однако, несмотря на выраженное вазоактивное действие эстрогена, которое стимулирует периферическое кровообращение путем снижения сосудистого тонуса [27], механизм развития венозного стаза в условиях дефицита эстрогена требует дальнейшего объяснения.
Метод ОКТ является уникальным инструментом, способным оценивать толщину эпителия влагалища и его состояние. Конкурирующий метод визуализации — высокочастотное ультразвуковое исследование (50 МГц) — обладает недостаточным разрешением для оценки вышеуказанных параметров [28], а такой высокоразрешающий метод, как отражательная конфокальная микроскопия, не может быть использован во влагалище ввиду отсутствия вагинальных зондов оптимального размера.
Недостатком данного исследования служит небольшая выборка лиц без патологии влагалища (n=3), это ограничение связано с отсутствием возможности проведения биопсии у здоровых женщин.
Заключение
Методом ОКТ получены структурные изображения (В-сканы) слизистой оболочки влагалища, охарактеризованы оптические свойства ткани в норме, при легкой и выраженной степени атрофических изменений слизистой оболочки в рамках генитоуринарного менопаузального синдрома. Определены 4 критерия, по которым можно дифференцировать генитоуринарный менопаузальный синдром и его стадии: толщина эпителия, уровень сигнала от эпителия и соединительной ткани, наличие эпителиальных складок. Установлено, что в норме толщина эпителия составляет 503 [467; 550] мкм, отмечена складчатость слизистой оболочки; уровень сигнала от эпителия составляет 54,1 [51,5; 56,3] у.е., а от соединительной ткани — 70,7 [65,9; 73,7] у.е. При атрофии легкой степени выявлены истончение эпителия до 261 [244; 289] мкм и отсутствие складок слизистой оболочки, а уровни сигнала от эпителия и соединительной ткани составляют 61,6 [55,0; 65,5] и 79,5 [77,2; 79,9] у.е. соответственно. При тяжелой атрофии отмечено резкое истончение слизистой оболочки — 158 [143; 191] мкм и также отсутствие складок, а уровни сигнала от эпителия и соединительной ткани составляют 69,7 [67,1; 72,4] и 90,32 [80,90; 101,60] у.е. соответственно. При атрофии наблюдаются потеря гликогена и накопление кератогиалина, в связи с чем уровень сигнала от эпителия увеличивается. Кроме того, происходит усиление сигнала в соединительной ткани в результате более плотного и неупорядоченного расположения коллагеновых волокон.
Благодаря возможности прижизненной и полностью неинвазивной оценки состояния эпителия и соединительной ткани, а также высокой скорости (практически в режиме реального времени) ОКТ-сканирования появилась возможность контроля за динамическими изменениями ткани в процессе терапии и индивидуального подбора способа лечения.
Финансирование исследования. Отсутствует.
Конфликт интересов. Авторы заявляют об отсутствии возможных конфликтов интересов.
Литература
- Briggs P. Genitourinary syndrome of menopause. Post Reprod Health 2020; 26(2): 111–114, https://doi.org/10.1177/2053369119884144.
- Moral E., Delgado J.L., Carmona F., Caballero B., Guillán C., González P.M., Suárez-Almarza J., Velasco-Ortega S., Nieto C.; as the writing group of the GENISSE study Genitourinary syndrome of menopause. Prevalence and quality of life in Spanish postmenopausal women. The GENISSE study. Climacteric 2018; 21(2): 167–173, https://doi.org/10.1080/13697137.2017.1421921.
- Florian M., Lu Y., Angle M., Magder S. Estrogen induced changes in Akt-dependent activation of endothelial nitric oxide synthase and vasodilation. Steroids 2004; 69(10): 637–645, https://doi.org/10.1016/j.steroids.2004.05.016.
- Копылова И.В., Сысоева В.Ю., Глыбина Т.М., Карева М.А. Экспрессия эстрогеновых и андрогеновых рецепторов в тканях наружных половых органов у девочек с врожденной дисфункцией коры надпочечников. Проблемы эндокринологии 2014; 60(6): 14–20, https://doi.org/10.14341/probl201460614-20.
- Роговская С.И., Липовая Е.В. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция. М: StatusPraesens; 2016; 832 с.
- Зиганшина Л.З., Муслимова С.Ю., Сахаутдинова И.В., Зулкарнеева Э.М. Симптомы и клиника постменопаузальной вульвовагинальной атрофии в различные стадии постменопаузы. Гинекология 2023; 25(2): 153–157, https://doi.org/10.26442/20795696.2023.2.202132.
- Phillips N.A., Bachmann G.A. The genitourinary syndrome of menopause. Menopause 2021; 28(5): 579–588, https://doi.org/10.1097/GME.0000000000001728.
- Gelikonov V.M. Gelikonov G.V. New approach to cross-polarized optical coherence tomography based on orthogonal arbitrarily polarized modes. Laser Physics Letters 2006; 3(9): 445–451, https://doi.org/10.1002/lapl.200610030.
- Гречканев Г.О., Плеханов А.А., Логинова М.М., Аветисян Е.А., Шепелева А.А., Зайцева А.М., Ушанова А.А., Гамаюнов С.В., Сироткина М.А., Зайцев В.Ю., Никишов Н.Н., Гладкова Н.Д. Первый опыт использования мультимодальной оптической когерентной томографии для диагностики гиперпластических процессов в эндометрии. Российский вестник акушера-гинеколога 2023; 23(5): 66–72.
- Логинова М.М., Плеханов А.А., Губарькова Е.В., Гречканев Г.О., Аветисян Е.А., Советский А.А., Зайцев В.Ю., Гамаюнов С.В., Гладкова Н.Д., Сироткина М.А. Исследование упругих свойств ткани эндометрия при гиперпластических и неопластических процессах с помощью оптической когерентной эластографии. В кн.: Сборник научных трудов VII съезда биофизиков России; Краснодар; 2023; с. 202.
- Kirillin M., Motovilova T., Shakhova N. Optical coherence tomography in gynecology: a narrative review. J Biomed Opt 2017; 22(12): 1–9, https://doi.org/10.1117/1.JBO.22.12.121709.
- Потапов А.Л., Коновалова Е.А., Сироткина М.А., Вагапова Н.Н., Сафонов И.К., Тимакова А.А., Раденска-Лоповок С.Г., Кузнецов С.С., Загайнова Е.В., Кузнецова И.А., Гладкова Н.Д. Новый метод мультимодальной оптической когерентной томографии для диагностики склеротического лихена вульвы. Акушерство и гинекология 2020; 12: 169–176, https://doi.org/10.18565/aig.2020.12.169-176.
- Potapov A.L., Loginova M.M., Moiseev A.A., Radenska-Lopovok S.G., Kuznetsov S.S., Kuznetsova I.A., Mustafina N.N., Safonov I.K., Gladkova N.D., Sirotkina M.A. Cross-polarization optical coherence tomography for clinical evaluation of dermal lesion degrees in vulvar lichen sclerosus. Sovremennye tehnologii v medicine 2023; 15(1): 53, https://doi.org/10.17691/stm2023.15.1.06.
- Sirotkina M.A., Potapov A.L., Vagapova N.N., Safonov I.K., Karashtin D.A., Matveev L.A., Radenska-Lopovok S.G., Timakova A.A., Kuznetsov S.S., Zagaynova E.V., Kuznetsova I.A., Gladkova N.D. Multimodal optical coherence tomography: imaging of blood and lymphatic vessels of the vulva. Sovremennye tehnologii v medicine 2019; 11(4): 26, https://doi.org/10.17691/stm2019.11.4.03.
- Escobar P.F., Belinson J.L., White A., Shakhova N.M., Feldchtein F.I., Kareta M.V., Gladkova N.D. Diagnostic efficacy of optical coherence tomography in the management of preinvasive and invasive cancer of uterine cervix and vulva. Int J Gynecol Cancer 2004; 14(3): 470–474, https://doi.org/10.1111/j.1048-891x.2004.14307.x.
- Kuznetsova I.A. Optimization of the neck of the uterus neoplasia diagnosis using optical coherent tomography. Sovremennye tehnologii v medicine 2011; (1): 72.
- Gubarkova E., Potapov A., Moiseev A., Kiseleva E., Krupinova D., Shatilova K., Karabut M., Khlopkov A., Loginova M., Radenska-Lopovok S., Gelikonov G., Grechkanev G., Gladkova N., Sirotkina M. Depth-resolved attenuation mapping of the vaginal wall under prolapse and after laser treatment using cross-polarization optical coherence tomography: a pilot study. Diagnostics (Basel) 2023; 13(22): 3487, https://doi.org/10.3390/diagnostics13223487.
- Gubarkova E., Potapov A., Krupinova D., Shatilova K., Karabut M., Khlopkov A., Loginova M., Sovetsky A., Zaitsev V., Radenska-Lopovok S., Gladkova N., Grechkanev G., Sirotkina M. Compression optical coherence elastography for assessing elasticity of the vaginal wall under prolapse after neodymium laser treatment. Photonics 2023; 10(1): 6, https://doi.org/10.3390/photonics10010006.
- Miao Y., Sudol N.T., Li Y., Chen J.J., Arthur R.A., Qiu S., Jiang Y., Tadir Y., Lane F., Chen Z. Optical coherence tomography evaluation of vaginal epithelial thickness during CO2 laser treatment: a pilot study. J Biophotonics 2022; 15(11): e202200052, https://doi.org/10.1002/jbio.202200052.
- Isaza P.G. Use of growth factors for vulvo/vaginal bio-stimulation. Surg Technol Int 2019; 34: 269–273.
- Bachmann G.A., Notelovitz M., Kelly S.J., Thompson C., Owens A. Long-term non-hоrmоnаl treatment of vaginal dryness. Clin Рrасt Sexualitv 1992; 8: 3–8.
- Hill C., Malone J., Liu K., Ng S.P., MacAulay C., Poh C., Lane P. Three-dimension epithelial segmentation in optical coherence tomography of the oral cavity using deep learning. Cancers (Basel) 2024; 16(11): 2144, https://doi.org/10.3390/cancers16112144.
- Li Y., Sudol N.T., Miao Y., Jing J.C., Zhu J., Lane F., Chen Z. 1.7 micron optical coherence tomography for vaginal tissue characterization in vivo. Lasers Surg Med 2019; 51(2): 120–126, https://doi.org/10.1002/lsm.23003.
- Qiu S., Arthur A., Jiang Y., Miao Y., Li Y., Wang J., Tadir Y., Lane F., Chen Z. OCT angiography in the monitoring of vaginal health. APL Bioeng 2023; 7(4): 046112, https://doi.org/10.1063/5.0153461.
- Sarmento A.C.A., Costa A.P.F., Vieira-Baptista P., Giraldo P.C., Eleutério J. Jr, Gonçalves A.K. Genitourinary syndrome of menopause: epidemiology, physiopathology, clinical manifestation and diagnostic. Front Reprod Health 2021; 3: 779398, https://doi.org/10.3389/frph.2021.779398.
- Szymański J.K., Słabuszewska-Jóźwiak A., Jakiel G. Vaginal aging-what we know and what we do not know. Int J Environ Res Public Health 2021; 18(9): 4935, https://doi.org/10.3390/ijerph18094935.
- Miller V.M., Duckles S.P. Vascular actions of estrogens: functional implications. Pharmacol Rev 2008; 60(2): 210–241, https://doi.org/10.1124/pr.107.08002.
- Migda M.S., Migda M., Słapa R., Mlosek R.K., Migda B. The use of high-frequency ultrasonography in the assessment of selected female reproductive structures: the vulva, vagina and cervix. J Ultrason 2019; 19(79): 261–268, https://doi.org/10.15557/JoU.2019.0039.