Корреляционный анализ тяжести доменов симптомов острого психоза и фракционной анизотропии трактов белого вещества головного мозга при шизофрении
Проведен анализ трактов белого вещества головного мозга (коннектомов) у пациентов с шизофренией, состояние которых определяли в парадигме дименсионального подхода.
Цель исследования — изучение связности регионов головного мозга в зависимости от тяжести клинической картины психоза при шизофрении.
Материалы и методы. 46 пациентов (22 женщины и 24 мужчины; средний возраст 26,5±5,3 года) с диагнозом шизофрении обследовали в период становления ремиссии после первого психотического эпизода. Тяжесть состояния определяли по баллам психометрических шкал PANSS, CRDPSS, BFCRS, NSA-4, FAB. Диффузионно-тензорную магнитно-резонансную томографию головного мозга выполняли с использованием 3Т МРТ Magnetom Verio (Siemens Healthineers, Германия). Расчет значимых связей между показателями обобщенной фракционной анизотропии проводящих путей мозга и тяжестью клинической картины психоза проводили на основе коэффициента ранговой корреляции Спирмена.
Результаты. Для каждого домена симптоматики были определены свои структурные особенности коннектома головного мозга, коррелирующие с тяжестью симптома. Помимо этого были визуализированы тракты, изменения в которых ассоциируются с тяжестью сразу нескольких доменов симптомов. Изменения в трактах фронтально-теменной и околообонятельной части поясного пучка правого полушария коррелируют с тяжестью проявления галлюцинаторной, негативной и кататонической симптоматики. Изменения в трактах левой фронтально-парагиппокампальной части поясного пучка отрицательно коррелируют со степенью тяжести галлюцинации и бреда, а правой фронтально-парагиппокампальной части — с тяжестью бреда и кататонии. В случаях тяжелой степени галлюцинаций, бредовых расстройств и дезорганизации наиболее значимые изменения проявляются в структурах трактов свода левого и правого полушарий. Значимые изменения в проводящих путях мозолистого тела коррелируют с выраженностью тяжести симптомов кататонии и негативной симптоматикой. Тяжесть проявления различных доменов психоза ассоциируется с различиями в структурной организации трактов головного мозга.
Заключение. Получены новые данные о возможной дифференциальной вовлеченности мозговых структур в патогенез разнообразных проявлений шизофрении, таких как галлюцинации, бред, явления дезорганизации, кататония и негативные расстройства, которые можно рассматривать в качестве объективных нейрофизиологических маркеров данного заболевания.
Введение
В качестве ключевых звеньев патогенеза шизофрении и других первичных психотических расстройств выступают нарушения структуры и функций отдельных регионов головного мозга, значимость которых подытожена в нескольких метаанализах по результатам нейровизуализационных исследований [1–3].
Симптомы шизофрении могут объединяться в домены (дименсии), которые присутствуют в разных формах психотических расстройств, а также сосуществовать у одного и того же пациента в различных качественных и/или количественных сочетаниях [4]. Отдельные клинические домены включают позитивные расстройства или искажение восприятия реальности (бред и галлюцинации), негативные расстройства (абулия/апатия, ангедония, асоциальность и снижение выразительности эмоций), психомоторные нарушения (в виде кататонических феноменов), а также когнитивные и аффективные нарушения и явления дезорганизации (в том числе формальные расстройства мышления).
Несмотря на продолжающиеся дискуссии относительно количества облигатных дименсий (речь идет о двух- [5], трех- [6], пяти- [7] и мультифакторных характеристиках, включающих и социально-психологические аспекты [8] изучения шизофрении), дименсиональное объединение симптомов представляется наиболее адекватным для решения исследовательских задач [9], в частности изучения особенностей связности и целостности белого вещества головного мозга между отдельными зонами.
С точки зрения структурно-функциональных изменений головного мозга как субстрата развития заболевания особый интерес представляют аберрации структурного коннектома, определяющего вероятностную связность нейросетей головного мозга и, следовательно, степень функциональной кооперации нейросетей в когнитивных процессах [10]. Архитектуру структурного коннектома можно оценить с помощью метода диффузионно-тензорной магнитно-резонансной трактографии, измеряющего характеристики фракционной анизотропии диффузии молекул воды в объеме головного мозга [11].
Анализ современной литературы, посвященной результатам нейровизуализационных, в частности трактографических исследований шизофрении, показал, что работы, как правило, проводятся в двух направлениях. Одно из них включает поиск специфических изменений в структуре и функционировании нейросетей головного мозга на разных стадиях прогрессирования заболевания шизофренией. Так, выявлены аберрации в структурном коннектоме белого вещества, характерные, например, для различных стадий шизофрении — от продромальной, или стадии высокого риска психоза, до стадии формирования ремиссии после психоза [12, 13]. Второе направление — определение особенностей в структурно-функциональной организации нейросетей головного мозга, задействованных в развитии отдельных синдромов заболевания шизофренией. Одним из самых воспроизводимых результатов [1, 3, 14–16] является выявление отклонений во фронтальных и височно-теменных отделах, включая аберрации не только трактов (дугообразный пучок (arcuate tract), мозолистое тело (corpus callosum), верхний и нижний продольный пучок (superior and inferior longitudinal tract)), но и морфометрических (анатомических) и функциональных характеристик мозга при слуховых вербальных галлюцинациях (например, ERC “VOICE” project [17]). При этом было отмечено, что наблюдаемые при заболевании шизофренией особенности в структурах головного мозга аналогично могут встречаться в разных комбинациях и разной степени выраженности у пациентов с непсихотическими расстройствами и у лиц из группы здорового контроля. Отчасти это прослеживается в обширной гетерогенности клинической картины психозов, опосредованной гетерогенностью структурной организации головного мозга, и в возможности персистирования симптоматики с континуальностью степени и ее выраженности от крайне тяжелых форм до персистирования на подпороговом уровне [18–19].
При поиске нейровизуалиционных маркеров заболевания шизофренией целесообразно выстраивать парадигму исследования с учетом не только дименсиональной структуры заболевания, но и континуальной гетерогенности тяжести симптомов/групп симптомов внутри дименсиональной структуры, так как резонно полагать, что для каждого домена (дименсии) существуют высокоспецифические нейробиологические корреляты или маркеры с высокой диагностической или прогностической ценностью.
В таком ключе выполнено исследование M.H.A. Bopp с соавт. [20], в ходе которого авторы провели корреляционный анализ показателей фракционной анизотропии (FA) трактов и степени тяжести психопатологических доменов при сравнении результатов диффузионно-тензорной визуализации (DTI) 26 пациентов с шизофренией и 26 испытуемых из группы здорового контроля. Авторами обнаружено изменение FA в девяти трактах белого вещества, которое в значительной мере коррелирует с отдельными доменами психопатологии, измеренными с помощью шкал SAPS/SANS (Scale for the Assessment of Positive Symptoms и Scale for the Assessment of Negative Symptoms). Тяжесть симптома галлюцинаций положительно коррелировала с показателем FA в левом крючковидном пучке (uncinate fasciculus) и левом кортикоспинальном тракте (left corticospinal tract). Фактор диссоциативного расстройства (феномен пассивности) показал положительную корреляцию с показателем FA тракта правой части передней таламо-кортикальной лучистости (right anterior thalamocortical radiations). Показатель степени тяжести дименсии дезорганизации мышления отрицательно коррелировал со значением FA в поясном пучке (cingulum) правого полушария. Степень негативных расстройств прямо коррелировала с изменением показателя FA в правой части передней таламической лучистости и обратно коррелировала с правым вентральным пучком поясной извилины (right ventral cingulum bundle) [20].
Согласно сформулированной нами гипотезе, существует корреляция между степенью тяжести отдельных групп доменов симптоматики и изменениями в структурной организации трактов белого вещества, связующих патогенетически значимые для этих доменов регионы головного мозга. Для проверки данной гипотезы одна и та же выборка пациентов проходила ранжирование с выделением континуальной гетерогенности по степени тяжести доменов симптоматики шизофрении.
Целью исследования стал корреляционный анализ между локальными показателями обобщенной фракционной анизотропии (GFA) трактов белого вещества головного мозга и континуально гетерогенной тяжестью симптоматики по основным психопатологическим доменам, включая галлюцинации, бред, явления дезорганизации, кататонию и негативные расстройства.
Материалы и методы
Пациенты
Обследовано 46 пациентов (22 женщины и 24 мужчины; средний возраст — 26,5±5,3 года) из числа госпитализированных в острые отделения Психиатрической клинической больницы №1 им. Н.А. Алексеева в 2018–2019 гг. Все испытуемые дали письменное информированное согласие после полного описания процедур исследования согласно Хельсинкской декларации (2024). Результаты настоящей работы являются частью исследовательской программы «Молекулярные и нейрофизиологические маркеры эндогенных заболеваний», проводимой в Психиатрической клинической больнице №1 им. Н.А. Алексеева и одобренной Независимым междисциплинарным комитетом по этической экспертизе клинических исследований от 14 июля 2017 г. (протокол №12).
Критерии включения: возраст от 21 до 35 лет, соответствие состояния критериям шизофрении (F20) по МКБ-10 (Международная классификация болезней) и DSM-5 (Diagnostic and Statistical Manual of mental disorders), праворукость, критика своего состояния с сохранением памяти о психотических симптомах, информированное согласие на участие в исследовании. Критерии исключения: шизоаффективные и аффективные расстройства, органические заболевания головного мозга, тяжелые соматические и/или неврологические состояния, потенциально влияющие на физиологию или структуру мозга, признаки злоупотребления психоактивными веществами и общие противопоказания для проведения магнитно-резонансной томографии (МРТ).
Клиническое обследование осуществлялось двумя опытными психиатрами с привлечением всех необходимых данных (опрос родственников, анализ медицинских карт, результаты физикальных и лабораторных тестов и т.д.).
Клиническое ранжирование по степени тяжести доменов симптоматики шизофрении выполняли по результатамклинического интервью и после оценки состояния пациентов с помощью психометрического инструментария в связи с тем, что клиническая картина и динамика психотических расстройств хотя и соответствовали критериям шизофрении, демонстрировали различные психопатологические домены различной степени тяжести. Так, выраженность галлюцинаций у пациентов варьировала от отдельных звуковых артефактов до императивных или угрожающих голосов. Бредовой синдром в части случаев проявлялся персекуторными идеями с фабулой из обыденной жизни (отравления, ревности, ущерба), а в других — отражал причудливое искажение мышления с фантастическими фабулами (мессианства, воздействия потусторонних сил или способности «построения межгалактических фракталов»). Кроме того, в состоянии острого психоза пациенты не одинаково были доступны контакту вследствие наличия кататонической симптоматики либо транзиторной утраты когнитивных функций.
Помимо метода клинического интервью применяли диагностический инструментарий: Шкалу позитивных и негативных симптомов (Positive and Negative Syndrome Scale, PANSS); шкалу Клинических габаритов тяжести психотических симптомов, установленную в DSM-5 (Clinician-Rated Dimensions of Psychosis Symptom Severity, CRDPSS); инструмент оценки негативных симптомов из 4 пунктов (4-Item Negative Symptom Assessment, NSA-4); шкалу кататонии Буша–Франциса (Bush–Francis Catatonia Rating Scale, BFCRS); батарею тестов лобной дисфункции (Frontal Assessment Battery, FAB).
Построение модели континуальной гетерогенности галлюцинаций основывалось на баллах критерия PANSS-Р3 и CRDPSS-hal. Среди пациентов обследованной выборки идентифицированы слуховые галлюцинации (расстройств восприятия других модальностей не выявлено), при этом тяжелая форма (PANSS-Р3 — 5–6 баллов, CRDPSS-hal — 3–4 балла) отмечена у 17 пациентов, средняя (PANSS-Р3 — 4 балла, CRDPSS-hal — 2 балла) — у 14, у оставшихся 15 наличие галлюцинаций было сомнительным (PANSS-P — 2–3 балла, CRDPSS-hal — 1 балл). Такое распределение соответствует как эпидемиологическим данным о распространенности слуховых галлюцинаций в диапазоне 60–80% среди пациентов с шизофренией [21], так и их гетерогенной степени проявления — от элементарных акустических артефактов до сложных предложений с семантическим содержанием, таким как «голоса внутри головы», в самой тяжелой степени принимающим императивный или угрожающий характер [21]. В работе проводилось исследование корреляции показателя GFA с баллами по шкале CRDPSS.
Ранжирование тяжести бреда выполняли на основании оценки пунктов PANSS-P1 и CRDPSS-delusion. Бредовые расстройства среди пациентов распределялись следующим образом: у 35 человек диагностированы тяжелая и умеренная формы с наличием нескольких систематизированных устойчивых идей с причудливыми фабулами, приводящих к дезадаптивному поведению (PANSS-Р1 — 4–6 баллов, CRDPSS-del — 3–4 балла); у 11 пациентов бредовые расстройства были выражены слабо (PANSS-Р1 — 2–3 балла и CRDPSS-del — 0–2 балла) либо определялись на подпороговом уровне (одна несистематизированная идея с фабулой обыденной жизни). Такое распределение также соответствует данным эпидемиологии бредовых расстройств при шизофрении, согласно которым этот домен встречается у 70% пациентов с шизофренией и является одним из ключевых диагностических критериев [22]. В работе проводилось исследование корреляции показателя GFA с баллами по шкале PANSS-Р1.
Тяжесть дезорганизации мышления определяли в соответствии с одноименными пунктами PANSS-P2, CRDPSS-dezorg, а также с помощью батареи тестов лобной дисфункции FAB. Тяжелые явления дезорганизации (PANSS-Р2 — 5–7 баллов, CRDPSS-dez — 3–4 балла, FAB <12 баллов) выявлены у 22 пациентов; в остальных 24 случаях отмечался континуум от средней степени выраженности до подпороговых значений, что укладывается в приводимый в литературе широчайший диапазон доли диагностики этого домена — от 5 до 91% психозов [23]. Для корреляционного анализа с показателем GFA был выбран суммарный показатель проведенных тестов по шкале FAB.
Континуум кататонических психомоторных аномалий строили на основании критериев CRDPSS-psychomotor и суммы баллов BFCRS. Диагностика кататонии имеет свои особенности. Установлено, что с помощью метода клинической беседы кататония диагностируется у 5–10% пациентов [24], тогда как оценка статуса с помощью психометрических инструментов увеличивает этот показатель до 20–43% [25]. Такое замечание применимо и к результатам настоящего исследования. Тяжелые симптомы кататонии (PANSS-G5 — 5–7 баллов, CRDPSS-psychomotor >3 баллов, BFCRS >10 баллов) выявлены у 16 пациентов; в остальных 30 случаях наблюдались единичные эпизодические феномены на подпороговом уровне. В работе проводилось исследование корреляции показателя GFA с суммарными баллами теста BFCRS.
Выраженность негативной симптоматики оценивали, опираясь на объективные данные, полученные от близких пациентам людей и из медицинской документации с глубиной ретроспекции до одного года, для исключения феноменологических пересечений с депрессивной симптоматикой или явлениями нейролепсии. При этом сопоставляли результаты диагностики по трем критериям — сумме всех баллов PANSS-N, габарита CRDPSS-negative и опросника NSA-4. Согласно результатам двух крупных эпидемиологических перекрестных исследований [26, 27], в 50% наблюдений обнаруживается хотя бы один негативный симптом. По нашим данным, у 22 пациентов определялась умеренная степень тяжести негативной симптоматики (суммарный балл PANSS-N >30 баллов, по критерию CRDPSS-negative >3 балла, NSA-4 >15 баллов) с учетом ретроспекции оценки состояния глубиной в один год, предшествовавший манифестации настоящего психоза. В остальных случаях негативные расстройства представлены на легком или сомнительном уровне. Для корреляционного анализа с показателем GFA был взят суммарный показатель проведенных тестов по шкале NSA-4.
Таким образом, для корреляционного анализа сформировано пять ранжированных выборок на одной и той же группе испытуемых, которые отражали континуальную гетерогенность тяжести соответствующей дименсии: галлюцинации, бред, дезорганизация мышления, кататония, негативная симптоматика.
МРТ-сканирование
Оборудование. Исследование проводилось в Национальном исследовательском центре «Курчатовский институт» на магнитно-резонансном томографе напряженностью магнитного поля 3 Т (Magnetom Verio; Siemens Healthineers, Германия). Для анализа получен набор данных: структурные трехмерные Т1-взвешенные изображения в сагиттальной плоскости (количество срезов — 176, время повторения — 2530 мс, время эха — 3.31 мс, толщина срезов — 1 мм, угол отклонения — 7°, время инверсии — 1200 мс, поле обзора FOV — 256×256 мм2), два набора данных диффузионной МРТ с 64 направлениями диффузионно-кодирующих градиентов с противоположными направлениями фазового кодирования (b-фактор — 1500 с/мм2, количество срезов — 64, время повторения — 13 700 мс, время эха — 101 мс, толщина срезов — 2 мм, угол отклонения — 90° и поле обзора FOV — 240×240 мм2).
Предобработка данных диффузионной МРТ. Диффузионные данные из формата DICOM конвертировали в формат NIfTI. Далее с помощью модуля topup в программе FSL (https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/FSL) проводили коррекцию артефактов искажений диффузионных данных: оценивали искажения двух наборов данных, строили карту неоднородности магнитного поля внутри томографа, после чего данные корректировали и выравнивали в соответствии с полученными картами. Минимальная длина реконструированных трактов составляла 10 вокселей (20 мм).
На основе метода локальных коннектомов анализировали показатель GFA, который за счет алгоритмов расчета лучше решает проблему пересечения трактов по сравнению с FA [28]. GFA характеризует обобщенное различие свойств среды в каждом вокселе: степень миелинизации, плотность и толщину аксональных путей [29]. В то время как большинство структурных коннектомных анализов человека основаны на поиске глобальных паттернов связности на обоих концах анатомических путей, выделенных как зоны интереса, анализ локальных коннектомов, называемый коннектометрией, отслеживает локальные паттерны связности вдоль самих волоконных путей. Это позволяет идентифицировать подкомпоненты путей, которые выражают значимые ассоциации с исследуемой переменной [30].
Статистическая обработка. В программе DSI Studio (http://dsi-studio.labsolver.org) скорректированные диффузионные данные нормализованы в пространство MNI с использованием q-space диффеоморфной реконструкции (QSDR), получена функция распределения спина. Выполнена дополнительная корректировка артефактов, вызванных движением головы испытуемого и вихревыми токами, возникающими при смене величины и полярности градиентных полей внутри томографа. Все скорректированные диффузионные данные включены в коннектометрическую базу для проведения корреляционного анализа производного параметра данных диффузионной МРТ (коэффициент GFA) и степени выраженности симптоматики.
Для статистического анализа взаимосвязи особенностей трактов с психопатологическими проявлениями была использована непараметрическая корреляция по Спирмену с порогом t-критерия, равным 2,5 (пороговое значение уровня значимости р=0,05). Применение рангового коэффициента корреляции Спирмена объясняется отсутствием нормального распределения зависимых величин (критерий Колмогорова–Смирнова) и нелинейной монотонностью во взаимосвязях коррелируемых переменных (коэффициент корреляции Пирсона оценивает линейные взаимосвязи). В результате статистического анализа были локализованы регионы (воксели), в которых величина GFA положительно или отрицательно коррелировала с континуальной гетерогенностью тяжести симптоматики. После этого определяли их принадлежность конкретным трактографическим путям согласно атласу HCP-842 (http://brain.labsolver.org/diffusion-mri-templates/hcp-842-hcp-1021). Для каждого сравнения клинической симптоматики была учтена дополнительная поправка на множественные сравнения FDR (false discovery rate, или ожидаемая доля ложных отклонений). Для удаления ложных связей выполнена 4-итерационная корректировка с учетом топологических особенностей мозга. Согласно методу локальной коннектометрии программы DSI Studio [30], для оценки поправки на множественные сравнения FDR проведено 4000 случайных перестановок в групповых независимых величинах (баллы по конкретной психиатрической шкале) для получения нулевого распределения длины трактов. Длина затронутого подкомпонента используется в качестве статистического индекса, помогающего отличить истинные результаты от ложных результатов, вызванных несовпадением.
Результаты
Характеристика группы пациентов
Все обследованные пациенты находились на стадии реконвалесценции после купирования острого психоза, получали стандартное антипсихотическое лечение в дозе 200–300 мг в хлорпромазиновом эквиваленте. Клинико-динамические характеристики течения заболевания свидетельствуют о репрезентативности изученной выборки и адекватности материала для решения поставленных задач. Так, средний возраст продрома составил 18,4±6,7 года; средний возраст манифеста — 22,2±5,3 года; средний возраст первой госпитализации — 24,9±9,0 года; средняя длительность болезни от начала продрома — 10,8±7,6 года.
Психометрические показатели свидетельствуют о болезненном состоянии на момент обследования. BFCRS составил 8,7±7,7 балла; PANSS P — 24,6±7,6 балла; PANSS N — 28,8±7,9 балла; PANSS G — 52,1±10,2 балла; PANSS Total — 105,4±19,4 балла; P1 (бред) — 4,9±1,8 балла; P3 (галлюцинации) — 3,4±2,1 балла; DSM-5 — 13,7±3,9 балла; NSA-4 — 20,6±5,4 балла; FAB — 14,5±3,4 балла; SAS — 3,0±2,8 балла.
Большинство обследованных пациентов (63,7%) на момент осмотра длительное время были нетрудоспособны (безработные и инвалиды). Кроме того, для пациентов изученной подгруппы характерна и семейная дезадаптация, выражающаяся в отсутствии потребности в доверительных отношениях и в ведении одинокого образа жизни.
Корреляционный анализ между степенью обобщенной фракционной анизотропии и тяжестью симптоматики
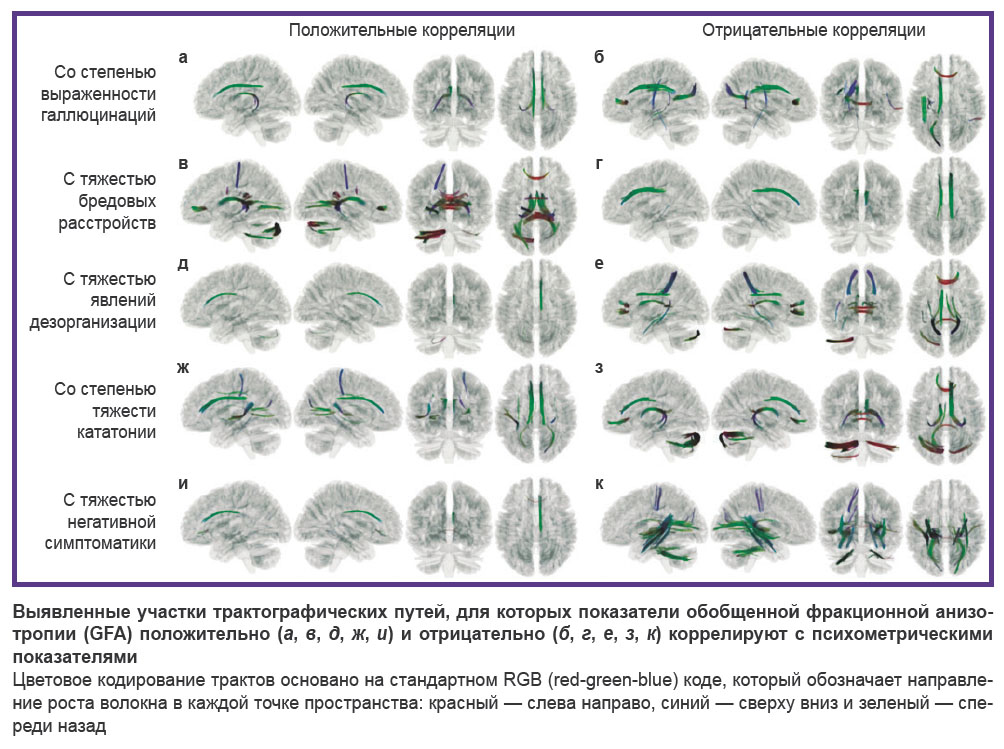
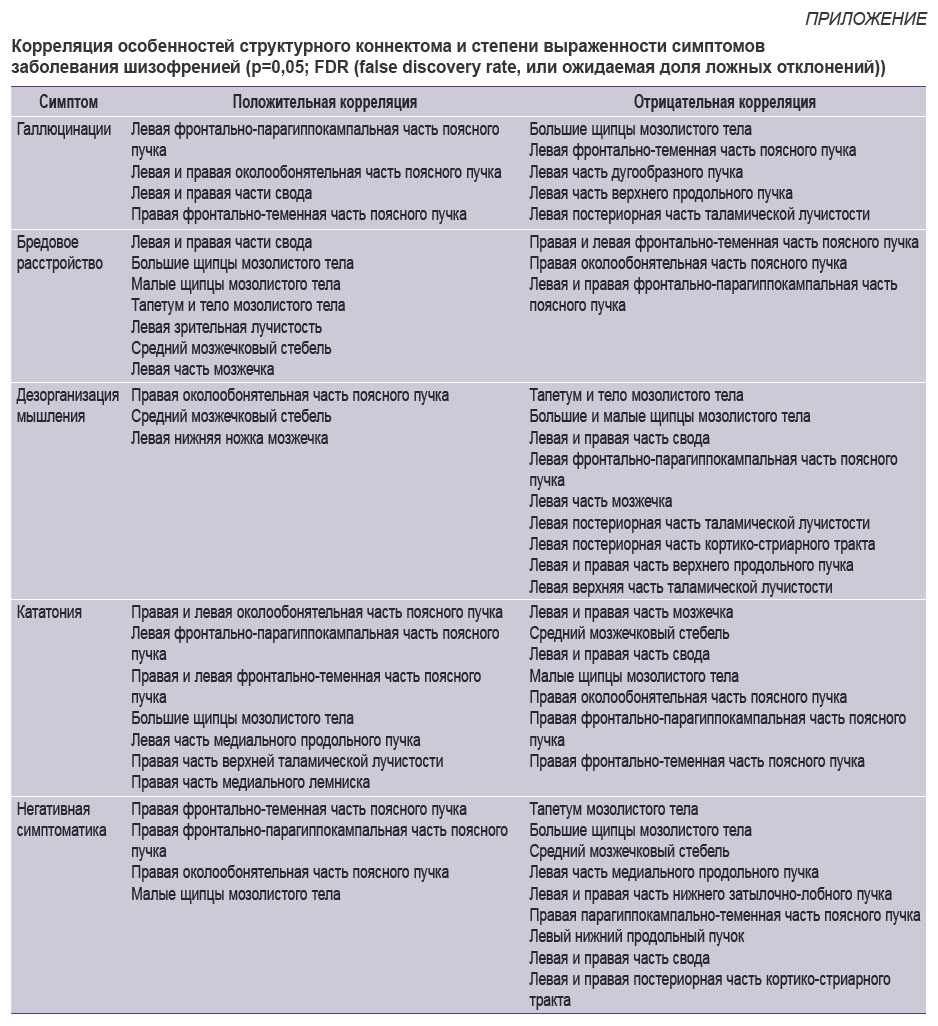
В результате анализа соотношения степени GFA со степенью тяжести симптоматики различных доменов получены данные о неоднородной корреляции структурных особенностей проводящих путей мозга с континуальной симптоматической гетерогенностью: с увеличением тяжести сиптоматики положительная корреляция свидетельствовала о росте анатомической связности регионов головного мозга по исследуемому тракту, в то время как отрицательная корреляция отражала уменьшение такой связности. При рассмотрении конкретных результатов корреляции симптоматики с трактами нужно учитывать, что выявленные соотношения позволяют говорить об ассоциированности или сопряженности обнаруженных структурно-функциональных изменений мозговых тканей, но никак не о прямых причинно-следственных связях. Результаты, представленные ниже, учитывают статистически значимые показатели (p=0,05; FDR) в трактах (см. рисунок и приложение).
 |
Корреляция особенностей структурного коннектома и степени выраженности симптомов заболевания шизофренией (p=0,05; FDR (false discovery rate, или ожидаемая доля ложных отклонений)) |
Корреляция особенностей структурного коннектома и степени выраженности симптома галлюцинаций. Положительная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,58) степени тяжести галлюцинаций и GFA наблюдалась в следующих проводящих путях головного мозга (pисунок, а): левой фронтально-парагиппокампальной части поясного пучка (left frontal parahippocampal cingulum), левой и правой околообонятельной части поясного пучка (left and right parolfactory cingulum), левой и правой части свода (left and right fornix), правой фронтально-теменной части поясного пучка (right frontal parietal cingulum) (p=0,05; FDR).
Отрицательная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,41) степени тяжести галлюцинаций и GFA наблюдалась в следующих проводящих путях головного мозга (рисунок, б): больших щипцах мозолистого тела (forceps major of corpus callosum), левой фронтально-теменной части поясного пучка (left frontal parietal cingulum), левой части дугообразного пучка (left arcuate fasciculus), левой части верхнего продольного пучка (left superior longitudinal fasciculus), левой постериорной части таламической лучистости (left posterior thalamic radiation).
Корреляция особенностей структурного коннектома и степени выраженности симптома бредовых расстройств. Положительная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,43) степени тяжести бреда и GFA наблюдалась в следующих проводящих путях головного мозга (рисунок, в): левой и правой части свода, больших щипцах мозолистого тела, малых щипцах мозолистого тела (forceps minor of corpus callosum), тапетуме и теле мозолистого тела (tapetum and body of corpus callosum), левой зрительной лучистости (left optic radiation), среднем мозжечковом стебле (middle cerebellar peduncle), левой части мозжечка (left cerebellum).
Отрицательная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,59) степени тяжести бреда и GFA наблюдалась для следующих проводящих путей головного мозга (pисунок, г): правой и левой фронтально-теменной части поясного пучка, правой околообонятельной части поясного пучка, левой и правой фронтально-парагиппокампальной части поясного пучка (left and right frontal parahippocampal cingulum).
Корреляция особенностей структурного коннектома и степени выраженности симптома дезорганизации мышления. Положительная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,49) степени тяжести симптома дезорганизации мышления и GFA наблюдалась в следующих проводящих путях головного мозга (pисунок, д): правой околообонятельной части поясного пучка, среднем мозжечковом стебле, левой нижней ножке мозжечка (left inferior cerebellar peduncle).
Отрицательная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,50) степени тяжести бреда и GFA наблюдалась в следующих проводящих путях головного мозга (pисунок, е): тапетуме и теле мозолистого тела, больших и малых щипцах мозолистого тела (forceps major and minor of corpus callosum), левой и правой части свода, левой фронтально-парагиппокампальной части поясного пучка, левой части мозжечка, левой постериорной части таламической лучистости, левой постериорной части кортико-стриарного тракта (left posterior corticostriatal tract), левой и правой части верхнего продольного пучка (left and right superior longitudinal fasciculus), левой верхней части таламической лучистости (left superior thalamic radiation).
Корреляция особенностей структурного коннектома и степени тяжести симптома кататонии. Положительная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,42) GFA проводящих путей головного мозга и тяжести кататонии установлена для следующих трактов (pисунок, ж): левой и правой околообонятельной части поясного пучка, левой фронтально-парагиппокампальной части поясного пучка, левой и правой фронтально-теменной части поясного пучка, больших щипцов мозолистого тела, левой части медиального продольного пучка (left middle longitudinal fasciculus), правой части верхней таламической лучистости (right superior thalamic radiation), правой части медиального лемниска (right medial lemniscus).
Отрицательная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,50) GFA проводящих путей головного мозга и тяжести кататонии зафиксирована в следующих трактах (pисунок, з): левой и правой части мозжечка (left and right cerebellum), среднем мозжечковом стебле, левой и правой части свода, малых щипцах мозолистого тела, правой околообонятельной части поясного пучка, правой фронтально-парагиппокампальной части поясного пучка, правой фронтально-теменной части поясного пучка.
Корреляция особенностей структурного коннектома и степени тяжести негативной симптоматики. Положительная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,53) степени тяжести негативной симптоматики и GFA анизотропии наблюдалась для следующих проводящих путей головного мозга (pисунок, и): правой фронтально-теменной части поясного пучка, правой фронтально-парагиппокампальной части поясного пучка, правой околообонятельной части поясного пучка, малых щипцов мозолистого тела.
Отрицательная корреляция (коэффициент корреляции Спирмена в вокселах менялся в пределах от 0,40 до 0,65) GFA проводящих путей головного мозга и тяжести негативной симптоматики зафиксирована в следующих трактах (pисунок, к): тапетуме мозолистого тела (tapetum of corpus callosum), больших щипцах мозолистого тела, среднем мозжечковом стебле, левой части медиального продольного пучка, левой и правой части нижнего затылочно-лобного пучка (left and right inferior fronto occipital fasciculus), правой парагиппокампально-теменной части поясного пучка (right parahippocampal parietal cingulum), левом нижнем продольном пучке (left inferior longitudinal fasciculus), левой и правой части свода, левой и правой постериорной части кортико-стриарного тракта.
Обсуждение
Особенности структурного коннектома и домен симптома галлюцинации. Нами зафиксировано, что в прямом соотношении с усилением тяжести галлюцинаций наблюдаются следующие изменения:
увеличивается структурная связность в трактах свода головного мозга и в цингулярных трактах, соединяющих фронтальные районы с парагиппокампальными, затылочными и ольфакторными отделами;
уменьшается структурная связность в трактах мозолистого тела в затылочных и передних отделах, соединяющих латеральные и медиальные участки; в трактах верхнего продольного пучка левого полушария, связывающего лобные, теменные, затылочные и височные регионы; в области задней таламической лучистости, обеспечивающей сенсомоторные функции; и, что было ожидаемым, — снижается связность по дугообразному пучку левого полушария между речевыми зонами Брока и Вернике.
Дополнительно к полученным результатам стоит отметить, что ранее в работе [20] были приведены данные о положительной корреляции тяжести галлюцинаций с изменениями в трактах крючкообразного пучка и кортико-спинального тракте левого полушария.
Предполагается, что наблюдаемые изменения в архитектуре проводящих путей мозга влекут за собой изменения в функциональном коннектоме. Так, у пациентов с невербальными галлюцинациями наблюдаются гиперактивность верхней височной извилины и гипоактивность префронтальной доли и передней поясной извилины, что коррелирует со снижением GFA в левом височно-теменном соединении [31]. При хроническом персистировании слуховых галлюцинаций отмечается ослабление функции связности и активности в височных, поясных, премоторных, мозжечковых и подкорковых отделах, участвующих во внутренней речи и вербальном воображении [32], а также снижение коэффициента FA в зонах гиппокампа (hippocampus), валика (splenium) и колена (genu) мозолистого тела [33].
Особенности структурного коннектома и домен симптома бредового расстройства. Бред представляет собой крайнее искажение таких когнитивных процессов, как оценка вознаграждения и оценка предсказания, патоморфологическим субстратом для которых служат нарушения структурной связности между префронтальной, лимбической, паралимбической и сенсорной областями, ответственными за реализацию полученного социально-эмоционального опыта и адекватность анализа происходящего [34]. Ранее получены данные о положительной корреляции параноидного бреда и низкого уровня FA в аркообразном пучке [35], мозолистом теле, верхнем продольном пучке, а также в поясном пучке [36]. Мы обнаружили, что наблюдается отрицательная корреляция между тяжестью бреда (на основе психиатрического обследования это проявляется в качественном показателе перехода от персекуторного к фантастическому бреду) и показателем GFA в цингулярных трактах левого и правого полушария, а также положительная корреляция с GFA тракта мозолистого тела и тракта зрительной лучистости левого полушария, о чем упоминалось в ряде исследований первого психотического эпизода шизофрении [37, 38]. Появление в клинической картине фантастической, причудливой фабулы сопряжено с увеличением GFA в трактах свода и тракте средних ножек мозжечка. Данный результат указывает на возможное участие гиппокампа и его структур (процессы запоминания и реактивации следов памяти), а также структур мозжечка (автономное поведение) в процессах формирования и проявления бредового расстройства.
Особенности структурного коннектома и домен симптома дезорганизации мышления. В период острого психоза наблюдается нарушение функции целенаправленности процессов мышления и его разорванности вплоть до проявления вербигераций, наряду со сложностями координации движений, непониманием смысла простых инструкций или даже появлением «симптома хоботка». Это явление хотя и динамическое, но прогностически важное, определяющее риск неблагоприятного исхода [23]. Установлено, что дезорганизация мышления связана с определяемой методами функциональной нейровизуализации дисфункцией работы нейросетей отделов головного мозга, включающих фронтальные отделы, слуховую кору, зрительную систему, теменные отделы, лимбическую систему, гиппокампальные пути, области поясной извилины и т.д. [39]. В нашем исследовании показана положительная корреляция между степенью нарушения мышления и показателями GFA правой околообонятельной части поясного пучка, трактов средней и нижней ножек мозжечка левого полушария; отрицательная корреляция — с показателем GFA мозолистого тела, свода головного мозга, тракта верхнего продольного пучка. Кроме того, стоит отметить, что с помощью корреляционного анализа была выявлена межполушарная асимметрия, выраженная для левого полушария в изменениях GFA цингулярного тракта, таламических трактов, мозжечка и кортико-стриатумного тракта, что является репликацией результатов нескольких исследований [39]. Полученные данные, как и в предыдущих случаях, отражают системное изменение в проводящих путях головного мозга, затрагивающее связность участков нейросетей исполнительных функций, эмоциональной сферы, процессов памяти, моторного обеспечения, внимания и принятия решений, а также автономных программ исполнения.
Особенности структурного коннектома и домен негативных симптомов. Поиск нейробиологических маркеров негативных расстройств является одной из приоритетных задач современных исследований в связи с фактической малокурабельностью и прямым влиянием на функциональный исход [40, 41]. Негативные расстройства можно считать отражением нейродегенеративных процессов и утраты психических функций в виде сужения палитры эмоциональной экспрессивности и ослабления волевых качеств, необходимых для ощущения полноты жизни и самореализации [42]. В одной из работ, выполненных в парадигме дименсионального подхода, показана положительная корреляция степени тяжести негативных изменений с нарушениями трактов правой передней части таламической лучистости и отрицательная — с правым вентральным поясным пучком [20]. Полученные в нашем исследовании данные расширяют представления о корреляции особенностей структурного коннектома и степени проявления негативных симптомов при заболевании шизофренией. Более глубокие негативные расстройства сопряжены с увеличением GFA в цингулярных трактах правого полушария и трактах мозолистого тела, а также с уменьшением GFA не только в трактах мозжечка и в цингулярном тракте (полученных в аналогичной работе [20]), но и в трактах свода, мозолистого тела, кортикостриальных трактах левого и правого полушарий, в правом височно-затылочном тракте, что обеспечивает вентральный зрительный поток (функция «Кто»). Клинически важным представляется идентификация отрицательной корреляции негативной симтоматики и структурных изменений в левом заднем отделе кортико-стриарного тракта, принимающего участие в волевой регуляции двигательной активности, категоризации объектов и адекватном восприятии эмоций [43].
Изменения структурного коннектома и кататония. Одним из ключевых патофизиологических процессов при кататонии является нарушение контроля моторных актов, проявления эмоций и регуляции поведения за счет аномалий как горизонтальной модуляции — префронтально-орбитофронтально-теменной цепи, так и вертикальной — связующей отделы переднего мозга с глубокими структурами [44]. Согласно результатам исследований [45], при кататонии именно за счет структурно-функциональных аберраций дорсолатеральной префронтальной и орбито-фронтальной коры происходит дисбаланс работы коннектома регулирующих и контролирующих передних отделов мозга с миндалевидным телом, гиппокампом, таламусом. Характерные проявления кататонии коррелируют с дисфункцией боковой части орбито-фронтальной коры, а гетерогенность симптоматики кататонии обусловлена различиями степени поражения или дисфункции тех или иных звеньев перечисленных систем [45]. Мы обнаружили, что утяжеление кататонии коррелирует с увеличением GFA в цингулярных трактах, больших щипцах мозолистого тела, среднем продольном пучке левого полушария, верхней части таламической лучистости и правой части медиального лемниска. Была зафиксирована обратная корреляция между тяжестью симптомов и показателем GFA в трактах мозжечка, свода, малых щипцов мозолистого тела, трактах средней ножки мозжечка и цингулярном тракте.
Изменения структурного коннектома и полиморфность тяжести различных доменов симптоматики. Полученные нами данные показали, что изменения некоторых трактов белого вещества головного мозга ассоциируются с тяжестью сразу нескольких доменов симптомов. Так, изменения в трактах фронтально-теменной и околообонятельной части поясного пучка правого полушария коррелируют с тяжестью галлюцинаций, негативной и кататонической симптоматикой. Известно, что передняя часть поясной извилины связана с формированием субъективных оценок индивидуального эмоционального опыта и контролем исполнительных функций. Изменения в связности поясной извилины особенно проявляются при эмпатии и когнитивной регуляции эмоций [46]. При этом задняя часть поясной извилины связана с интеграцией информации в структуру индивидуального опыта при задействовании процессов внимания, рабочей/долговременной памяти [36]. Изменения в трактах левой фронтально-парагиппокампальной части поясного пучка отрицательно коррелируют со степенью тяжести галлюцинации и бреда, а правой фронтально-парагиппокампальной части поясного пучка — с тяжестью бреда и кататонии. В случаях тяжелой степени галлюцинаций, бредовых расстройств и дезорганизации наиболее значимые изменения проявляются в структурах трактов свода левого и правого полушарий. Свод как часть лимбической системы и основной выходной тракт гиппокампа принимает участие в работе эпизодической памяти, связанной с кодированием и извлечением пространственно-временных паттернов, а также в процессах извлечения долговременной памяти [47].
Значимые изменения в проводящих путях мозолистого тела, играющего ключевую роль в информационных межполушарных взаимодействиях, коррелировали с выраженностью тяжести симптомов кататонии и негативной симптоматикой. При этом развитие кататонии с явлениями тяжелой дезорганизации было дополнительно сопряжено с изменением связности трактов сенсорно-моторной системы (левой и правой части верхней таламической лучистости).
Результаты, полученные в ходе настоящей работы, частично совпадают с ранее опубликованными данными M.H.A. Bopp с соавт. [20], при этом дополняют сведения о наборе измененных трактов в структурном коннектоме, связанных с тяжестью психопатологических дименсий. Причина изменения структурного коннектома требует дальнейшего изучения. Полученные нами результаты могут быть объяснены разными моделями — особенностями нейрогенеза в структурах головного мозга, уровнем функциональной активности различных нейротрансмиттерных нейромедиаторных систем, задействованных при психозах [48] и т.д. Необходимо учесть, что изменения могут иметь более сложную форму причинно-следственных связей и развиваться в силу взаимодействия нескольких факторов, участвующих в патогенезе психозов. Например, существует дискутивное предположение о сочетанном действии нейротропных микроорганизмов [49].
Функциональная и структурная реорганизация нейросетей головного мозга при заболевании шизофренией происходит в онтогенезе и, по-видимому, имеет определенный профиль. Этот профиль задается, с одной стороны, динамикой созревания нейросетевых структур головного мозга [50] и, с другой стороны, последующей потерей серого вещества головного мозга [51], последовательно затрагивающей париентальный, фронтальный кортекс, височные области. Направленность таких генерализованных изменений совмещена с формированием индивидуального опыта при взаимодействии субъекта с внешней средой и таким образом влияет на формирование функциональных систем организма. На уровне структурной организации головного мозга это отражается, помимо изменений в сером веществе, в нелинейной зависимости силы связности участков мозга от выраженности симптоматики заболевания [52]. На поведенческом уровне данная динамика морфометрических и трактографических изменений отражается в комплексе онтогенетических симптомов, затрагивающих нарушение перцепции интегративного образа, функции когнитивного контроля, формирования опережающей модели поведения, социальной дезадаптации и др. Полученные данные позволяют предположить, что на данном этапе развития психиатрии важно и необходимо создание объективной оценки заболевания шизофренией, основу которой составят структурные и функциональные архитектуры нейросетей головного мозга больных как субстрата реализаций психических функций. Понимание нарушений в функциональных системах головного мозга даст возможность на следующем этапе разработать индивидуальные программы восстановления.
Сильные стороны работы. Проведено тщательное обследование нозологически единой группы пациентов, перенесших первый психотический эпизод шизофрении. Важным аспектом является выделение континуальной гетерогенности тяжести проявления основных психопатологических доменов — галлюцинаций, бреда, дезорганизации мышления, кататонии и негативной симптоматики. Это позволило не только реплицировать результаты других работ, выполненных в аналогичном дизайне, но и получить новые данные о трактах головного мозга, изменения которых коррелируют с симптоматикой.
Ограничения работы. Относительно пациентов обследованной выборки можно указать на то, что в клиническом аспекте (с точки зрения диагноза) речь идет об однородной группе с континуально гетерогенными по степени тяжести симптомами. Однако не проводится детальный анализ проводимой терапии, а также характеристик доболезненного периода, включая перинатальную патологию, нарушения в детском возрасте и т.д., которые потенциально могут оказывать влияние на морфофункциональные особенности головного мозга.
Заключение
В ходе исследования применен дименсиональный подход клинической диагностики, учитывающий континуальную гетерогенность тяжести основных симптомов в группе пациентов с шизофренией. Получены новые данные о возможной дифференциальной вовлеченности мозговых структур в патогенез разнообразных проявлений шизофрении, таких как галлюцинации, бред, явления дезорганизации, кататония и негативные расстройства.
Финансирование. Исследование выполнено частично за счет гранта Российского научного фонда №20-15-00299П.
Конфликт интересов. Конфликт интересов, связанный с данным исследованием, отсутствует.
Литература
- Vitolo E., Tatu M.K., Pignolo C., Cauda F., Costa T., Ando’ A., Zennaro A. White matter and schizophrenia: a meta-analysis of voxel-based morphometry and diffusion tensor imaging studies. Psychiatry Res Neuroimaging 2017; 270: 8–21, https://doi.org/10.1016/j.pscychresns.2017.09.014.
- Honea R., Crow T.J., Passingham D., Mackay C.E. Regional deficits in brain volume in schizophrenia: a meta-analysis of voxel-based morphometry studies. Am J Psychiatry 2005; 162(12): 2233–2245, https://doi.org/10.1176/appi.ajp.162.12.2233.
- Podwalski P., Szczygieł K., Tyburski E., Sagan L., Misiak B., Samochowiec J. Magnetic resonance diffusion tensor imaging in psychiatry: a narrative review of its potential role in diagnosis. Pharmacol Rep 2021; 73(1): 43–56, https://doi.org/10.1007/s43440-020-00177-0.
- Demjaha A., Morgan K., Morgan C., Landau S., Dean K., Reichenberg A., Sham P., Fearon P., Hutchinson G., Jones P.B., Murray R.M., Dazzan P. Combining dimensional and categorical representation of psychosis: the way forward for DSM-V and ICD-11? Psychol Med 2009; 39(12): 1943–1955, https://doi.org/10.1017/S0033291709990651.
- Crow T.J. The two-syndrome concept: origins and current status. Schizophr Bull 1985; 11(3): 471–486, https://doi.org/10.1093/schbul/11.3.471.
- Liddle P.F., Barnes T.R., Morris D., Haque S. Three syndromes in chronic schizophrenia. Br J Psychiatry Suppl 1989; 7: 119–122.
- Lindenmayer J.P., Bernstein-Hyman R., Grochowski S., Bark N. Psychopathology of schizophrenia: initial validation of a 5-factor model. Psychopathology 1995; 28(1): 22–31, https://doi.org/10.1159/000284896.
- Lehman A.F. Improving treatment for persons with schizophrenia. Psychiatr Q 1999; 70(4): 259–272, https://doi.org/10.1023/a:1022082031007.
- Mucci A., Galderisi S., Amodio A., Dierks T. Neuroimaging and psychopathological domains. In: Galderisi S., DeLisi L., Borgwardt S. (editors). Neuroimaging of schizophrenia and other primary psychotic disorders. Springer, Cham; 2019; p. 57–155, https://doi.org/10.1007/978-3-319-97307-4_2.
- Wheeler A.L., Voineskos A.N. A review of structural neuroimaging in schizophrenia: from connectivity to connectomics. Front Hum Neurosci 2014; 8: 653, https://doi.org/10.3389/fnhum.2014.00653.
- Zhang F., Daducci A., He Y., Schiavi S., Seguin C., Smith R.E., Yeh C.H., Zhao T., O’Donnell L.J. Quantitative mapping of the brain’s structural connectivity using diffusion MRI tractography: a review. Neuroimage 2022; 249: 118870, https://doi.org/10.1016/j.neuroimage.2021.118870.
- Kraguljac N.V., Lahti A.C. Neuroimaging as a window into the pathophysiological mechanisms of schizophrenia. Front Psychiatry 2021; 12: 613764, https://doi.org/10.3389/fpsyt.2021.613764.
- Chan W.Y., Yang G.L., Chia M.Y., Lau I.Y., Sitoh Y.Y., Nowinski W.L., Sim K. White matter abnormalities in first-episode schizophrenia: a combined structural MRI and DTI study. Schizophr Res 2010; 119(1-3): 52–60, https://doi.org/10.1016/j.schres.2009.12.012.
- Alderson-Day B., McCarthy-Jones S., Fernyhough C. Hearing voices in the resting brain: a review of intrinsic functional connectivity research on auditory verbal hallucinations. Neurosci Biobehav Rev 2015; 55: 78–87, https://doi.org/10.1016/j.neubiorev.2015.04.016.
- Kubera K.M., Rashidi M., Schmitgen M.M., Barth A., Hirjak D., Sambataro F., Calhoun V.D., Wolf R.C. Structure/function interrelationships in patients with schizophrenia who have persistent auditory verbal hallucinations: a multimodal MRI study using parallel ICA. Prog Neuropsychopharmacol Biol Psychiatry 2019; 93: 114–121, https://doi.org/10.1016/j.pnpbp.2019.03.007.
- Rowland L.M., Spieker E., Holcomb H.H. A review of diffusion tensor imaging in schizophrenia. Clinical Schizophrenia & Related Psychoses 2009; 3(3): 142–154.
- Hugdahl K. Auditory hallucinations: A review of the ERC “VOICE’ project. World J Psychiatry 2015; 5(2): 193–209, https://doi.org/10.5498/wjp.v5.i2.193.
- Padmanabhan J.L., Tandon N., Haller C.S., Mathew I.T., Eack S.M., Clementz B.A., Pearlson G.D., Sweeney J.A., Tamminga C.A., Keshavan M.S. Correlations between brain structure and symptom dimensions of psychosis in schizophrenia, schizoaffective, and psychotic bipolar I disorders. Schizophr Bull 2015; 41(1): 154–162, https://doi.org/10.1093/schbul/sbu075.
- McKnight R., Price J., Geddes J. Schizophrenia and related psychotic disorders. In: Psychiatry. Oxford University Press; 2019; p. 289–310, https://doi.org/10.1093/oso/9780198754008.003.0030.
- Bopp M.H.A., Zöllner R., Jansen A., Dietsche B., Krug A., Kircher T.T.J. White matter integrity and symptom dimensions of schizophrenia: a diffusion tensor imaging study. Schizophr Res 2017; 184: 59–68, https://doi.org/10.1016/j.schres.2016.11.045.
- Thomas P., Mathur P., Gottesman I.I., Nagpal R., Nimgaonkar V.L., Deshpande S.N. Correlates of hallucinations in schizophrenia: a cross-cultural evaluation. Schizophr Res 2007; 92(1–3): 41–49, https://doi.org/10.1016/j.schres.2007.01.017.
- Jablensky A., Sartorius N., Ernberg G., Anker M., Korten A., Cooper J.E., Day R., Bertelsen A. Schizophrenia: manifestations, incidence and course in different cultures. A World Health Organization ten-country study. Psychol Med Monogr Suppl 1992; 20: 1–97. Corrected and republished from: Psychol Med Monogr Suppl 1992; 22(4): following 1092, https://doi.org/10.1017/s0264180100000904.
- Roche E., Creed L., MacMahon D., Brennan D., Clarke M. The epidemiology and associated phenomenology of formal thought disorder: a systematic review. Schizophr Bull 2015; 41(4): 951–962, https://doi.org/10.1093/schbul/sbu129.
- Solmi M., Pigato G.G., Roiter B., Guaglianone A., Martini L., Fornaro M., Monaco F., Carvalho A.F., Stubbs B., Veronese N., Correll C.U. Prevalence of catatonia and its moderators in clinical samples: results from a meta-analysis and meta-regression analysis. Schizophr Bull 2018; 44(5): 1133–1150, https://doi.org/10.1093/schbul/sbx157.
- Aandi Subramaniyam B., Muliyala K.P., Suchandra H.H., Reddi V.S.K. Diagnosing catatonia and its dimensions: cluster analysis and factor solution using the Bush Francis Catatonia Rating Scale (BFCRS). Asian J Psychiatr 2020; 52: 102002, https://doi.org/10.1016/j.ajp.2020.102002.
- Sicras-Mainar A., Maurino J., Ruiz-Beato E., Navarro-Artieda R. Impact of negative symptoms on healthcare resource utilization and associated costs in adult outpatients with schizophrenia: a population-based study. BMC Psychiatry 2014; 14: 225, https://doi.org/10.1186/s12888-014-0225-8.
- Bobes J., Arango C., Garcia-Garcia M., Rejas J.; CLAMORS Study Collaborative Group Prevalence of negative symptoms in outpatients with schizophrenia spectrum disorders treated with antipsychotics in routine clinical practice: findings from the CLAMORS study. J Clin Psychiatry 2010; 71(3): 280–286. Corrected and republished from: J Clin Psychiatry 2011; 72(7): 1017, https://doi.org/10.4088/JCP.08m04250yel.
- Yeh F.C., Verstynen T.D., Wang Y., Fernández-Miranda J.C., Tseng W.Y. Deterministic diffusion fiber tracking improved by quantitative anisotropy. PLoS One 2013; 8(11): e80713, https://doi.org/10.1371/journal.pone.0080713.
- Yu W., Lv Q., Zhang C., Shen Z., Sun B., Wang Z. High-angular diffusion MRI in reward-based psychiatric disorders. In: Sun B., Salles A. (editors). Neurosurgical Treatments for Psychiatric Disorders. Springer, Dordrecht; 2015, https://doi.org/10.1007/978-94-017-9576-0_2.
- Yeh F.C., Badre D., Verstynen T. Connectometry: a statistical approach harnessing the analytical potential of the local connectome. Neuroimage 2016; 125: 162–171, https://doi.org/10.1016/j.neuroimage.2015.10.053.
- Zhuo C., Fang T., Chen C., Chen M., Sun Y., Ma X., Li R., Tian H., Ping J. Brain imaging features in schizophrenia with co-occurring auditory verbal hallucinations and depressive symptoms — implication for novel therapeutic strategies to alleviate the reciprocal deterioration. Brain Behav 2021; 11(2): e01991, https://doi.org/10.1002/brb3.1991.
- Martí-Bonmatí L., Lull J.J., García-Martí G., Aguilar E.J., Moratal-Pérez D., Poyatos C., Robles M., Sanjuán J. Chronic auditory hallucinations in schizophrenic patients: MR analysis of the coincidence between functional and morphologic abnormalities. Radiology 2007; 244(2): 549–556, https://doi.org/10.1148/radiol.2442060727.
- Hubl D., Koenig T., Strik W., Federspiel A., Kreis R., Boesch C., Maier S.E., Schroth G., Lovblad K., Dierks T. Pathways that make voices: white matter changes in auditory hallucinations. Arch Gen Psychiatry 2004; 61(7): 658–668, https://doi.org/10.1001/archpsyc.61.7.658
- Rădulescu A.R., Mujica-Parodi L.R. A systems approach to prefrontal-limbic dysregulation in schizophrenia. Neuropsychobiology 2008; 57(4): 206–216, https://doi.org/10.1159/000151731.
- Abdul-Rahman M.F., Qiu A., Woon P.S., Kuswanto C., Collinson S.L., Sim K. Arcuate fasciculus abnormalities and their relationship with psychotic symptoms in schizophrenia. PLoS One 2012; 7(1): e29315, https://doi.org/10.1371/journal.pone.0029315.
- Fitzsimmons J., Schneiderman J.S., Whitford T.J., Swisher T., Niznikiewicz M.A., Pelavin P.E., Terry D.P., Mesholam-Gately R.I., Seidman L.J., Goldstein J.M., Kubicki M. Cingulum bundle diffusivity and delusions of reference in first episode and chronic schizophrenia. Psychiatry Res 2014; 224(2): 124–132, https://doi.org/10.1016/j.pscychresns.2014.08.002.
- Whitford T.J., Kubicki M., Pelavin P.E., Lucia D., Schneiderman J.S., Pantelis C., McCarley R.W., Shenton M.E. Cingulum bundle integrity associated with delusions of control in schizophrenia: preliminary evidence from diffusion-tensor tractography. Schizophr Res 2015; 161(1): 36–41, https://doi.org/10.1016/j.schres.2014.08.033.
- Braun U., Schaefer A., Betzel R.F., Tost H., Meyer-Lindenberg A., Bassett D.S. From maps to multi-dimensional network mechanisms of mental disorders. Neuron 2018; 97(1): 14–31, https://doi.org/10.1016/j.neuron.2017.11.007.
- Harvey P.D., Strassnig M. Predicting the severity of everyday functional disability in people with schizophrenia: cognitive deficits, functional capacity, symptoms, and health status. World Psychiatry 2012; 11(2): 73–79, https://doi.org/10.1016/j.wpsyc.2012.05.004.
- Galderisi S., Rossi A., Rocca P., Bertolino A., Mucci A., Bucci P., Rucci P., Gibertoni D., Aguglia E., Amore M., Bellomo A., Biondi M., Brugnoli R., Dell’Osso L., De Ronchi D., Di Emidio G., Di Giannantonio M., Fagiolini A., Marchesi C., Monteleone P., Oldani L., Pinna F., Roncone R., Sacchetti E., Santonastaso P., Siracusano A., Vita A., Zeppegno P., Maj M; Italian Network For Research on Psychoses. The influence of illness-related variables, personal resources and context-related factors on real-life functioning of people with schizophrenia. World Psychiatry 2014; 13(3): 275–287, https://doi.org/10.1002/wps.20167.
- Galderisi S., Mucci A., Buchanan R.W., Arango C. Negative symptoms of schizophrenia: new developments and unanswered research questions. Lancet Psychiatry 2018; 5(8): 664–677, https://doi.org/10.1016/S2215-0366(18)30050-6.
- de Wit S., Watson P., Harsay H.A., Cohen M.X., van de Vijver I., Ridderinkhof K.R. Corticostriatal connectivity underlies individual differences in the balance between habitual and goal-directed action control. J Neurosci 2012; 32(35): 12066–12075, https://doi.org/10.1523/JNEUROSCI.1088-12.2012.
- Gansler D.A., McLaughlin N.C., Iguchi L., Jerram M., Moore D.W., Bhadelia R., Fulwiler C. A multivariate approach to aggression and the orbital frontal cortex in psychiatric patients. Psychiatry Res 2009; 171(3): 145–154, https://doi.org/10.1016/j.pscychresns.2008.03.007.
- Hirjak D., Rashidi M., Kubera K.M., Northoff G., Fritze S., Schmitgen M.M., Sambataro F., Calhoun V.D., Wolf R.C. Multimodal magnetic resonance imaging data fusion reveals distinct patterns of abnormal brain structure and function in catatonia. Schizophr Bull 2020; 46(1): 202–210, https://doi.org/10.1093/schbul/sbz042.
- Palomero-Gallagher N., Hoffstaedter F., Mohlberg H., Eickhoff S.B., Amunts K., Zilles K. Human pregenual anterior cingulate cortex: structural, functional, and connectional heterogeneity. Cereb Cortex 2019; 29(6): 2552–2574, https://doi.org/10.1093/cercor/bhy124.
- Bubb E.J., Metzler-Baddeley C., Aggleton J.P. The cingulum bundle: anatomy, function, and dysfunction. Neurosci Biobehav Rev 2018; 92: 104–127, https://doi.org/10.1016/j.neubiorev.2018.05.008.
- Benear S.L., Ngo C.T., Olson I.R. Dissecting the fornix in basic memory processes and neuropsychiatric disease: a review. Brain Connect 2020; 10(7): 331–354, https://doi.org/10.1089/brain.2020.0749.
- Efimova O., Pavlov K., Kachanovskiy M., Ayupova A., Zorkina Ya., Morozova A., Andreyuk D., Kostyuk G. Gene expression asymmetry in the human prefrontal cortex. In: Velichkovsky B.M., Balaban P.M., Ushakov V.L. (editors). Advances in cognitive research, artificial intelligence and neuroinformatics. Intercognsci 2020. Advances in Intelligent Systems and Computing, vol 1358. Springer, Cham; 2021; p. 464–472, https://doi.org/10.1007/978-3-030-71637-0_53.
- Gutiérrez-Fernández J., Luna Del Castillo Jde D., Mañanes-González S., Carrillo-Ávila J.A., Gutiérrez B., Cervilla J.A., Sorlózano-Puerto A. Different presence of Chlamydia pneumoniae, herpes simplex virus type 1, human herpes virus 6, and Toxoplasma gondii in schizophrenia: meta-analysis and analytical study. Neuropsychiatr Dis Treat 2015; 11: 843–852, https://doi.org/10.2147/NDT.S79285.
- Gogtay N., Giedd J.N., Lusk L., Hayashi K.M., Greenstein D., Vaituzis A.C., Nugent T.F. 3rd, Herman D.H., Clasen L.S., Toga A.W., Rapoport J.L., Thompson P.M. Dynamic mapping of human cortical development during childhood through early adulthood. Proc Natl Acad Sci U S A 2004; 101(21): 8174–8179, https://doi.org/10.1073/pnas.0402680101.
- Шмуклер А.Б. Структурно-функциональная рассогласованность различных отделов головного мозга при шизофрении: роль интегративной перцепции. Социальная и клиническая психиатрия 2010; 20(3): 86–95.
- Mosina L., Ushakov V., Orlov V., Kartashov S., Zakharova N., Kostyuk G. Assessment and correlation of morphometric and tractographic measures of patients diagnosed with schizophrenia. In: Samsonovich A.V., Liu T. (editors). Biologically Inspired Cognitive Architectures 2023. BICA 2023. Studies in Computational Intelligence, vol 1130. Springer, Cham; 2024; p. 612–626, https://doi.org/10.1007/978-3-031-50381-8_65.