Лазерная сварка с биоприпоем для соединения краев ран на слизистой оболочке полости рта в эксперименте
Цель исследования — в условиях экспериментального моделирования дефектов ротовой полости оценить эффективность соединения краев мягких тканей с применением диодного лазера с длиной волны 970 нм и биоприпоя на основе бычьего сывороточного альбумина и одностенных углеродных нанотрубок.
Материалы и методы. Объектом экспериментального исследования явились 16 кроликов породы шиншилла. Моделировали линейные дефекты слизистой оболочки ротовой полости длиной 1 см. Животных разделили на 2 группы — по 8 в каждой. В контрольной группе раны ушивали хирургическим швом нитью Prolene 5-0; в опытной — с помощью лазерной сварки и биоприпоя на основе бычьего сывороточного альбумина, индоцианина зеленого, одностенных углеродных нанотрубок и коллагена I типа с последующим наложением дополнительных швов нитью Prolene 5-0. Использовали проприорный лазерный прибор с длиной волны 970 нм с адаптивной термостабилизацией шва, который позволяет устанавливать температуру нагрева биоткани в области наложения лазерного шва с точностью ~1°С, что предотвращает термический некроз тканей.
Биологические ткани 24 образцов слизистой оболочки полости рта кроликов обеих групп были фиксированы на 1, 3, 5 и 10-е сутки и исследованы методами морфологии и морфометрии.
Результаты. Воспалительные изменения были в большей степени связаны с реакцией на шовный материал, пролиферативные (неоангиогенез и регенерация эпителия) — с активацией пролиферации фибробластов и эпителиоцитов вследствие воздействия лазера. Применение биоприпоя способствовало дополнительному сцеплению тканей, что в дальнейшем ускорило процесс регенерации и увеличило показатель неоангиогенеза и плотности сосудов на 1 мм2.
В опытной группе воспалительная реакция завершалась уже к 5-м суткам, тогда как в контрольной группе остаточные признаки воспаления сохранялись в отдельных образцах до 10-х суток. На 10-е сутки в опытной группе отмечалось начало пролиферативной фазы. При иммуногистохимическом анализе выявлено статистически значимое увеличение количества кровеносных сосудов в опытной группе на 70,6% по сравнению с контролем (p=0,003).
Заключение. Применение лазерного воздействия в сочетании с биоприпоем способствует улучшению адгезии тканей, сокращению фазы воспаления и ускорению регенерации, обеспечивая минимальное рубцевание. Полученные данные подчеркивают перспективность применения предлагаемой нами методики соединения краев ран слизистой оболочки полости рта в клинической практике для пациентов с различными стоматологическими заболеваниями.
Введение
Лазерная медицина является одним из приоритетных направлений в современной стоматологии. Лазерная сварка обладает рядом преимуществ по сравнению с традиционными методами соединения биологических тканей с использованием хирургических шовных материалов (например, иглы и нити). К таким преимуществам относят герметичность и стерильность раны, сосудистый анастомоз, практически незаметные рубцы на местах швов и быстрое соединение тканей [1, 2]. Все это напрямую влияет на качество лечения и ускорение репаративных процессов [3–7]. Исследователи подчеркивают, что диодный лазер обладает высоким уровнем безопасности, вследствие чего его можно применять в стоматологии, не опасаясь при этом повредить мягкие ткани [8].
С целью ускорения заживляющих процессов и лучшего сцепления краев раны во время операции совместно с лазерами для соединения рассеченных тканей используют специальные биоприпои. В состав биоприпоя могут входить такие белки, как альбумин, фиброген и коллаген. Был предложен биоприпой на основе биологического материала альбумина, наполнителя из одностенных углеродных нанотрубок и медицинского красителя индоцианина зеленого. Этот биоприпой обеспечивает высокую прочность лазерного шва на разрыв, имеет низкое содержание углеродных нанотрубок, минимизирует энергетическую нагрузку лазерного излучения на ткани и ускоряет процесс сварки [9].
Лазерная пайка тканей с использованием биоприпоев особенно эффективна при восстановлении целостности мелких кровеносных сосудов, нервных волокон и семенных протоков. Вместе с тем лазерные устройства не всегда обеспечивают достаточную прочность соединения биологических тканей. В связи с этим существует необходимость усиления эффективности лазерного спаивания рассеченных тканей (например, через увеличение поглощения излучения используемого лазера), что позволит обеспечить точечный прогрев свариваемых тканей, не допуская перегрева окружающих участков [10–15].
При соединении краев раны, в том числе при операциях в ротовой полости, большое значение имеет не только герметичность шва, но и возможность предупреждения воспаления и некроза, а также эстетичность послеоперационного рубца [1, 2, 4, 5, 16, 17]. На сегодняшний день не предложено универсального метода сцепления краев раны мягких тканей при хирургическом лечении пациентов со стоматологическими заболеваниями, который бы удовлетворял всем требованиям и не имел ограничений по применению.
Цель исследования — в условиях экспериментального моделирования дефектов ротовой полости оценить эффективность соединения краев мягких тканей с применением диодного лазера с длиной волны 970 нм и биоприпоя на основе бычьего сывороточного альбумина и одностенных углеродных нанотрубок.
Материалы и методы
Протокол работы с животными. Работа проведена в полном соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.), и одобрена этическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова. Содержание животных осуществлялось согласно требованиями ГОСТ P 53434-2009 «Принципы надлежащей лабораторной практики (GLP)» от 02.12.2009 г. Кормление животных проводилось по нормативам в соответствии с видом животного, без специализированного корма (например, содержащего добавки для стимуляции регенерации).
В исследование включено 16 кроликов породы шиншилла, разделенных на две группы — по 8 в каждой. Каждая группа была распределена по четырем временны́м точкам (по 2 животных на каждую). У всех животных моделировали линейные раны длиной 1 см на вестибулярной поверхности верхней челюсти слева и справа, используя скальпель №15С. Дополнительно у одного из двух кроликов на временнóй точке на нижней челюсти справа создавали дефект, а у второго — забирали интактный участок слизистой оболочки. Таким образом, на каждой временнóй точке получали шесть образцов: пять — из зон раневого заживления и один — из интактной ткани.
Соединение краев ран в контрольной и в опытной группе проводили под наркозом и местной анестезией с использованием раствора для инъекций Артикаина-Бинергия с адреналином (20 мг + 0,005 мг/мл).
В контрольной группе раны ушивали хирургическим швом нитью Prolene 5-0; в опытной — с помощью лазерной сварки и биоприпоя на основе бычьего сывороточного альбумина, индоцианина зеленого, одностенных углеродных нанотрубок и коллагена I типа с последующим наложением дополнительных швов нитью Prolene 5-0.
В опытной группе с помощью серповидной гладилки вносили биоприпой в рану, равномерно распределяя по краям; при нанесении избыточного количества биоприпоя его удаляли с помощью стерильной марлевой медицинской салфетки путем ее промокания на поверхности раны. Далее на рану воздействовали излучением с помощью лазерной установки, плавно перемещая наконечник лазера от начала разреза по всей его длине. Формирование лазерного шва длиной 1 см осуществлялось в течение 15 с. Для усиления прочности на лазерный шов накладывали 3 узловых. Использовали лазерный прибор с длиной волны 970 нм с адаптивной термостабилизацией шва, разработанный в научно-исследовательской лаборатории биомедицинских нанотехнологий Института биомедицинских систем Национального исследовательского университета «Московский институт электронной техники». Прибор позволяет устанавливать температуру нагрева биоткани в области наложения лазерного шва с точностью ~1°С, что предотвращает термический некроз тканей. Диаметр оптоволокна — 600 мкм; диаметр лазерного пятна — 2 мм. Средняя температура в области лазерной пайки составляла 40°; мощность лазерного излучения варьировалась от 1,1 до 2,5 Вт.
Лабораторных животных обеих групп выводили из эксперимента введением избыточной дозы «Золетила» с соблюдением правил эвтаназии на 1, 3, 5 и 10-е сутки после операции. Макропрепараты слизистой оболочки полости рта кроликов направляли на гистологическое и иммуногистохимическое исследование.
Протокол изготовления гистологических препаратов. На гистологическое исследование поступило 48 образцов от 16 животных. Среди них 20 образцов содержали дефекты слизистой оболочки ротовой полости после наложения шва, 20 образцов — после применения лазерной пайки. Оставшиеся 8 образцов представляли собой интактную ткань слизистой оболочки ротовой полости. Таким образом, в каждой группе исследования на каждую временнýю точку на гистологическое исследование поступило 5 образцов.
Ткани, фиксированные в 10% нейтральном забуференном формалине, заливали парафином так, чтобы обеспечить получение срезов, перпендикулярных поверхности слизистой оболочки. Срезы толщиной 3–4 мкм окрашивали гематоксилином и эозином и трихромом по Маллори. Образцы были изучены методом стандартной оптической микроскопии с помощью универсального микроскопа Leica DM4000 B, оснащенного видеокамерой Leica DFC7000 T и программным обеспечением LAS V4.8 (Leica Microsystems, Германия).
В каждом препарате оценивали признаки воспаления (экссудация, инфильтрация иммунными клетками, микроциркуляторные нарушения) и регенерации (неоангиогенез, пролиферация фибробластов) по опубликованной ранее 4-балльной шкале (см. таблицу) [18].

|
Балльная система оценки морфологических признаков в участке лечения [18] |
Протокол иммуногистохимического исследования. Срезы толщиной 3–4 мкм депарафинизировали и инкубировали с 3% перекисью водорода в течение 10 мин. Неспецифическое окрашивание предотвращали блокирующим раствором (Cell Marque, США). Срезы инкубировали с мышиными моноклональными первичными антителами против α-гладкомышечного актина, или α-SMA (A2547; Merck & Co., Inc., США; разведение 1:400). Визуализацию проводили с помощью вторичных козьих антител, конъюгированных с пероксидазой хрена (G-21040; Invitrogen, США; разведение 1:1000), и диаминобензидина (DAB) с контрастным окрашиванием гематоксилином. Экспрессию α-SMA в участках имплантации оценивали с помощью полуколичественной системы:
«–» — экспрессия отсутствует;
«+» — отдельные позитивно окрашенные клетки;
«++» — небольшое количество позитивно окрашенных клеток (менее 19 на 1 поле зрения; 400×);
«+++» — значительное количество позитивно окрашенных клеток (более 20 на 1 поле зрения; 400×).
Плотность сосудов определяли на микроскопе Leica DM4000 B T (Leica Microsystems, Германия) при 200× в 5 репрезентативных полях зрения.
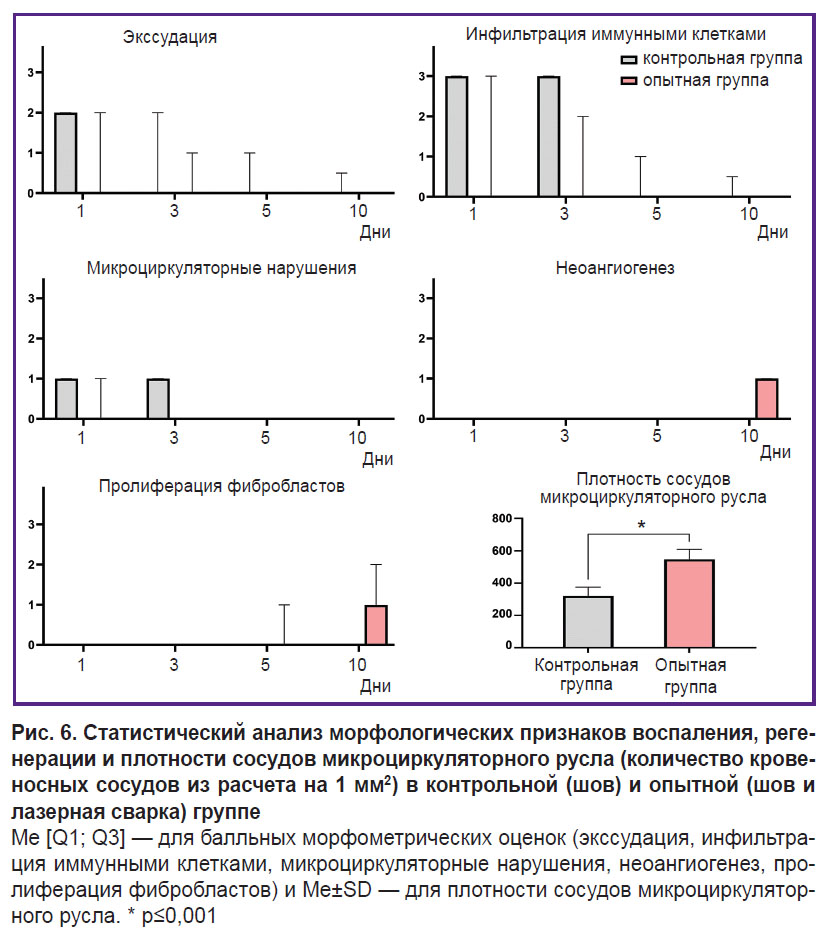
Статистическая обработка результатов. Статистический анализ экспериментальных данных проводили с использованием программного обеспечения Prism 10.0 для Windows (GraphPad, США). Различия балльных морфометрических параметров (экссудация, инфильтрация иммунными клетками, микроциркуляторные нарушения, неоангиогенез, пролиферация фибробластов) оценивали с помощью теста Манна–Уитни. Нормальность распределения количественных данных (количество кровеносных сосудов из расчета на 1 мм2) проверяли с помощью теста Шапиро–Уилка. Различия в плотности кровеносных сосудов проверяли с помощью t-теста. Результаты считали статистически значимыми при р≤0,05. Результаты статистического анализа балльных морфометрических параметров представляли в виде столбчатых графов с медианными значениями и межквартильными размахами (Me [Q1; Q3]). Результаты анализа плотности сосудов были представлены как средние значения, рассчитанные на 1 мм2, с указанием стандартного отклонения (Me±SD).
Результаты
В контрольной группе на 1-е сутки (рис. 1, а, б и рис. 2, а, б) фрагменты ткани слизистой оболочки рта были выстланы многослойным плоским эпителием. В трех из пяти исследованных срезов наблюдался дефект слизистой оболочки в области синтетической нити с нарушением эпителиального покрова, окруженный валом воспалительных клеток (преимущественно нейтрофилов, а также лимфоцитов). Подслизистая основа в этом месте — несколько отечная, разволокненная, содержит расширенные полнокровные сосуды капиллярного типа. При окраске по Маллори выявлены рыхлые ярко-голубые коллагеновые волокна, более светлые — в месте отека. В материале также обнаружены белково-слизистые железы и жировая ткань без особенностей.
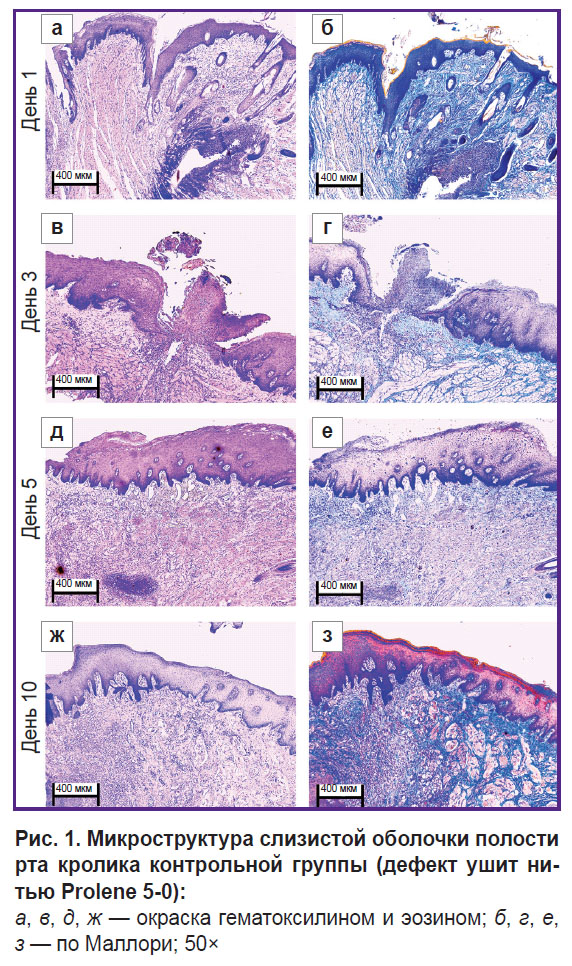
|
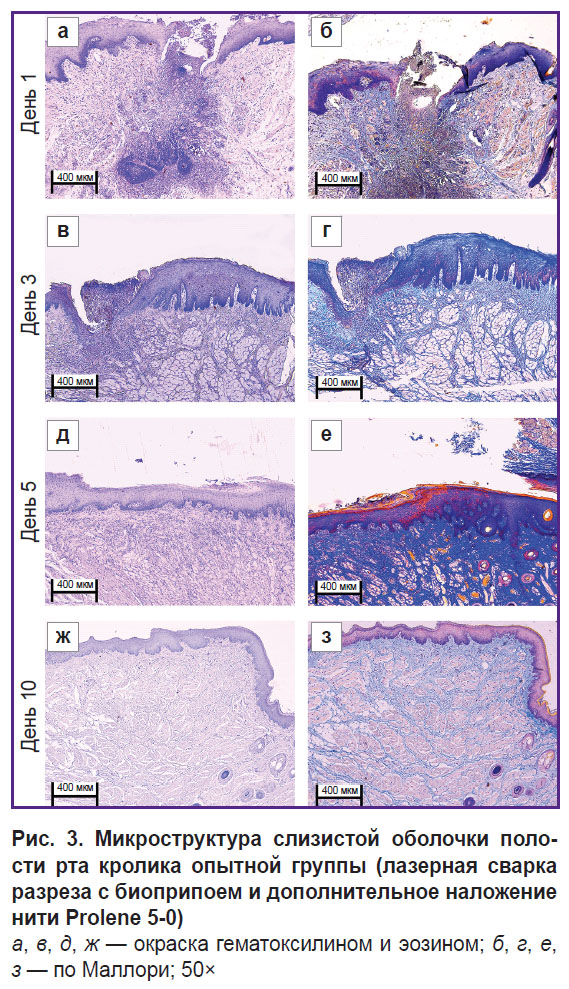
Рис. 1. Микроструктура слизистой оболочки полости рта кролика контрольной группы (дефект ушит нитью Prolene 5-0):
а, в, д, ж — окраска гематоксилином и эозином; б, г, е, з — по Маллори; 50× |
К 3-м суткам (рис. 1, в, г и рис. 2, в, г) гистологическая картина фазы воспаления раневого заживления значительно не изменилась, однако среди иммунных клеток стали обнаруживаться макрофаги.
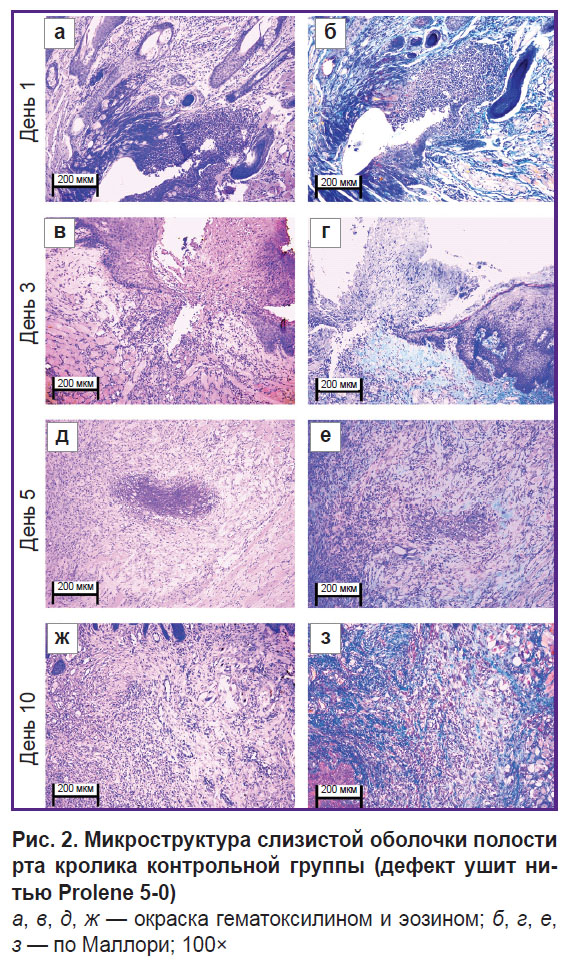
|
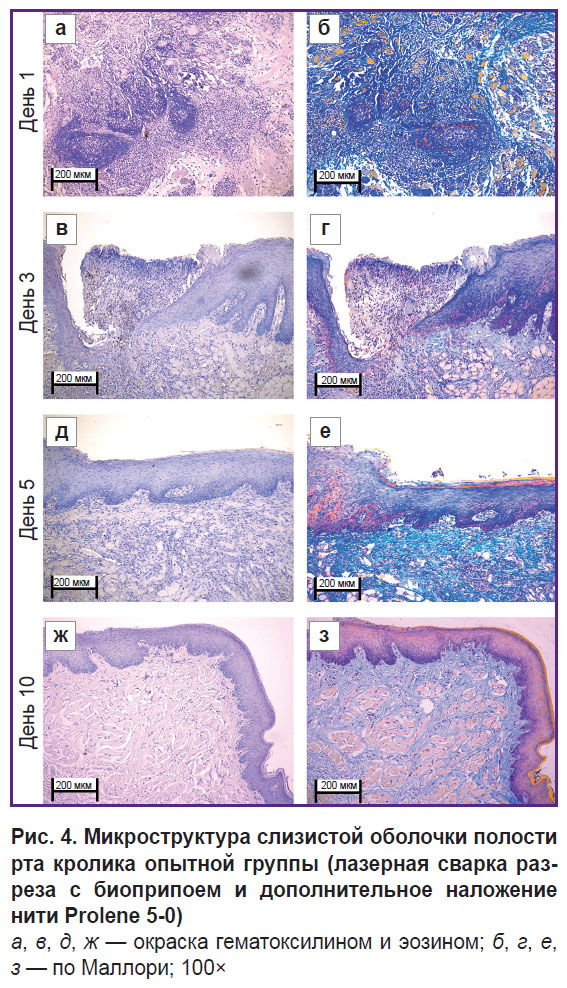
Рис. 2. Микроструктура слизистой оболочки полости рта кролика контрольной группы (дефект ушит нитью Prolene 5-0)
а, в, д, ж — окраска гематоксилином и эозином; б, г, е, з — по Маллори; 100× |
На 5-е сутки (рис. 1, д, е и рис. 2, д, е) слизистая оболочка полости рта была выстлана многослойным плоским эпителием. В одном срезе наблюдался дефект слизистой оболочки (площадь стала меньше) в области синтетической нити, окруженный умеренным количеством воспалительных клеток (макрофагов, лимфоцитов, единичных нейтрофилов). В двух срезах при целостности эпителия определялся шовный материал, окруженный макрофагами, лимфоцитами и единичными нейтрофилами. Собственная пластинка в этом месте — отечная, разволокненная, содержит полнокровные сосуды капиллярного типа (отек более локализованный). При окраске по Маллори рыхлые коллагеновые волокна собственной пластинки окрасились в ярко-голубой цвет; в отдельных зонах отека наблюдалась бледно-голубая окраска с сиреневыми включениями (миксоматоз). По сравнению с 1-ми и 3-ми сутками воспалительный отек стал меньше и локализованнее; нейтрофилы (клетки острой фазы) обнаруживались в единичном количестве.
На 10-е сутки (рис. 1, ж, з и рис. 2, ж, з) слизистая оболочка полости рта была выстлана регенерирующим многослойным плоским эпителием с признаками пролиферации базального слоя. В одном из пяти срезов наблюдался эпителизирующийся дефект слизистой; фрагментов нитей не обнаружено. Подслизистая основа содержит немногочисленные лимфоциты и сеть сосудов капиллярного типа. При окраске по Маллори выявлены рыхлые ярко-голубые коллагеновые волокна. В отличие от 1, 3 и 5-х суток отсутствуют признаки острого воспаления (нейтрофилы); эпителий — с признаками регенерации; отека не наблюдается.
В опытной группе на 1-е сутки (рис. 3, а, б и рис. 4, а, б) слизистая оболочка полости рта была выстлана многослойным плоским эпителием. В двух из пяти исследованных срезов наблюдался дефект слизистой оболочки в области синтетической нити с нарушением эпителиального покрова и наложением фибрина, окруженный валом воспалительных клеток (преимущественно нейтрофилов, а также лимфоцитов). Подслизистая основа в этом месте — отечная, разволокненная, с участками фибриноидного некроза, содержит расширенные полнокровные сосуды капиллярного типа. В материале также обнаружены белково-слизистые железы и жировая ткань без особенностей. При окраске по Маллори коллагеновые волокна собственной пластинки без дистрофических изменений имели ярко-голубой цвет, а в местах фибриноидного некроза наблюдалась гомогенизация волокон с окрашиванием их в бледно-голубой цвет. Существенных отличий от контрольного образца не обнаружено.
К 3-м суткам (рис. 3, в, г и рис. 4, в, г) воспалительная фаза раневого заживления становилась менее выраженной за счет снижения количества нейтрофилов и отсутствия отека. Отмечалась также активная эпителиализация дефектов слизистой оболочки с ростом эпителия под некротическим детритом.
На 5-е сутки (рис. 3, д, е и рис. 4, д, е) дефекты слизистой оболочки и шовный материал наблюдались не во всех срезах. В бывшем месте альтерации в собственной пластинке субэпителиально определялась клеточная соединительная ткань. При окраске по Маллори выявлены рыхлые ярко-голубые коллагеновые волокна, более интенсивно окрашенные в зоне регенерации. По сравнению с 3-ми сутками отсутствуют дефекты и какие-либо признаки острого воспаления. В контроле на 5-е сутки все еще наблюдались отек, миксоматоз, нейтрофильная инфильтрация, что резко отличает образцы двух групп.
На 10-е сутки (рис. 3, ж, з и рис. 4, ж, з) слизистая оболочка была выстлана многослойным плоским эпителием с признаками пролиферации базального слоя. Под эпителием определялась собственная пластинка — компактно упакованная рыхлая соединительная ткань, содержащая немногочисленные лимфоциты и сеть сосудов капиллярного типа (неоангиогенез). При окраске по Маллори выявлены рыхлые ярко-голубые коллагеновые волокна. В отличие от контрольной группы, в этой временнóй точке в ране после применения лазерной пайки отсутствовали какие-либо признаки воспаления, процесс раневого заживления был завершенным.
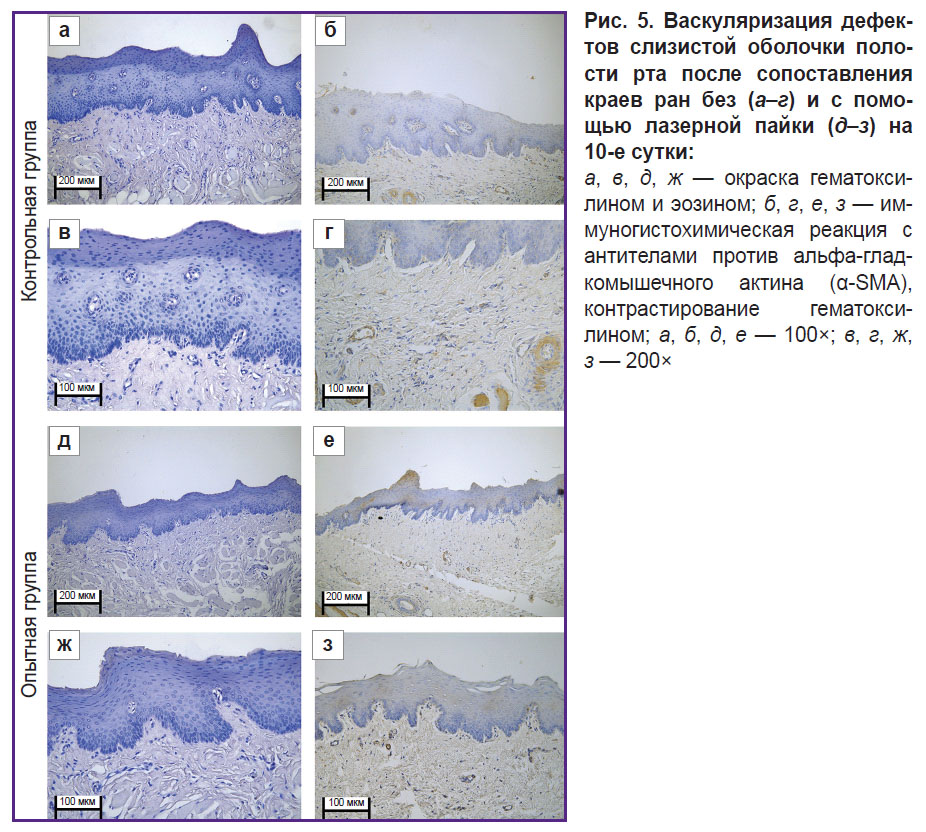
При иммуногистохимической реакции с антителами к α-SMA в контрольной группе на 10-е сутки определялась слабая экспрессия в мышечной оболочке сосудов (+). Плотность сосудов составила 320 на 1 мм2 микропрепарата (рис. 5, а–г).
При иммуногистохимической реакции с антителами к α-SMA в опытной группе определялась умеренная экспрессия в фибробластах, а также в гладких миоцитах в сосудистой стенке (++). Плотность сосудов составила 550 на 1 мм2 микропрепарата (рис. 5, д–з).
Морфометрический анализ показал, что применение лазерной пайки способствовало ускоренному завершению воспалительной фазы раневого процесса. Это проявлялось полным отсутствием признаков экссудации, инфильтрации иммунными клетками и нарушений микроциркуляции. В опытной группе воспалительная реакция завершалась уже к 5-м суткам, тогда как в контрольной группе остаточные признаки воспаления сохранялись в отдельных образцах до 10-х суток. На 10-е сутки в опытной группе отмечалось начало пролиферативной фазы: в ряде образцов наблюдалась активная пролиферация фибробластов и формирование участков рыхлой соединительной ткани с повышенной клеточностью. Кроме того, при иммуногистохимическом анализе было выявлено статистически значимое увеличение количества кровеносных сосудов в опытной группе на 70,6% по сравнению с контролем (p=0,003) (рис. 6).
Обсуждение
Предлагаемая методика лазерной сварки мягких тканей слизистой оболочки полости рта заключается в соединении краев послеоперационных ран с использованием биоприпоя и лазерного аппарата на основе диодного лазера с длиной волны 970 нм с адаптивной термостабилизацией шва. Данный проприорный лазерный аппарат оснащен системой обратной связи по температуре, которая реализуется с помощью болометрического инфракрасного матричного датчика. Датчик определяет самую горячую точку в области лазерной сварки биологических тканей и регулирует ток на лазерном диоде. Целевая температура лазерной сварки выдерживается с точностью до 1°C, что предохраняет ткани от перегрева и некроза. Для повышения прочности лазерных сварных швов нами использован биоприпой, чтобы увеличить поглощение лазерного излучения и предотвратить термический некроз тканей. Биоприпой представляет собой водную дисперсию бычьего сывороточного альбумина, индоцианина зеленого и одностенных углеродных нанотрубок. При воздействии излучением лазера на биоприпой дисперсная жидкость преобразуется в нанокомпозит, который представляет собой каркасную структуру углеродных нанотрубок в биополимерной матрице, обеспечивающих соединение краев раны и формирование прочного лазерного сварного шва. Края слизистой оболочки полости рта характеризуются большой концентрацией жидкости (слюны), поэтому нами в состав биоприпоя вводился белок — коллаген I типа, увеличивающий его вязкость до гелеобразного состояния. Это предотвращало вытекание биоприпоя из области раны.
Полученные результаты коррелируют с данными нашего предыдущего исследования, посвященного лазерной сварке кожи. Было показано [9], что при соблюдении правил сварки и точности выполнения наблюдается менее выраженная воспалительная реакция и меньшая выраженность рубца. При лазерной сварке сосудов реже возникают аневризмы. Углеродные нанотрубки в составе припоя способствуют увеличению прочности на разрыв лазерных швов. Кроме того, уменьшается длительность и трудоемкость операции.
По данным гистологического исследования, при соединении краев ран в опытной группе (лазерный шов; биоприпой из бычьего сывороточного альбумина, индоцианина зеленого, одностенных углеродных нанотрубкок и коллагена I типа; Prolene 5-0) зона операции на 1-е сутки определялась в форме очага фибриноидного некроза неправильной формы, слабое воспаление было связано с реакцией на шовную нить. В контрольной группе (хирургический шов нитью Prolene 5-0) воспалительные явления были выражены в большей степени (по сравнению с опытной группой). На 3-и сутки воспалительные явления в опытной группе были минимальны, в то время как в контрольной группе воспалительная реакция сохранялась: была нарушена эпителиализация, определялся вал воспалительных клеток (преимущественно нейтрофилов, а также лимфоцитов и макрофагов). Пролиферативные (неоангиогенез и регенерация эпителия) изменения в опытной группе были в большей степени связаны с активацией пролиферации фибробластов и эпителиоцитов вследствие воздействия лазерного излучения. Эти изменения были максимально выражены на 10-е сутки. Согласно данным иммуногистохимического исследования, применение лазерного излучения в комбинации с биоприпоем и дополнительным швом нитью Prolene 5-0 для соединения краев раны слизистой оболочки полости рта способствовало эффективному сцеплению тканей, что в дальнейшем ускорило процесс регенерации и неоангиогенез. Это является значительным преимуществом методики лазерной сварки тканей.
Заключение
Проведенное in vivo исследование показало эффективность соединения краев ран слизистой оболочки рта с помощью лазерного излучения и биоприпоя на основе бычьего сывороточного альбумина, индоцианина зеленого, одностенных углеродных нанотрубок и коллагена I типа. Предлагаемая методика позволяет избежать чрезмерного натяжения и травмирования тканей, способствует дополнительной адгезии тканей. Кроме того, лазерная сварка с биоприпоем сокращает фазу воспаления и повышает регенераторный потенциал послеоперационных тканей.
Финансирование исследования. Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, соглашение №075-15-2024-640 (Сеченовский университет).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Faris A., Khalid L., Hashim M., Yaghi S., Magde T., Bouresly W., Hamdoon Z., Uthman A.T., Marei H., Al-Rawi N. Characteristics of suture materials used in oral surgery: systematic review. Int Dent J 2022; 72(3): 278–287, https://doi.org/10.1016/j.identj.2022.02.005.
- La Rosa G.R.M., Scapellato S., Cicciù M., Pedullà E. Antimicrobial activity of antibacterial sutures in oral surgery: a scoping review. Int Dent J 2024; 74(4): 688–695, https://doi.org/10.1016/j.identj.2024.01.029.
- Дурново Е.А., Тараканова В.А. Возможности оптимизации течения раневого процесса на слизистой оболочке в полости рта с использованием фотодинамической терапии. Dental Forum 2019; 4(75): 35–36.
- Тарасенко С.В., Благушина Н.А. Гистологическая оценка использования биорезорбируемых коллагеновых мембран при закрытии раневых дефектов слизистой оболочки рта в эксперименте. Вятский медицинский вестник 2022; 1(73): 67–75.
- Шарипов И.А., Дитковский В.В., Хатомкин Д.М., Комиссарова Н.В. Узлы и швы в хирургии. Синергия наук 2022; 71: 546–563.
- Larjava H., Wiebe C., Gallant-Behm C., Hart D.A., Heino J., Häkkinen L. Exploring scarless healing of oral soft tissues. J Can Dent Assoc 2011; 77: b18.
- Chandra G.B., VinayKumar M.B., Walavalkar N.N., Vandana K.L., Vardhan P.K. Evaluation of surgical scalpel versus semiconductor diode laser techniques in the management of gingival melanin hyperpigmentation: a split-mouth randomized clinical comparative study. J Indian Soc Periodontol 2020; 24(1): 47–53, https://doi.org/10.4103/jisp.jisp_186_19.
- Блашкова С.Л., Крикун Е.В., Мустафин И.Г., Валеева И.Х., Блашкова Ю.В. Динамика клинических и иммунологических показателей при комплексном лечении эндопародонтальных поражений, включающем лазерную терапию. Казанский медицинский журнал 2021; 102(3): 322–328, https://doi.org/10.17816/KMJ2021-322.
- Gerasimenko A.Y., Morozova E.A., Ryabkin D.I., Fayzullin A., Tarasenko S.V., Molodykh V.V., Pyankov E.S., Savelyev M.S., Sorokina E.A., Rogalsky A.Y., Shekhter A., Telyshev D.V. Reconstruction of soft biological tissues using laser soldering technology with temperature control and biopolymer nanocomposites. Bioengineering (Basel) 2022; 9(6): 238, https://doi.org/10.3390/bioengineering9060238.
- Matteini P., Ratto F., Rossi F., de Angelis M., Cavigli L., Pini R. Hybrid nanocomposite films for laser-activated tissue bonding. J Biophotonics 2012; 5(11–12): 868–877, https://doi.org/10.1002/jbio.201200115.
- Ark M., Cosman P.H., Boughton P., Dunstan C.R. Photochemical tissue bonding (PTB) methods for sutureless tissue adhesion. Int J Adhes Adhes 2016; 71: 87–98, https://doi.org/10.1016/j.ijadhadh.2016.08.006.
- Judy M.M., Fuh L., Matthews J.L., Lewis D.E., Utecht R.E. Gel electrophoretic studies of photochemical cross-linking of type I collagen with brominated 1,8-naphthalimide dyes and visible light. Proc. SPIE 2128, Laser Surgery: Advanced Characterization, Therapeutics, and Systems IV 1994, https://doi.org/10.1117/12.184876.
- Judy M.M., Nosir H.R., Jackson R.W., Matthews J.L., Utecht R.E., Lewis D.E., Yuan D. Photochemical bonding of skin with 1,8-naphthalimide dyes. Proc. SPIE 3195, Laser-Tissue Interaction, Tissue Optics, and Laser Welding III 1998, https://doi.org/10.1117/12.297902.
- Merguerian P.A., Pugach J.L., Lilge L.D. Nonthermal ureteral tissue bonding: Nonthermal ureteral tissue bonding: comparison of photochemical collagen crosslinking with thermal laser bonding. Proc. SPIE 3590, Lasers in Surgery: Advanced Characterization, Therapeutics, and Systems IX 1999; https://doi.org/10.1117/12.350962.
- Mulroy L., Kim J., Wu I., Scharper P., Melki S.A., Azar D.T., Redmond R.W., Kochevar I.E. Photochemical keratodesmos for repair of lamellar corneal incisions. Invest Ophthalmol Vis Sci 2000; 41(11): 3335–3340.
- Беспалова Н.А., Дурново Е.А., Галкина Е.С., Тараканова В.А., Рунова Н.Б. Возможности клинического использования метода инфракрасной термометрии в оценке течения раневого процесса после операции вестибулопластика с использованием свободных десневых трансплантатов. Пародонтология 2020; 25(2): 127–133, https://doi.org/10.33925/1683-3759-2020-25-2-127-133.
- Ашурко И.П., Крылова Д.А., Белкин В.О., Яценко А.Г., Тарасенко С.В. Результаты применения коллагенового матрикса при менеджменте мягких тканей в области дентальных имплантатов во фронтальном отделе верхней челюсти. Проблемы стоматологии 2023; 19(4): 69–76, https://doi.org/10.18481/2077-7566-2023-19-4-69-76.
- Antoshin A., Gostev M., Khristidis Y., Giliazova A., Voloshin S., Blagushina N., Smirnova O., Diachkova E., Istranova E., Usanova A., Solodov N., Fayzullin A., Ivanova E., Sadchikova E., Vergara Bashkatova M.N., Drakina O., Tarasenko S., Timashev P. Electrophoretically co-deposited collagen-lactoferrin membranes with enhanced pro-regenerative properties for oral soft tissue regeneration. Int J Mol Sci 2023; 24(24): 17330, https://doi.org/10.3390/ijms242417330.