Разработка антропоморфной модели позвонка L1 для усовершенствования денситометрического фантома
Цель исследования — создание антропоморфной модели позвонка L1 для усовершенствования ранее разработанного фантома РСК ФК2.
Материалы и методы. Позвонок изготовлен с помощью 3D-печати по цифровой модели, полученной из DICOM-файлов КТ-сканирования брюшной полости. Конструкция фантома включает три слоя с различной рентгеновской плотностью. В основе, выполненной из фотополимерной смолы, сформировано цилиндрическое углубление, которое заполняется пластичным композитным материалом для имитации нормального состояния губчатого вещества (высокая плотность), остеопении (умеренное снижение плотности) и остеопороза (значительное снижение плотности). Минеральная плотность регулируется за счет изменения концентрации β-трикальцийфосфата в смеси. Кортикальный слой воспроизводится путем нанесения медной фольги на поверхность основы.
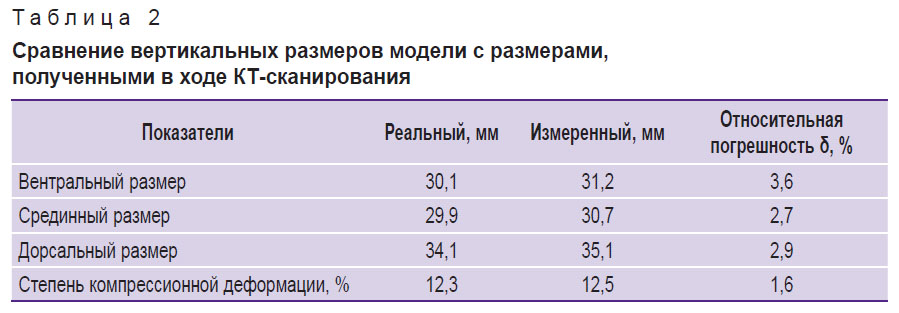
Результаты. При напряжении на трубке 120 кВ среднеквадратичные отклонения измеренных значений рентгеновской плотности тела позвонка, губчатого вещества и кортикального слоя составили 12,40; 3,96 и 57,23 HU соответственно. Оценка минеральной плотности губчатого вещества для трех напряжений на трубке (100, 120, 140 кВ) показала среднюю абсолютную погрешность 7,4 мг/мл, а среднюю относительную — 7,3% (коэффициент вариации). Для корректировки значений использовали поправочный коэффициент, равный 7 мг/мл. После его применения средняя абсолютная погрешность снизилась до 0,4 мг/мл, а средняя относительная — до 0,4% (коэффициент вариации). Относительные погрешности измерений вентрального, срединного и дорсального размеров тела позвонка составили 3,6; 2,7 и 2,9% соответственно.
Заключение. Методика, использованная при создании модели позвонка, может применяться для моделирования всего диапазона минеральной плотности губчатого вещества кости: от остеопороза до нормы. Разработанная модель демонстрирует высокую стабильность рентгенологических характеристик и анатомическую точность, поэтому может быть использована для калибровки оборудования, контроля качества диагностических систем, а также в обучении для демонстрации изменений костной структуры.
Введение
В последние годы в лучевой и инструментальной диагностике особое внимание уделяется настройке и калибровке оборудования. Корректно функционирующее устройство обеспечивает высокую надежность, точность, а также кратковременную и долговременную воспроизводимость измерений [1]. Настройку диагностической аппаратуры осуществляют с помощью фантомов, которые представляют собой специальные объекты, имитирующие анатомические структуры человеческого тела.
В условиях активного внедрения алгоритмов искусственного интеллекта (ИИ) для интерпретации медицинских изображений фантомы могут стать эффективным инструментом тестирования точности этих алгоритмов [2]. Например, при автоматическом анализе КТ-исследований с целью определения признаков остеопороза требуется высокая достоверность измерений минеральной плотности костной ткани и высоты тел позвонков [3, 4]. Фантомы позволяют создавать контролируемые условия, в которых можно оценить, насколько точно алгоритм ИИ способен проводить необходимые замеры [5].
Ранее коллективом авторов Научно-практического клинического центра диагностики и телемедицинских технологий [6, 7] был разработан фантом РСК ФК2, предназначенный для оценки точности денситометрических исследований при асинхронной количественной компьютерной томографии и двухэнергетической рентгеновской абсорбциометрии. Однако в стандартной версии РСК ФК2 позвонки имитируют простые геометрические фигуры (цилиндр и параллелепипед), что не позволяет оценить точность работы алгоритмов ИИ.
Цель данной работы — создание антропоморфной модели позвонка для усовершенствования ранее разработанного фантома РСК ФК2.
Материалы и методы
Объектом моделирования выбран позвонок L1, так как изменение минеральной плотности кости (МПК) данного позвонка является основным маркером наличия остеопороза [8]. Разработанная модель представляет собой трехслойное разборное изделие антропоморфной формы, состоящее из тела позвонка, к которому с помощью двух ножек присоединяется дужка с двумя участками (пластинами) и расположенными между ними отростками, изготовленными из фотополимерной смолы. Тело позвонка содержит полость, заполненную пластичной массой с добавлением β-трикальцийфосфата (β-ТКФ), воспроизводящей губчатое вещество кости. Собранная модель покрыта слоем медной фольги для имитации кортикального слоя позвонка.
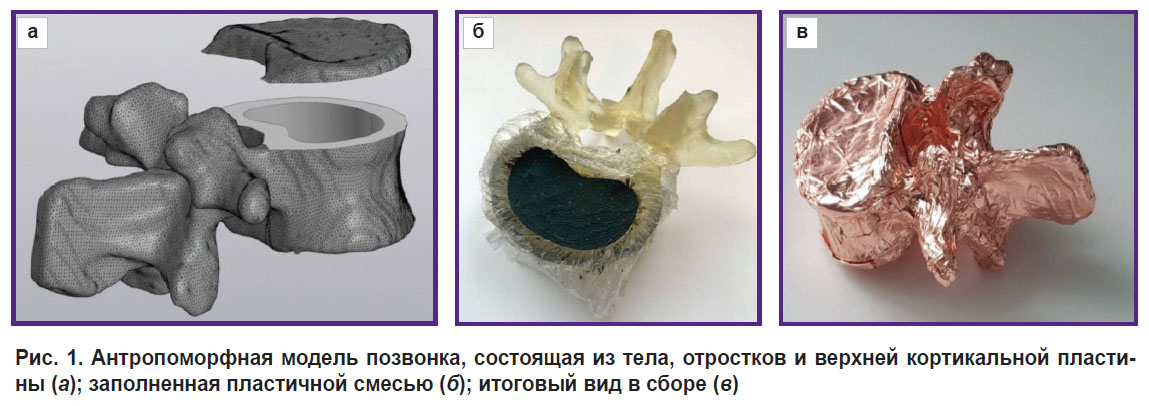
Построение 3D-модели. В качестве референса выбрано анонимизированное КТ-исследование брюшной полости. Данные импортировали в программное обеспечение 3D Slicer версии 5.2, применяли маску для разметки позвонков и сохраняли объемную модель в формате STL. После этого STL-файл импортировали в программу Компас-3D («Аскон», Россия) и формировали полигональный объект, состоящий из 78 780 треугольников. Затем данный объект преобразовывали для дальнейшей модификации и рассечения полученной модели плоскостью, перпендикулярной продольной оси позвонка, на две части, условно названные «тело позвонка» и «пластина» (рис. 1, а). Толщина пластины при этом составила от 3 до 6 мм. В теле позвонка формировали цилиндрическое углубление для заполнения эквивалентным губчатому веществу составом таким образом, чтобы минимальная толщина стенки равнялась 3 мм. Для обеспечения соединения с натягом на нижней поверхности пластины создавали выступ высотой 1,5 мм. В программе Meshmixer (Autodesk, США) проверяли полученную модель и исправляли ошибки.
|
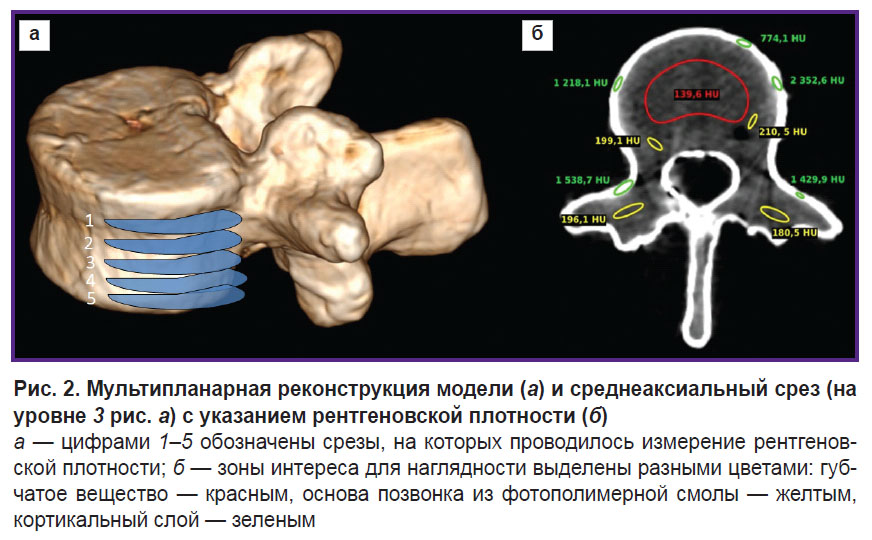
Рис. 1. Антропоморфная модель позвонка, состоящая из тела, отростков и верхней кортикальной пластины (а); заполненная пластичной смесью (б); итоговый вид в сборе (в) |
Изготовление основы модели. Тело позвонка и пластина были изготовлены методом LCD-печати из фотополимерной смолы на принтере Elegoo Saturn 2 (Shenzhen Elegoo Technology Co., Китай). Время параллельной печати обеих моделей составило 5,5 ч. Неотвержденные остатки смолы удаляли этиловым спиртом. После очистки детали облучали в УФ-печи.
Имитация губчатого вещества. Губчатое вещество тела позвонка имитировали с помощью смеси композитного пластилина и β-ТКФ, содержащего Ca3(PO4)2 с чистотой более 98% (Sigma-Aldrich, США). Эта смесь является эквивалентом гидроксиапатита костной ткани. Преимущество данного метода заключается в возможности изменения заданной минеральной плотности губчатого вещества путем изготовления набора заменяемых вкладышей с различной концентрацией β-ТКФ.
В качестве основы выбран композит, включающий следующие компоненты (максимально приближенные к природному составу губчатого вещества кости): крахмал (органическая составляющая), церезин и парафин (жировые составляющие), а также парафиновое масло.
Выбрано целевое значение МПК — 100 мг/мл, что соответствует состоянию остеопении по критериям ACR 2023 [9]. В программе Компас-3D вычислен объем углубления в теле позвонка (объем губчатого вещества) — 17,4 мл. Экспериментально определили плотность пластичного композита, которая составила 1,25 г/мл, а также насыпную плотность β-ТКФ — 1,33 г/мл.
Приготовлено 18 мл смеси с массовой концентрацией β-ТКФ 8%. Процесс приготовления включал следующие этапы: композит разогревали на водяной бане, затем разделяли на 4 равные части и каждую часть перемешивали отдельно с β-ТКФ в течение 10 мин, после чего все части соединяли в единую массу. Итоговая плотность смеси составила 1,22 г/мл.
Соединение частей фантома. В качестве оболочки заменяемого вкладыша использовали пищевую полиэтиленовую пленку, которую проложили между смолой и композитом. Заполнение углубления в теле позвонка проводили в емкости с дистиллированной водой. В нее погружали все составляющие, тщательно утрамбовывали пластичную смесь и извлекали модель из жидкости (рис. 1, б). Это позволило предотвратить попадание пузырьков воздуха внутрь фантома. Затем позвонок закрыли пластиной и обклеили медной фольгой (рис. 1, в).
Сканирование созданной модели проводили на компьютерном томографе Revolution EVO (General Electric, США). Параметры сканирования: напряжение — 80, 100, 120, 140 кВ; сила тока — 200 мА; толщина среза — 0,62 мм; доза облучения — 10,14 мГр. Позвонок помещали внутрь емкости с водой для снижения эффекта усиления жесткости луча [10] и создания условий поглощения рентгеновского излучения, близких к аналогичным в теле человека.
Мультипланарную реконструкцию модели позвонка выполняли в программе RadiAnt DICOM Viewer (Medixant, Польша) (рис. 2, а).
Полученные КТ-изображения анализировали с помощью программного обеспечения Weasis DICOM Viewer. Измеряли среднюю рентгеновскую плотность (РП) трех слоев модели по шкале Хаунсфилда (HU) в трех взаимно-перпендикулярных плоскостях на пяти срезах (рис. 2, б).
Для губчатого вещества выполнено сравнение заданной МПК с расчетными значениями, полученными с учетом независимых асинхронных калибровочных кривых для фантома РСК ФК2. По этим данным вычисляли среднее значение µ и среднеквадратическое отклонение (СКО) σ:
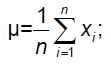
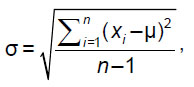
где xi — это измеренные значения для i-го измерения, n — общее число измерений.
Степень компрессионной деформации позвонка определяли в программе RadiAnt DICOM Viewer (Medixant, Польша) путем измерения вертикальных размеров (вентральный, срединный и дорсальный) тела позвонка в сагиттальной проекции.
Истинные размеры модели измеряли при помощи штангенциркуля с глубиномером 250 мм MATRIX 316335 (Россия). Затем проводили сравнение полученных размеров с истинными и определяли относительную погрешность 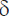 по формуле:
по формуле:
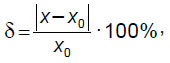
где х0 — реальный размер модели, х — размер, измеренный в программе RadiAnt DICOM Viewer.
Степень компрессионной деформации по классификации Genant характеризуется индексом G, определяемым по формуле [11]:
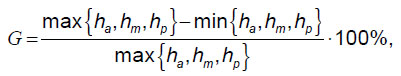
где ha — вентральный размер позвонка, hm — срединный размер позвонка, hp — дорсальный размер позвонка.
Результаты
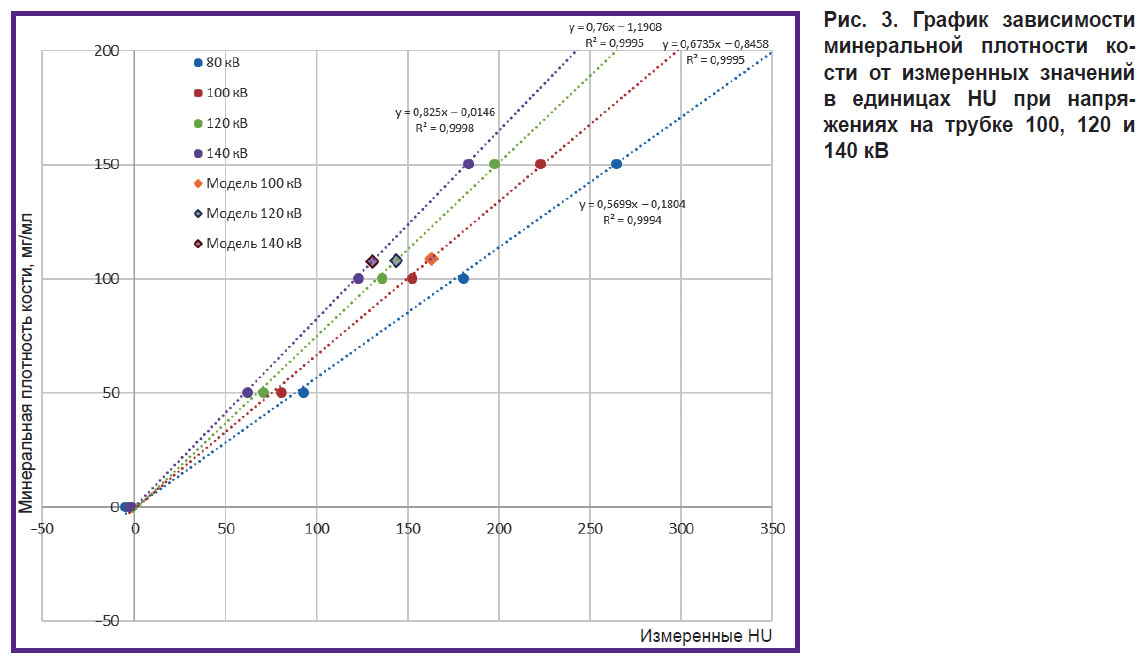
На рис. 3 представлен график зависимости МПК от измеренных значений в единицах HU, полученный при различных значениях напряжения на трубке.
|
Рис. 3. График зависимости минеральной плотности кости от измеренных значений в единицах HU при напряжениях на трубке 100, 120 и 140 кВ |
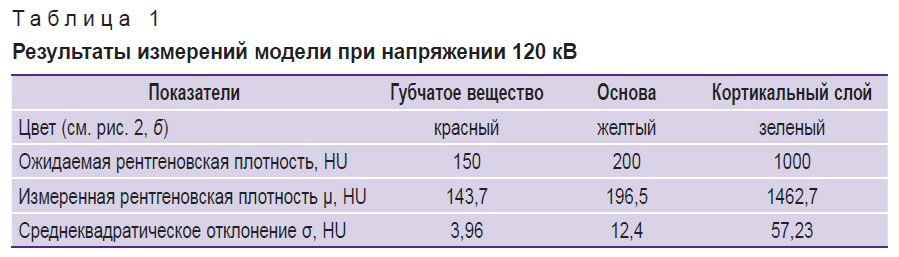
Значения РП всех слоев модели и ожидаемые показатели РП приведены в табл. 1.
|
Таблица 1. Результаты измерений модели при напряжении 120 кВ |
Усредненные значения РП губчатого вещества составили 154,4±41,9; 162,9±18,8; 143,7±12,8; 130,6±11,0 HU (среднее значение ± СКО по результатам измерений) для напряжений на рентгеновской трубке 80, 100, 120 и 140 кВ соответственно. Учитывая значительную величину СКО и наличие артефактов от металлической фольги, для дальнейшего анализа измерения при 80 кВ не учитывали. СКО измеренных значений РП тела позвонка, губчатого вещества и кортикального слоя при напряжении на трубке 120 кВ составили 12,40; 3,96 и 57,23 HU соответственно. Средняя абсолютная погрешность определения минеральной плотности губчатого вещества для трех напряжений на трубке (100, 120, 140 кВ) составила 7,4 мг/мл, средняя относительная — 7,3% (коэффициент вариации). Поправочный коэффициент для пересчета минеральной плотности — 7 мг/мл. Средняя абсолютная погрешность с учетом поправочного коэффициента — 0,4 мг/мл, средняя относительная — 0,4% (коэффициент вариации).
Данные сравнения вертикальных размеров разработанной модели приведены в табл. 2.
|
Таблица 2. Сравнение вертикальных размеров модели с размерами, полученными в ходе КТ-сканирования |
Обсуждение
В ходе исследования разработана модель позвонка L1 со значениями РП, сопоставимыми с соответствующими показателями реального позвонка человека. Предлагаемый подход может быть использован для создания фантома всего позвоночника или его части. Использование позвонков антропоморфной формы позволит усовершенствовать конструкцию денситометрического фантома РСК ФК2.
В литературных источниках имеется информация о нескольких тест-объектах, которые содержат позвонки [12–16]. Наиболее близким аналогом является Hologic DPA/QDR-1 Anthropomorphic Spine Phantom [13], предназначенный для калибровки аппаратов при проведении двухэнергетической рентгеновской денситометрии. Он состоит из антропоморфных моделей поясничных позвонков L1–L4, которые изготовлены из гидроксиапатита кальция, моделирующего значение МПК 1,02 г/см2. В качестве окружающий среды, имитирующей мягкие ткани с содержанием жира 60%, используется эпоксидная смола. Однако по сравнению с РСК ФК2 у аналога отсутствует диапазон значений МПК, поэтому он непригоден для кросс-калибровки. Еще одним недостатком является то, что конфигурация позвонков и среда вокруг них не подлежат изменению, поэтому невозможно моделировать различные условия сканирования и поглощения рентгеновского излучения.
На рынке также представлен Hologic Anthropomorphic Spine Phantom (HolxASP(v2)), являющийся улучшенной версией предыдущего прототипа [17]. Фантом выполнен из четырех позвонков L1–L4 из литого алюминия (моделирующего значение МПК 1,009 г/см2), помещенных в пластиковый бокс. Недостатки данной модели аналогичны тем, которые выявлены и у первой версии прототипа.
Отметим, что в открытых источниках не приводятся сведения об основных этапах создания позвонков, поэтому настоящая работа обладает высокой актуальностью. Фантом, изготовленный с применением разработанной модели позвонка, будет значительно отличаться от существующих аналогов. Преимущество заключается в возможности моделирования всего диапазона МПК губчатого вещества: от остеопороза до нормы; конфигурацию позвонков и состав окружающей их среды можно легко изменить при необходимости. C помощью предлагаемого фантома возможны проведение кросс-калибровки рентгеновских денситометров, обучение систем ИИ автоматическому измерению РП губчатого вещества и расчет степени компрессионной деформации тел позвонков [2]. Зная истинный размер моделей позвонка, можно определять точность их детектирования алгоритмами ИИ на DICOM-изображениях.
К ограничениям использования разработанной модели можно отнести:
отсутствие возможности точного моделирования РП кортикального слоя ввиду сложностей в подборе материала и, как следствие, большое отклонение значения РП данной области при сканировании;
условность разделения тела позвонка на основу и губчатое вещество, поскольку реконструкция проводилась вручную, без соблюдения точной анатомии строения конкретного позвонка;
выраженные артефакты от использования металлической фольги.
В дальнейшем авторы планируют улучшить тест-объект и устранить указанные недостатки.
Разработанная методика позволяет моделировать позвонок L1. В будущем ее можно адаптировать для создания других позвонков шейного, грудного, поясничного, крестцового и копчикового отделов позвоночника.
Заключение
В работе предложена методика изготовления модели позвонка L1 для усовершенствования ранее разработанного денситометрического фантома РСК ФК2. Результаты КТ-сканирования представленной модели подтвердили соответствие измеренных показателей РП и размеров ожидаемым. Интеграция антропоморфного позвонка с предыдущей версией фантома позволит превзойти существующие аналоги и может найти широкое применение при создании новых методов денситометрической диагностики и для контроля их качества.
Финансирование. Данная статья подготовлена авторским коллективом в рамках НИОКР «Разработка и создание аппаратно-программного комплекса для оппортунистического скрининга остеопороза» (№ЕГИСУ: 123031400007-7) в соответствии с Приказом от 21.12.2022 г. №1196 «Об утверждении государственных заданий, финансовое обеспечение которых осуществляется за счет средств бюджета города Москвы государственным бюджетным (автономным) учреждениям, подведомственным Департаменту здравоохранения города Москвы, на 2023 год и плановый период 2024 и 2025 годов» Департамента здравоохранения города Москвы.
Конфликт интересов отсутствует.
Литература
- Хоружая А.Н., Ахмад Е.С., Семенов Д.С. Роль системы контроля качества лучевой диагностики онкологических заболеваний в радиомике. Digital Diagnostics 2021; 2(2): 170–184, https://doi.org/10.17816/DD60393.
- Артюкова З.Р., Петряйкин А.В., Кудрявцев Н.Д., Петряйкин Ф.А., Семенов Д.С., Шарова Д.Е., Белая Ж.Е., Владзимирский А.В., Васильев Ю.А. Опыт применения сервисов искусственного интеллекта для диагностики компрессионных переломов тел позвонков по данным компьютерной томографии: от тестирования до апробации. Digital Diagnostics 2024; 5(3): 505–518, https://doi.org/10.17816/DD624250.
- Артюкова З.Р., Кудрявцев Н.Д., Петряйкин А.В., Абуладзе Л.Р., Сморчкова А.К., Ахмад Е.С., Семенов Д.С., Беляев М.Г., Белая Ж.Е., Владзимирский А.В., Васильев Ю.А. Применение алгоритма искусственного интеллекта для оценки минеральной плотности тел позвонков по данным компьютерной томографии. Медицинская визуализация 2023; 27(2): 125–137, https://doi.org/10.24835/1607-0763-1257.
- Петряйкин А.В., Белая Ж.Е., Беляев М.Г., Захаров А.А., Бухараев А.Н., Бобровская Т.М., Кудрявцев Н.Д., Семенов Д.С., Ахмад Е.С., Артюкова З.Р., Абуладзе Л.Р., Сморчкова А.К., Васильев Ю.А. Точность автоматической диагностики компрессионных переломов тел позвонков по данных морфометрического алгоритма искусственного интеллекта. Остеопороз и остеопатии 2022; 25(3): 92–93, https://doi.org/10.14341/osteo13064.
- Артюкова З.Р., Кудрявцев Н.Д., Абуладзе Л.Р., Ахмад Е.С., Семенов Д.С. Практическое применение фантома для автоматизированной оценки минеральной плотности кости. Остеопороз и остеопатии 2022; 25(3): 10–11, https://doi.org/10.14341/osteo12974.
- Петряйкин А.В., Смолярчук М.Я., Петряйкин Ф.А., Низовцова Л.А., Артюкова З.Р., Сергунова К.А., Ахмад Е.С., Семенов Д.С., Владзимирский А.В., Морозов С.П. Оценка точности денситометрических исследований. Применение фантома РСК ФК2. Травматология и ортопедия России 2019; 25(3): 124–134, https://doi.org/10.21823/2311-2905-2019-25-3-124-134.
- Морозов С.П., Сергунова К.А., Петряйкин А.В., Семенов Д.С., Петряйкин Ф.А., Ахмад Е.С., Низовцова Л.А., Владзимирский А.В. Устройство фантома для проведения испытаний рентгеновских методов остеоденситометрии. Патент RU186961 U1. 2018.
- Pickhardt P.J., Lee S.J., Liu J., Yao J., Lay N., Graffy P.M., Summers R.M. Population-based opportunistic osteoporosis screening: validation of a fully automated CT tool for assessing longitudinal BMD changes. Br J Radiol 2019; 92(1094): 20180726, https://doi.org/10.1259/bjr.20180726.
- The American College of Radiology. ACR–SPR–SSR practice parameter for the performance of quantitative computed tomography tQCT) bone mineral density. 2023. URL: https://gravitas.acr.org/PPTS/GetDocumentView?docId=11.
- Громов А.И., Петряйкин А.В., Кульберг Н.С., Ким Ю.С., Морозов С.П., Сергунова К.А., Усанов М.С. Проблема точности денситометрических показателей в современной многослойной компьютерной томографии. Медицинская визуализация 2016; 6: 133–142.
- Roth H.R., Wang Y., Yao J., Lu L., Burns J.E., Summers R.M. Deep convolutional networks for automated detection of posterior-element fractures on spine CT. Medical Imaging 2016: Computer-Aided Diagnosis 2016; 9785: 97850P, https://doi.org/10.1117/12.2217146.
- Kalender W.A., Felsenberg D., Genant H.K., Fischer M., Dequeker J., Reeve J. The European Spine Phantom — a tool for standardization and quality control in spinal bone mineral measurements by DXA and QCT. Eur J Radiol 1995; 20(2): 83–92, https://doi.org/10.1016/0720-048x(95)00631-y.
- Pearson D., Cawte S.A., Green D.J. A comparison of phantoms for cross-calibration of lumbar spine DXA. Osteoporos Int 2002; 13(12): 948–954, https://doi.org/10.1007/s001980200132.
- Arnold B.A., Xiang P., Budoff M.J., Mao S.S. Very small calcifications are detected and scored in the coronary arteries from small voxel MDCT images using a new automated/calibrated scoring method with statistical and patient specific plaque definitions. Int J Cardiovasc Imaging 2012; 28(5): 1193–1204, https://doi.org/10.1007/s10554-011-9914-2.
- Kweon D.C., Kim E.H., Shim D.O., Dong K.R., Kim H.S., Goo E.H., Chung W.K. Assessment of the effect of bone density and soft tissue thickness on phantom measurements. J Korean Phys Soc 2010; 5(57): 1263–1269, https://doi.org/10.3938/jkps.57.1263.
- Islamian J.P., Garoosi I., Fard K.А., Abdollahi M.R. Comparison between the MDCT and the DXA scanners in the evaluation of BMD in the lumbar spine densitometry. Egypt J Radiol Nucl Med 2016; 47(3): 961–967, https://doi.org/10.1016/j.ejrnm.2016.04.005.
- Park A.J., Choi J.H., Kang H., Park K.J., Kim H.Y., Kim S.H., Kim D.Y., Park S.H., Ha Y.C. Result of proficiency test and comparison of accuracy using a European spine phantom among the three bone densitometries. J Bone Metab 2015; 22(2): 45–49, https://doi.org/10.11005/jbm.2015.22.2.45.