Изучение влияния биопокрытия роговицы на основе оригинального гидрогелевого биополимерного скаффолда на структуры переднего отрезка глаза в эксперименте
В последние годы были предложены различные виды биоинженерных конструкций скаффолдов — биоматериальных структур, служащих субстратом для восстановления и регенерации тканей. Они обладают выраженной биосовместимостью, способны поддерживать высокую концентрацию доставляемых веществ в поврежденных тканях, а также могут быть стандартизованы в процессе изготовления.
Цель исследования — оценить безопасность и изучить влияние биопокрытия на основе оригинального гидрогелевого биополимерного скаффолда на неповрежденные структуры переднего отрезка глаза и его придаточного аппарата в эксперименте.
Материалы и методы. Экспериментальное исследование было проведено на 6 кроликах (6 глаз). В качестве биопокрытия роговицы использовали оригинальный гидрогелевый биополимерный скаффолд диаметром 10,0 мм, толщиной 1,5 и 2,0 мм. На 3, 7 и 9-е сутки от начала эксперимента выполняли гистологическую оценку результатов.
Результаты. На 3-е и 7-е сутки эксперимента гистологические исследования препаратов глаз кроликов не выявили структурных изменений переднего отрезка глаза и отличий между скаффолдами разной толщины. Во всех случаях наблюдалась равномерная эпителизация роговицы. Строма, десцеметова мембрана, эндотелий, общая топография межклеточного матрикса не были изменены. На 9-е сутки в эксперименте со скаффолдом толщиной 1,5 мм структурные изменения переднего отрезка глаза также не были выявлены. При гистологическом исследовании образца со скаффолдом толщиной 2,0 мм отмечены изменения в виде утолщения эпителия, признаков псевдорядности базального слоя, гиперплазии слоя крыловидных клеток с увеличением количества его слоев, увеличения количества клеточных элементов в передних слоях стромы, без структурных изменений десцеметовой мембраны и эндотелия роговицы.
Заключение. Использованное биопокрытие на основе гидрогелевого скаффолда подвергается самостоятельной биодеградации без последствий для глазного яблока и его придаточного аппарата. Увеличение толщины биопокрытия приводит к замедлению его биодеградации и усилению активности пролиферативных процессов в эпителии и передних слоях стромы, что косвенно свидетельствует о повышении регенераторных свойств данных тканей.
Введение
По данным Всемирной организации здравоохранения, минимум 2,2 млрд людей страдают нарушением зрения и слепотой, при этом патология роговицы встречается у 4,2 млн человек [1]. В Российской Федерации заболевания роговицы составляют 5,9% всех причин слабовидения и слепоты среди взрослого населения [2].
Этиология поражений роговицы многообразна и включает в себя широкий спектр инфекционных, воспалительных, дистрофических, нейротрофических, аутоиммунных заболеваний, проявлений первичной и вторичной лимбальной недостаточности, а также травмы и ожоги. Многие поверхностные дефекты роговицы поддаются стандартным методам консервативного лечения с благоприятным зрительным исходом. Однако проблема замедленной реэпителизации роговицы остается одной из актуальных в современной офтальмологии и может сопровождаться присоединением вторичной инфекции, изъязвлением и перфорацией роговицы, ее васкуляризацией, формированием стойких помутнений и, как следствие, значительным снижением зрения и слепотой [3–5].
С целью стимуляции и ускорения заживления тканей в различных областях регенеративной медицины, в том числе и в офтальмологии, применяют производные крови в виде тромбоцитарных препаратов, которые стимулируют репаративные процессы в поврежденных тканях и обладают выраженным противовоспалительным эффектом [6–8]. Однако для поддержания концентрации биологически активных веществ на глазной поверхности и достижения стабильного терапевтического эффекта необходимы частые инстилляции препарата.
Множество исследований посвящено применению амниотической мембраны в качестве биологического покрытия роговицы. Трансплантация амниотической мембраны способствует эпителизации дефектов роговицы, поскольку эта мембрана служит базальной мембраной для роста эпителиальных клеток; обеспечивает эпителий факторами роста и цитокинами, стимулируя адгезию и дифференцировку клеток и уменьшая апоптоз кератоцитов [9–12]. Однако данный материал труден в заготовке, требует дорогостоящих обследований доноров на наличие инфекций. Кроме того, он недоступен на отечественном рынке в качестве медицинского продукта.
В последние годы были предложены различные виды биоинженерных конструкций скаффолдов — структур, служащих субстратом и направляющей для восстановления и регенерации тканей. Такие скаффолды обладают высокой биосовместимостью, способны поддерживать высокую концентрацию доставляемых в поврежденные ткани веществ, а также, по сравнению с амниотической мембраной, могут быть стандартизованы в процессе изготовления [13].
Одной из функций скаффолдов является создание среды, имитирующей естественный внеклеточный матрикс (ВКМ). Гидрогелевые скаффолды обладают самоподдерживающейся вязкоупругой сетчатой 3D-структурой и биологической активностью, что позволяет образовывать адгезивные комплексы между клетками и ВКМ. Наличие подобных свойств стало поводом для оценки возможности использования гидрогелевого скаффолда в лечении заболеваний глаз, связанных с длительно существующими незаживающими дефектами роговичной поверхности. Данная тема практически не представлена в литературе, что требует отдельных исследований по оценке безопасности подобного способа лечения.
Цель исследования — изучить влияние биопокрытия роговицы на основе оригинального гидрогелевого биополимерного скаффолда на неповрежденные структуры переднего отрезка глаза и его придаточного аппарата в эксперименте.
Материалы и методы
Экспериментальное исследование проведено на 6 кроликах (6 глаз) породы шиншилла массой тела 2,5–3,0 кг. Работа выполнена в соответствии с Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.).
Объектом изучения было биопокрытие на основе оригинального гидрогелевого биополимерного скаффолда. Скаффолд разработан в Приволжском исследовательском медицинском университете [14]. Для формирования скаффолдов использовали композит на основе криопреципитата плазмы крови человека с пэгилироваными белками. К пэгилированному криопреципитату добавляли 2% раствор коллагена (коллаген, выделенный из шкур трески [15]), pH=7,2–7,4. Формирование скаффолда проводили в условиях ферментативного гидролиза. Для полимеризации композита в него добавляли тромбин-кальциевую смесь: 80 МЕ/мл тромбина в 1% растворе CaCl2. После формирования скаффолды помещали в чашки Петри с физиологическим раствором с целью предотвращения пересыхания гидрогеля. До момента использования скаффолды хранили при температуре 2–8°С.
До начала эксперимента животные были разделены на 2 группы: в первой группе использовали скаффолд толщиной 1,5 мм (3 кролика, 3 глаза), во второй — скаффолд толщиной 2,0 мм (3 кролика, 3 глаза). Выбор разной толщины скаффолда был связан с необходимостью оценки скорости его биодеградации на интактной роговичной поверхности. У всех экспериментальных животных до старта исследования офтальмологический статус не был изменен.
Оперативное лечение проводили с соблюдением правил асептики и антисептики в условиях медикаментозного сна с выполнением подкожной инъекции 0,1% раствором атропина сульфата, внутримышечной — раствора Золетила в дозировках, пропорциональных массе тела животного; местно использовали инстилляции Инокаина. После стандартной обработки операционного поля, проведения эпибульбарной анестезии и установки векорасширителя удаляли третье веко. Из гидрогелевого биополимерного скаффолда трепаном выкраивали диск диаметром 10,0 мм и фиксировали его к роговице правого глаза кролика четырьмя узловыми швами нитью Prolene 10-0 для предупреждения смещения (рис. 1). Операцию завершали простой блефарорафией двумя П-образными швами нитью Mersilene 5-0. Левый глаз кролика оставался интактным.
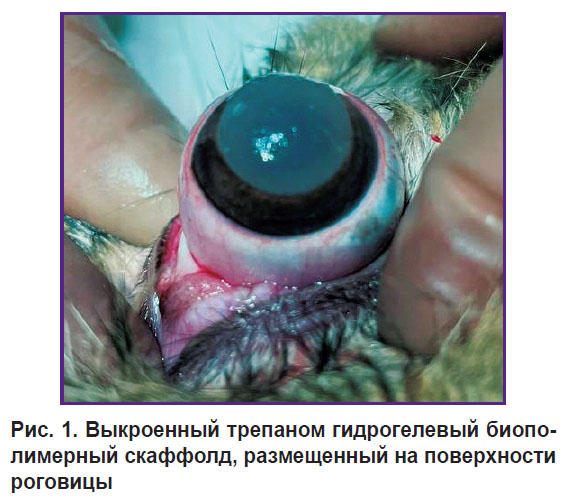
|
Рис. 1. Выкроенный трепаном гидрогелевый биополимерный скаффолд, размещенный на поверхности роговицы |
В послеоперационном периоде ежедневно проводили инстилляции 0,5% раствором левофлоксацина 2 раза в день в целях профилактики присоединения вторичной инфекции. Ежедневно клинически оценивали выраженность воспалительной реакции со стороны придаточного аппарата и видимых структур переднего отрезка глаза.
На 3, 7 и 9-е сутки от начала эксперимента проводили гистологическую оценку. После вывода животных из эксперимента и экзентерации оперированных глаз полученный материал фиксировали в 10% растворе нейтрального формалина, промывали проточной водой, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Выполняли серии гистологических срезов с окраской гематоксилином и эозином. Препараты изучали под микроскопом Leica DM LВ2 (Leica, Германия) при увеличении 50, 100, 200, 400 и 630 с последующей фоторегистрацией на слайдсканере Leica Aperio CS2 (Leica, США).
Результаты
Биомикроскопия. После операции в течение всего периода наблюдения веки оставались спокойными, видимые участки конъюнктивы были бледно-розовыми, роговица и глубжележащие структуры не визуализировались из-за проведенной блефарорафии.
На 3-и сутки от начала эксперимента на просматриваемых участках роговицы скаффолд присутствовал в глазах всех экспериментальных животных. На 7-е сутки визуализировалась биодеградация скаффолдов толщиной 1,5 и 2,0 мм и наблюдалось вымывание их фрагментов из конъюнктивальной полости в виде тяжей белого цвета во время закапывания антибиотика. На 9-е сутки эксперимента при осмотре видимых структур переднего отрезка глаза структуры скаффолда не просматривались. По этой причине животные были выведены из эксперимента на 9-е сутки.
Таким образом, за время клинического наблюдения за глазами экспериментальных животных не было отмечено негативного действия биопокрытия на структуры переднего отрезка глаза и придаточного аппарата. Признаки инфицирования конъюнктивальной полости не наблюдались, гнойное отдаляемое отсутствовало.
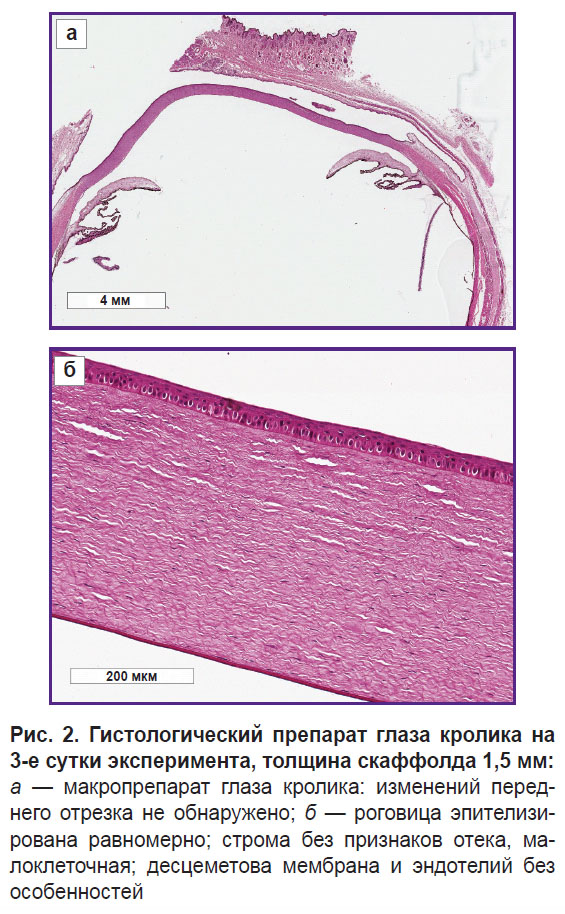
Гистологическое исследование. Гистологическое исследование препаратов глаз кроликов на 3-и сутки эксперимента не выявило структурных изменений переднего отрезка глаза на фоне аппликаций скаффолдами толщиной 1,5 и 2,0 мм. Роговица на всем протяжении имела одинаковую толщину, была равномерно эпителизирована, без изменений структуры стромы, десцеметовой мембраны и эндотелия, общая топография ВКМ не была изменена (рис. 2).
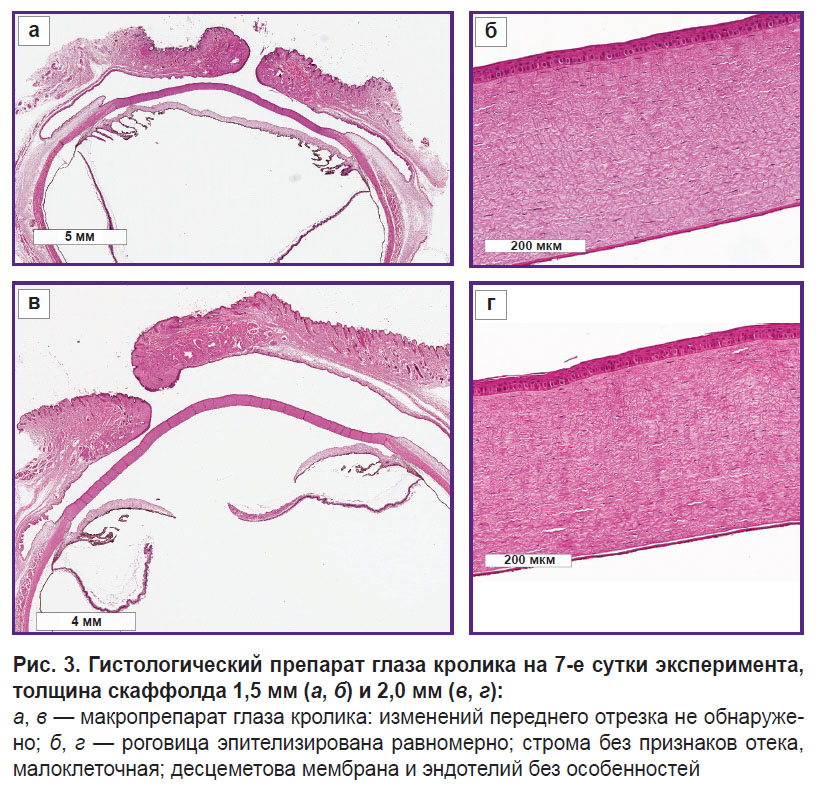
На 7-е сутки эксперимента гистологические исследования также не выявили структурных изменений переднего отрезка глаза в обеих исследуемых группах (рис. 3).
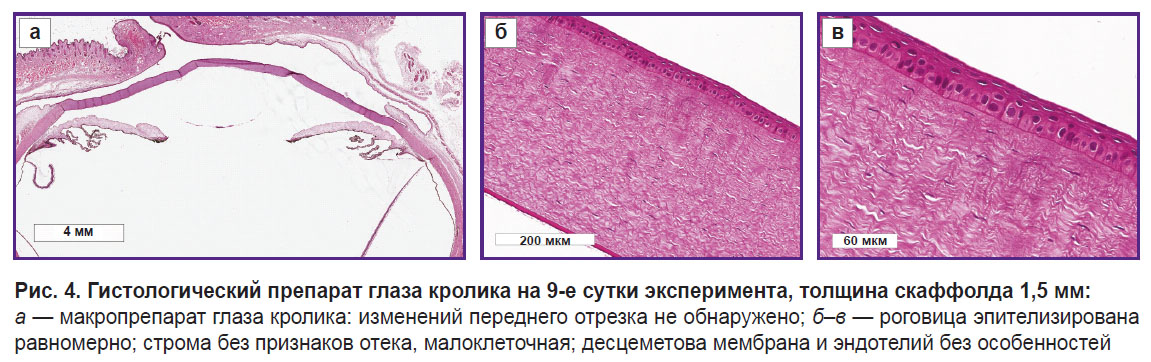
На 9-е сутки эксперимента гистологическое исследование препаратов глаза кроликов со скаффолдом толщиной 1,5 мм не выявило структурных изменений переднего отрезка (рис. 4).
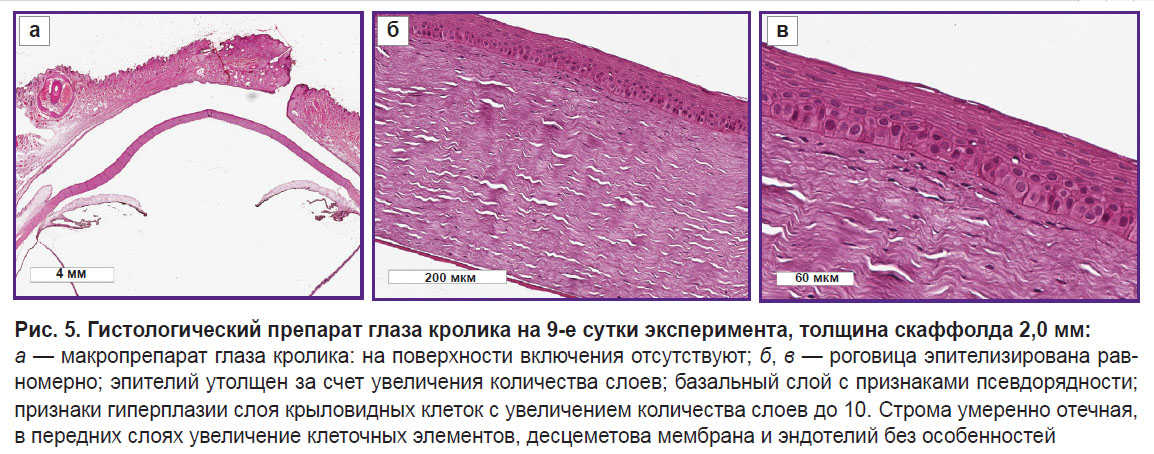
После гистологической проводки следов скаффолда на глазной поверхности во 2-й группе на 9-е сутки эксперимента не обнаружено, однако отмечены изменения переднего эпителия и передних слоев стромы роговицы. Эпителий роговицы был утолщен за счет увеличения количества его слоев: базальный слой имел признаками псевдорядности, наблюдались признаки гиперплазии слоя крыловидных клеток с увеличением количества слоев до 10. Строма была умеренно отечной с признаками увеличения клеточных элементов в передних слоях; десцеметова мембрана и эндотелий — без особенностей (рис. 5).
При вырезке материала со скаффолдом толщиной 2,0 мм на поверхности роговой оболочки и в конъюнктивальной полости были обнаружены белые матовые артифициальные скопления — остатки биополимерного материала, подвергшегося биодеградации (рис. 6).

|
Рис. 6. Макрокропрепарат с остатками биополимерного материалав конъюнктивальной полости (указано стрелкой) |
Обсуждение
Основными структурообразующими белками оригинального гидрогелевого скаффолда являются фибриноген/фибрин и коллаген I типа [16]. Эти адгезивные пептиды могут активировать рецепторы интегринов на поверхности клеток, связываться с белками ВКМ или растворимыми внеклеточными лигандами.
Коллаген I типа является преобладающим коллагеном в большинстве тканей у животных высшего порядка и наиболее часто используется в медицине. Он состоит из двух α1-цепей и одной α2-цепи с диаметром фибрилл 50 нм [17]. В структуре роговицы коллаген I типа составляет 80–90% фибриллярного коллагена кератоцитов [18]. Коллагены являются преимущественным компонентом ВКМ и базальных мембран во всех соединительных тканях, в том числе и в роговице. Кроме этой основной каркасной функции, коллагены способны взаимодействовать со специфическими рецепторами на поверхности клеток, влияя на многочисленные клеточные процессы, включая клеточную адгезию, миграцию, дифференцировку, пролиферацию [19]. Коллагены также участвуют в захвате, хранении и доставке факторов роста и цитокинов, что делает их идеальными для создания систем транспортировки лекарств и факторов роста. Благодаря упомянутым рецепторным взаимодействиям, функциям хранения и доставки, коллаген играет ведущую роль в заживлении ран и регенерации тканей [20]. Коллаген I типа обладает высокой биосовместимостью и способностью к биодеградации под действием эндогенных коллагеназ. Некоторые продукты распада экзогенного коллагена I–III типов вызывают хемотаксис фибробластов человека. В свою очередь подобная деградация способствует восстановлению структуры и функций тканей [21].
Известно, что плазма крови, которая легла в основу представленного композита скаффолда, содержит аминокислоты, необходимые для роста и пролиферации клеток вместе с некоторыми из ключевых белков ВКМ, такими как фибриноген и фибронектин [22]. Фибронектин представляет собой адгезивный гликопротеин, присутствующий в слезной жидкости, базальной мембране эпителия роговицы и конъюнктивы. Он играет важную роль в клеточной миграции, действуя как временная матрица, по которой мигрируют эпителиальные клетки в процессе регенерации дефекта эпителия.
Несколько исследований продемонстрировали способность фибриногена и фибрина, благодаря гепарин-связывающему домену, связывать, длительно удерживать и медленно высвобождать факторы роста различных семейств (PDGF, FGF, TGF-ß) [23, 24]. Эта физиологическая особенность фибриновой матрицы действовать в качестве депо оказывает благоприятное влияние на восстановление поврежденных тканей.
В данном исследовании длительная адгезия эпителия роговицы с поверхностью скаффолда способствовала поддержанию жизнеспособности поверхностных слоев роговицы (уменьшению их слущивания) и выраженной пролиферативной активности базального эпителия с увеличением слоев крыловидных клеток. Подобные эффекты могут во многом определяться сигналами, получаемыми клетками от биологически активного скаффолда, и поддерживаться за счет наличия комплекса белковых факторов, изначально присутствующих в криопреципитате плазмы крови и высвобождающихся в течение периода биодеградации биополимерной матрицей.
Первый опыт применения гидрогелевого биополимера показал, что через 9 дней после фиксации скаффолда толщиной 1,5 мм на поверхности интактной роговицы отмечалась его полная резорбция. В свою очередь при использовании образца толщиной 2,0 мм имело место сохранение остаточного артифициального материала в сводах конъюнктивальной полости. Скорость резорбции биоматериала в ране во многом может зависеть от действия протеолитических ферментов, выраженности процесса альтерации и воспаления в очаге повреждения. Следует отметить отсутствие признаков инфекционного заражения глазной поверхности и придаточного аппарата глаза в течение всего периода наблюдения за экспериментальными животными (9 дней).
Таким образом, оригинальный гидрогелевый скаффолд на основе криопреципитата плазмы крови и коллагена I типа не оказывает цитотоксического воздействия на интактную поверхность роговицы кролика.
Заключение
Экспериментальное исследование показало, что биопокрытие на основе оригинального гидрогелевого биополимерного скаффолда подвергается самостоятельной биодеградации без последствий для глазного яблока и его придаточного аппарата. Увеличение толщины биопокрытия в эксперименте привело к замедлению биодеградации и частичному сохранению его структур на поверхности глаза вплоть до 9-х суток эксперимента. Этот факт позволил продемонстрировать активность пролиферативных процессов в эпителии и передних слоях стромы, что косвенно свидетельствует о повышении регенераторных свойств роговицы на фоне создания подходящего микроокружения.
Финансирование. Исследование не получило какого-либо конкретного гранта от финансирующих агентств в государственном, коммерческом или некоммерческом секторах.
Конфликт интересов отсутствует.
Литература
- Burton M.J., Ramke J., Marques A.P., Bourne R.R.A., Congdon N., Jones I., Ah Tong B.A.M., Arunga S., Bachani D., Bascaran C., Bastawrous A., Blanchet K., Braithwaite T., Buchan J.C., Cairns J., Cama A., Chagunda M., Chuluunkhuu C., Cooper A., Crofts-Lawrence J., Dean W.H., Denniston A.K., Ehrlich J.R., Emerson P.M., Evans J.R., Frick K.D., Friedman D.S., Furtado J.M., Gichangi M.M., Gichuhi S., Gilbert S.S., Gurung R., Habtamu E., Holland P., Jonas J.B., Keane P.A., Keay L., Khanna R.C., Khaw P.T., Kuper H., Kyari F., Lansingh V.C., Mactaggart I., Mafwiri M.M., Mathenge W., McCormick I., Morjaria P., Mowatt L., Muirhead D., Murthy G.V.S., Mwangi N., Patel D.B., Peto T., Qureshi B.M., Salomão S.R., Sarah V., Shilio B.R., Solomon A.W., Swenor B.K., Taylor H.R., Wang N., Webson A., West S.K., Wong T.Y., Wormald R., Yasmin S., Yusufu M., Silva J.C., Resnikoff S., Ravilla T., Gilbert C.E., Foster A., Faal H.B. The Lancet Global Health Commission on Global Eye Health: vision beyond 2020. Lancet Glob Health 2021; 9(4): e489–e551, https://doi.org/10.1016/S2214-109X(20)30488-5.
- Нероев В.В. Работа Российского национального комитета по ликвидации устранимой слепоты в рамках программы ВОЗ «Зрение 2020». В кн.: Материалы VIII межрегионального симпозиума «Профилактика слепоты вследствие травм органа зрения». Инициатива ВОЗ «Всеобщий доступ к здоровью глаз: глобальный план действий на 2014–2019 годы», 13 октября 2016. М; 2017; с. 11–34.
- Thia Z.Z., Ho Y.T., Shih K.C., Tong L. New developments in the management of persistent corneal epithelial defects. Surv Ophthalmol 2023; 68(6): 1093–1114, https://doi.org/10.1016/j.survophthal.2023.06.001.
- Труфанов С.В., Суббот А.М., Шахбазян Н.П. Биотехнологические методы лечения персистирующих эпителиальных дефектов роговицы. Вестник офтальмологии 2020; 136(5): 277–282, https://doi.org/10.17116/oftalma2020136052277.
- Безушко А.В., Дубовиков А.С., Куликов А.Н., Чурашов С.В., Черныш В.Ф., Блинова М.И., Александрова О.И., Хорольская Ю.И., Гаврилюк И.О., Карпович В.В., Даниличев В.Ф. Применение коллагенового скаффолда и амниотической мембраны с культивируемыми стволовыми клетками лимба для устранения лимбальной недостаточности: экспериментальное исследование. Тихоокеанский медицинский журнал 2019; 2: 54–57.
- Mazzocca A.D., McCarthy M.B., Chowaniec D.M., Dugdale E.M., Hansen D., Cote M.P., Bradley J.P., Romeo A.A., Arciero R.A., Beitzel K. The positive effects of different platelet-rich plasma methods on human muscle, bone, and tendon cells. Am J Sports Med 2012; 40(8): 1742–1749, https://doi.org/10.1177/0363546512452713.
- Федосеева Е.В., Ченцова Е.В., Боровкова Н.В., Пономарев И.Н., Власова В.А., Павленко Ю.А. Опыт применения тромбофибринового сгустка богатой тромбоцитами плазмы при язвенном поражении роговицы. Российский офтальмологический журнал 2021; 14 (4): 15–21, https://doi.org/10.21516/2072-0076-2021-14-4-supplement-15-21.
- You J., Hodge C., Hoque M., Petsoglou C., Sutton G. Human platelets and derived products in treating ocular surface diseases — a systematic review. Clin Ophthalmol 2020; 14: 3195–3210, https://doi.org/10.2147/OPTH.S265701.
- Natalia M.E.R., Susiyanti M. The efficacy of sutureless amnion membrane transplantation for corneal epithelialization in delayed corneal healing: a systematic review. Korean J Ophthalmol 2025; 39(3): 288–299, https://doi.org/10.3341/kjo.2025.0004.
- Новицкий И.Я., Сарахман М.Н., Смаль Т.М. Трансплантация амниотической оболочки с фиксацией в слоях роговицы. Офтальмохирургия 2003; 3: 4–7.
- Furundaoturan O., Palamar M., Barut Selver Ö. Palliative efficacy of intrastromal amniotic membrane procedure in symptomatic bullous keratopathy patients. Turk J Ophthalmol 2022; 52(3): 162–167, https://doi.org/10.4274/tjo.galenos.2022.38839.
- Meller D., Pauklin M., Thomasen H., Westekemper H., Steuhl K.P. Amniotic membrane transplantation in the human eye. Dtsch Arztebl Int 2011; 108(14): 243–248, https://doi.org/10.3238/arztebl.2011.0243.
- Егорихина М.Н., Мухина П.А., Бронникова И.И. Скаффолды как системы доставки биологически активных и лекарственных веществ. Комплексные проблемы сердечно-сосудистых заболеваний 2020; 9(1): 92–102, https://doi.org/10.17802/2306-1278-2020-9-1-92-102.
- Егорихина М.Н., Левин Г.Я., Чарыкова И.Н., Алейник Д.Я., Соснина Л.Н. Способ создания биорезорбируемого клеточного скаффолда на основе фибрина плазмы крови. Патент RU 2653434 C1.
- Семенычева Л.Л., Астанина М.В., Кузнецова Ю.Л., Валетова Н.Б., Гераськина Е.В., Таранкова О.А. Способ получения уксусной дисперсии высокомолекулярного рыбного коллагена. Патент RU 2567171 C1.
- Egorikhina M.N., Aleynik D.Y., Rubtsova Y.P., Levin G.Y., Charykova I.N., Semenycheva L.L., Bugrova M.L., Zakharychev E.A. Hydrogel scaffolds based on blood plasma cryoprecipitate and collagen derived from various sources: structural, mechanical and biological characteristics. Bioact Mater 2019; 4: 334–345, https://doi.org/10.1016/j.bioactmat.2019.10.003.
- Matthews J.A., Wnek G.E., Simpson D.G., Bowlin G.L. Electrospinning of collagen nanofibers. Biomacromolecules 2002; 3(2): 232–238, https://doi.org/10.1021/bm015533u.
- Chen S., Mienaltowski M.J., Birk D.E. Regulation of corneal stroma extracellular matrix assembly. Exp Eye Res 2015; 133: 69–80, https://doi.org/10.1016/j.exer.2014.08.001.
- Vogel W.F. Collagen-receptor signaling in health and disease. Eur J Dermatol 2001; 11(6): 506–514.
- Baratta R.O., Del Buono B.J., Schlumpf E., Ceresa B.P., Calkins D.J. Collagen mimetic peptides promote corneal epithelial cell regeneration. Front Pharmacol 2021; 12: 705623, https://doi.org/10.3389/fphar.2021.705623.
- Chattopadhyay S., Raines R.T. Review collagen-based biomaterials for wound healing. Biopolymers 2014; 101(8): 821–833, https://doi.org/10.1002/bip.22486.
- Егорихина М.Н. Использование компонентов крови в тканевой инженерии. Сибирское медицинское обозрение 2018; 3: 14–23, https://doi.org/10.20333/2500136-2018-3-14-23.
- Martino M.M., Briquez P.S., Ranga A., Lutolf M.P., Hubbell J.A. Heparin-binding domain of fibrin(ogen) binds growth factors and promotes tissue repair when incorporated within a synthetic matrix. Proc Natl Acad Sci U S A 2013; 110(12): 4563–4568, https://doi.org/10.1073/pnas.1221602110.
- Martino M.M., Hubbell J.A. The 12th–14th type III repeats of fibronectin function as a highly promiscuous growth factor-binding domain. FASEB J 2010; 24(12): 4711–4721, https://doi.org/10.1096/fj.09-151282.