Использование состава на основе коллагена высокой концентрации и желатиновых гранул в качестве биочернил для экструзионной 3D-биопечати пористо-структурированных гидрогелевых конструкций
Цель исследования — анализ пригодности состава биочернил на основе коллагена высокой концентрации (40 мг/мл) и желатиновых гранул (6,25 мг/мл) для печати пористо-структурированных гидрогелевых конструкций с помощью экструзионного 3D-биопринтера.
Материалы и методы. Биопечать проводили на биопринтере 3D Invivo (Rokit, Южная Корея). Оценивали непрерывность филамента при экструзии, изменение его толщины после тестовой печати и инкубирования, а также биодеградацию готовых скаффолдов. Исследовали цитосовместимость гидрогеля по пролиферации инкорпорированных в скаффолды мультипотентных мезенхимных стромальных клеток жировой ткани человека (ММСК-ЖТ). Для определения иммунофенотипа ММСК-ЖТ проводили проточную цитометрию. Пролиферацию клеток in vitro в структуре скаффолдов исследовали спектрофотометрически после добавления реагента PrestoBlue в течение 28 сут. Анализ экспрессии целевых генов осуществляли методом количественной полимеразной цепной реакции с обратной транскрипцией на 21-е сутки культивирования. В работе использовали праймеры к матричной РНК, кодирующей синтез хондрогенных факторов и метаболитов (ACAN, SOX9, COL1A1, COL2A1), поверхностных маркеров (CD29, CD44, CD73, CD90, CD105), а также факторов гипоксии (HIF1A), пролиферации (PCNA) и апоптоза (BCL2, BAX). Морфологию скаффолдов изучали на 28-е сутки культивирования посредством световой микроскопии после фиксации и окраски гистологических срезов.
Результаты. Экструзия гидрогелевого состава на основе коллагена высокой концентрации (40 мг/мл) и желатиновых гранул (6,25 мг/мл) в процессе печати была стабильной, без обрыва филамента. При инкубации в фосфатно-солевом буфере толщина филамента данного гидрогеля была статистически значимо выше толщины скаффолда после печати. Деградация скаффолдов из коллагена и желатина в растворе коллагеназы I типа начиналась раньше, чем коллагеновых. Инкубация в фосфатно-солевом буфере в течение 14 сут приводила к меньшей потере массы при сушке скаффолдов из коллагена с гранулами желатина. Клетки, выделенные из жировой ткани человека, экспрессировали поверхностные маркеры, характерные для ММСК-ЖТ. Пролиферацию и дифференцировку ММСК-ЖТ в хондрогенном направлении наблюдали в обеих сравниваемых группах. Различия заключались в пространственном расположении клеток. В скаффолдах из коллагена большая часть клеток находилась на поверхности, а в скаффолдах из коллагена и желатина клетки были распределены по всему объему. Результаты количественной полимеразной цепной реакции с обратной транскрипцией по методу 2–ΔΔCt продемонстрировали повышенную экспрессию транскрипционного фактора SOX9 клетками в скаффолдах из коллагена и желатина, а также пониженную экспрессию антиапоптотического гена BCL2 относительно скаффолдов из коллагена.
Заключение. В работе предложен состав биочернил на основе коллагена высокой концентрации (40 мг/мл) и желатиновых гранул (6,25 мг/мл) для биопечати пористо-структурированных гидрогелевых конструкций. Исследование показало, что гидрогель пригоден для печати и проявляет свойства пористого материала. Гидрогель обеспечивал равномерное распределение ММСК-ЖТ в объеме скаффолда и способствовал их дифференцировке в хондрогенном направлении. Таким образом, предлагаемый состав биочернил является перспективным материалом для применения в тканевой инженерии.
Введение
Повреждения хряща чаще всего возникают в результате травм, хронических и аутоиммунных заболеваний. Человеческий организм обладает ограниченными возможностями регенерации хрящевой ткани из-за ее аваскулярной структуры и низкой метаболической активности хондроцитов [1, 2]. В настоящее время хирургические процедуры восстановления хряща основаны на микроперфорировании, хондропластике, а также трансплантации кадаверных материалов. Однако часто вместо полного восстановления целостности хрящевого дефекта данные методы только отдаляют наступление рецидива [3, 4]. Все это побуждает продолжать поиск новых методов создания тканеинженерных аналогов хрящевой ткани.
Трехмерная (3D) экструзионная биопечать относится к аддитивным технологиям послойной печати цитосовместимых гидрогелевых материалов [5]. Сам по себе процесс биопечати подразумевает создание тканеинженерной конструкции (скаффолда). Скаффолд формируется путем нанесения гидрогелевого состава с инкорпорированными клетками непосредственно на подложку биопринтера или культуральный пластик с помощью автоматизированной системы дозирования [6]. Гидрогелевые составы c клетками и другими необходимыми компонентами (питательная среда, буферный раствор, сшивающие агенты и т.д.), применяемые в 3D-биопечати, называются биочернилами [7]. Разработка новых биосовместимых материалов для 3D-биопечати и оптимизация состава существующих являются одними из главных задач как для тканевой инженерии, так и для регенеративной медицины в целом [8].
Зачастую в исследованиях по реконструкции хряща используют дифференцированные клетки, такие как хондроциты, а также клетки на стадии тканеспецифической дифференцировки — хондробласты [9]. Процедура включает в себя получение клеток из здоровых участков хрящевой ткани пациента и их экспансию в условиях in vitro. Недостатком этого метода является ограниченная доступность хондроцитов и их склонность к дедифференцировке после 2 нед культивирования на адгезивном пластике в фибробласты [10, 11]. Кроме того, возможны повреждения донорской зоны в месте взятия хрящевой ткани [12, 13].
Альтернативным источником клеточного материала может выступать липоаспират, полученный из жировой ткани пациента, содержащий мультипотентные мезенхимные стромальные клетки (ММСК-ЖТ) [14]. Большим преимуществом ММСК-ЖТ является менее инвазивная процедура получения, в отличие от хондроцитов и хондробластов, высокий выход клеток, а также способность к хондрогенной дифференцировке после 6 циклов пассирования и криоконсервации [15].
Клиническое применение полноразмерных скаффолдов толщиной от 1 мм сопряжено с рядом трудностей, связанных как непосредственно с процессом биопечати, так и с интеграцией клеток в скаффолд [16]. Инкапсулированные клетки часто ограничены в миграции и пролиферации плотными сетями биоматериала, формирующимися в процессе гелеобразования биочернил.
Цель данного исследования — анализ пригодности состава биочернил на основе коллагена высокой концентрации (40 мг/мл) и желатиновых гранул (6,25 мг/мл) для печати пористо-структурированных гидрогелевых конструкций с помощью экструзионного 3D-биопринтера. Оценивали пригодность состава для печати, изменение толщины филамента после тестовой печати и инкубирования, биодеградацию готовых скаффолдов, а также их цитосовместимость и функциональность.
Материалы и методы
Процедура смешивания биочернил. Приготовление биочернил осуществляли в шприцах (1 мл; Vogt Medical, Германия), соединенных при помощи пластикового комбификс-адаптера (тип соединения Luer Lock; Leiko Injekto, Китай), в соответствии с методикой производителя коллагена [17]. Для получения 1 мл исследуемого состава смешивали 500 мкл стерильного ателоколлагена свиньи I типа в концентрации 80 мг/мл («Имтек», Россия), 250 мкл Tris-HCl (100 мМ; «ПанЭко», Россия), 250 мкл клеточной суспензии в питательной среде DMEM (Gibco, США), 6,25 мг желатиновых гранул (G1890; тип A, прочность геля ~300 g Bloom; Sigma-Aldrich, США). Биочернила того же состава, но без гранул желатина, использовали для печати скаффолдов группы сравнения.
Определение диаметра гранул желатина. До смешивания проводили оценку диаметра используемых гранул желатина. Для этого на стекла наносили образец гранул, фотографировали с использованием инвертированного микроскопа «Биомед-3» («Биомед», Россия) и камеры ToupCam UCMOS03100KPA (ToupTek Photonics, Китай). Изображения обрабатывали с помощью программного обеспечения ImageJ v. 1.52a. Диаметр вычисляли по формуле:
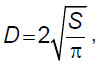
где D — диаметр гранул, S — площадь среза гранул.
Основные параметры печати. Биопечать осуществляли на биопринтере 3D Invivo (Rokit, Южная Корея). Экструзию материалов выполняли через иглы 21G (~514 мкм) типа Luer Lock. Перед процессом печати проводили юстировку печатного стола и выравнивание давления в шприцевом дозаторе. G-код создавали в среде NewCreatorK (v. 1.57.63). Скаффолды печатали в виде цилиндров высотой 4 мм и диаметром 3,2 мм. Параметры: высота слоя — 514 мкм, процент заполнения — 80, тип заполнения — концентрический, скорость печати первого слоя — 2 мм/c, скорость печати — 5 мм/с, толщина стенки — 1,028 мм, процент толщины первого слоя — 133, процент выхода материала — 100. Использовали параметр Skirt, который заключался в построении контура вокруг печатаемой области для исключения обрыва материала на первом слое. Температура столика, как и температура гидрогеля в шприце, поддерживалась на уровне 4°С.
Оценка толщины линий и площади ниш. Для оценки толщины филамента полученного гидрогелевого состава использовали тестовую пластину с шириной линии 0,5 мм и 8 нишами площадью 4 мм2 в соответствии с методикой, приведенной в наших предыдущих работах [18, 19]. Высота объекта — 600 мкм, высота слоя печати — 342 мкм. С учетом потенциальной ошибки процесса калибровки базового слоя выход материала на первом слое составил 115%. После печати пластину заливали фосфатно-солевым буфером (ФСБ) («ПанЭко», Россия) и инкубировали в нем же в течение суток при температуре 37°C. После этого ФСБ удаляли и фотографировали напечатанные объекты с использованием инвертированного микроскопа «Биомед-3» («Биомед», Россия) и камеры ToupCam UCMOS03100KPA (ToupTek Photonics, Китай). Изображения обрабатывали в программе ImageJ v. 1.52a.
Оценка биодеградации тканеинженерных конструкций. Для оценки времени биодеградации печатали 2 группы скаффолдов: коллагеновые 4% и коллагеновые 4% с включением желатиновых гранул в концентрации 6,25 мг/мл. После 3D-печати скаффолды заливали теплым раствором ФСБ (37°С) и помещали в СО2-инкубатор MCO-5AC (Sanyo, Япония) на сутки для завершения полимеризации. На следующий день распределяли образцы на две группы. Биодеградацию полученных скаффолдов исследовали при инкубации в растворах ФСБ и коллагеназы I типа с концентрацией 0,1 мг/мл (Gibco, США). Степень деградации после инкубации в растворе коллагеназы оценивали через 2, 4 и 6 ч; в растворе ФСБ — через 7 и 14 сут. Образцы выдерживали при 37°С, после чего промывали ФСБ двукратно. Скаффолды (n=5) размещали в чашки Петри по группам и оставляли для сушки при комнатной температуре до следующего дня. Далее скаффолды помещали в сушильный шкаф ГП-40 МО (АО «Касимовский приборный завод», Россия). Использовали программу «Сушка» (85°С) в течение часа. Скаффолды взвешивали на аналитических весах Adventurer Pro AV114C (Ohaus, США).
Культура мультипотентных мезенхимных стромальных клеток жировой ткани. Экспериментальные исследования по цитосовместимости были выполнены с использованием ММСК-ЖТ. Донорство жировой ткани осуществлялось при проведении плановых операций по липосакции после подписания пациентами информированного согласия. Изолированные при помощи коллагеназы II типа (Sigma-Aldrich, США) клетки переносили в культуральные флаконы из расчета 5·104 клеток на 1 см2 и культивировали в среде DMEM («ПанЭко», Россия) с содержанием 1 г/л глюкозы и с добавлением 10% эмбриональной телячьей сыворотки — ЭТС (Biosera, Франция), пенициллина–стрептомицина (100 ЕД/мл и 100 мкг/мл соответственно), глутамина (150 мкг/мл) в СО2-инкубаторе MCO-5AC (Sanyo, Япония) при 37°С до 9-го пассажа. Морфологию клеток оценивали с помощью фазово-контрастной световой микроскопии на инвертированном микроскопе Leica DMi1 (Leica Microsystem, Германия). Изображения клеток получали с помощью камеры Flexacam C1 (Leica Microsystem, Германия). Для оценки жизнеспособности клеток до их включения в скаффолды суспензию окрашивали 0,4% раствором трипанового синего («ПанЭко», Россия) в ФСБ.
Проточная цитометрия. Перед встраиванием клеток в структуру биочернил проводили проточную цитометрию на приборе Macs Quant 16 (Miltenyi Biotec, Германия) для определения иммунофенотипа ММСК-ЖТ. Клетки снимали с пластика раствором трипсина-ЭДТА («ПанЭко», Россия), после чего отмывали от ферментов ФСБ (400 g, 5 мин) и вносили в пробирки Falcon 12×75 мм (Thermo Fisher Scientific, США) в количестве 5·105 клеток на 50 мкл окрашивающего буфера (ФСБ c 1% ЭТС). Далее добавляли мышиные моноклональные антитела к CD29, CD90, СD105 (130-101-27, 130-114-859, 130-112-163; Miltenyi Biotec, Германия); CD44, CD73 (REF 347943, REF 561254; Becton Dickinson, США); CD45, CD34 (SAB4700480, SAB4700682; Sigma-Aldrich, Германия) согласно инструкции производителей. Инкубировали в течение 30 мин при 4°С в холодильнике. По истечении этого срока клетки центрифугировали, отмывали дважды в ФСБ, доводили объем пробы до 400 мкл. Каждый образец записывали в трех повторностях с количеством событий 30 000. Для измерения флуоресценции FITC (CD44, CD73, CD90, CD45) использовали канал B1 (525/50 нм), для PE (CD29, СD105, CD34) — канал B2 (579/34 нм). В качестве отрицательного контроля служили клетки, не окрашенные антителами.
Оценка пролиферации клеток, инкорпорированных в скаффолды. Для исследования пролиферации клеток внутри скаффолдов печатали конструкции с ММСК-ЖТ (концентрация — 2·106 в 1 мл гидрогеля). Изучали две группы скаффолдов: напечатанные из 4% коллагенового гидрогеля и из биочернил на основе коллагена и желатина. Напечатанные скаффолды цилиндрической формы инкубировали в 24-луночных планшетах (Nunc, Дания) в хондрогенной среде, состоящей из DMEM с GlutaMAX (Gibco, США) и содержащей 4,5 г/л глюкозы, с добавлением 5% эмбриональной телячьей сыворотки (Biosera, Франция), 1% пенициллина–стрептомицина (Gibco, США), 100 нг/мл фактора роста фибробластов («ПанЭко», Россия), 100 нг/мл инсулиноподобного фактора роста I типа (Sigma-Aldrich, США), 10 нг/мл трансформирующего фактора роста (Sigma-Aldrich, США), 100 МЕ инсулина (РУП «Белмедпрепараты», Беларусь), 10 мкг/мл аскорбиновой кислоты (50 мг/мл; ОАО «Дальхимфарм», Россия) при стандартных условиях в течение 3, 7, 14, 21 и 28 сут. Смену среды проводили каждые 2 сут. Скаффолды по истечении срока инкубирования перемещали в 96-луночный планшет, заливали питательной средой без сыворотки (180 мкл/лунку) и добавляли реагент PrestoBlue (Invitrogen, США) в количестве 20 мкл на лунку. Скаффолды инкубировали в течение 2 ч при 37°С. Измерение оптической плотности проводили на спектрофотометре INNO-S (LTeK, Южная Корея) в диапазоне длин волн 500–630 нм с шагом 10 нм. Итоговое значение оптической плотности вычисляли на двух длинах волн — 560 нм (максимум поглощения) и 600 нм (референсная длина волны).
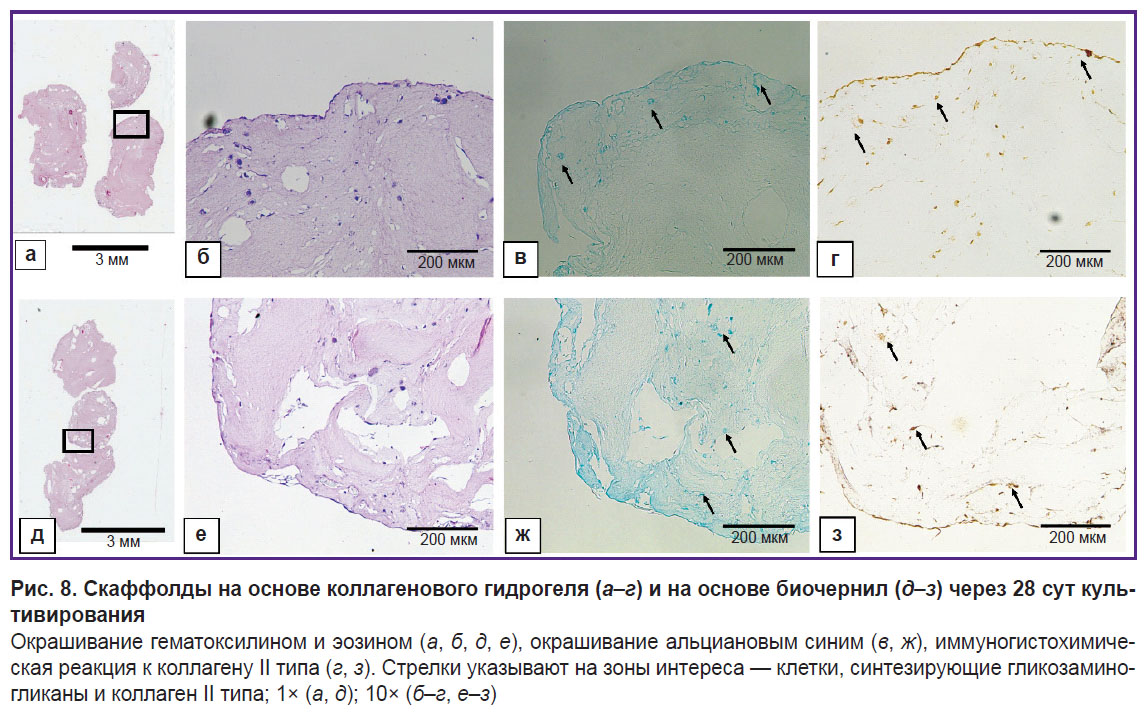
Гистологический анализ полученных скаффолдов. Проверку морфологии скаффолда осуществляли на 28-е сутки посредством создания фиксированных гистологических срезов и световой микроскопии. Скаффолды фиксировали в течение 24 ч в кислой жидкости Буэна, содержащей 1,3% тринитрофенол (Sigma-Aldrich, Германия) и 40% формалин («БиоВитрум», Россия). После отмывки в 70% этаноле выполняли стандартную гистологическую проводку образцов с их последующим заключением в парафиновую среду «Гистомикс» («БиоВитрум», Россия). Парафиновые срезы толщиной 5 мкм, полученные на микротоме RM2235 (Leica Microsystem, Германия), помещали на силанизированные стекла S3003 (Dako, США). Для гистологических исследований депарафинированные срезы окрашивали гематоксилином и эозином и альциановым синим 8GX (Sigma-Aldrich, Германия). После обезвоживания в спиртах и просветления в орто-ксилоле препараты заключали в канадский бальзам (Merck, Германия). Иммуногистохимические исследования проводили с использованием моноклональных кроличьих антител к коллагену II типа (SAB4500366; 1:50; Sigma-Aldrich, Германия). Для иммуновизуализации кроличьих антител применяли вторичные козьи антитела к кроличьим IgG, конъюгированные с пероксидазой хрена (ab205718; 1:1000; Abcam, США). Растворы для иммуногистохимии готовили на ФСБ. Согласно протоколу иммуногистохимических исследований, до нанесения первичных антител к коллагену II типа депарафинированные срезы, погруженные в цитратный буфер (рН=6,0), кипятили в течение 5 мин. Эндогенную пероксидазу блокировали в 3% растворе перекиси водорода. В блокирующий буфер добавляли 2% нормальной сыворотки, 1% бычьего сывороточного альбумина и 0,1% Тритона Х-100 (Sigma-Aldrich, США). В растворе первичных антител препараты инкубировали в течение ночи во влажной камере при 4°С. После отмывки препаратов в ФСБ на срезы наносили вторичные козьи антикроличьи антитела на 1 ч при комнатной температуре. Субстратную пероксидазу выявляли с использованием диаминобензидина (Liquid DAB+; К3468; Dako, Дания). После обезвоживания в спиртах и просветления в ксилоле препараты заключали в канадский бальзам. Гистологические срезы изучали с помощью микроскопа 3 ЛЮМ LED («Микромед», Россия) со встроенной камерой U3CMOS05100KPA ToupCam (ToupTek Photonics, Китай).
Анализ экспрессии целевых генов методом количественной ПЦР с обратной транскрипцией. Суммарную РНК получали с помощью реагента ExtractRNA («Евроген», Россия) из скаффолдов, культивируемых 21 сут в хондрогенной среде. Для этого скаффолды помещали в пробирки типа Эппендорф (1,5 мл; NEST, Китай), заливали 100 мкл реагента ExtractRNA, после чего конструкции растирали полипропиленовым пестиком до гомогенного состояния. Далее добавляли ExtractRNA в количестве 1000 мкл; содержимое пробирки перемешивали на вортексе (V-1 plus; BioSan, Латвия) в течение 16 с. Следующие этапы выполняли согласно стандартному протоколу производителя. Для повышения степени чистоты выделенной РНК использовали осаждение в 100 мкл раствора LiCl (12 М; 310468; Sigma-Aldrich, США). В качестве контроля выступала культура ММСК-ЖТ 9-го пассажа, выращенная в чашках Петри (60 мм; Wuxi NEST Biotechnology Co., Ltd, Китай). Концентрацию РНК измеряли на спектрофотометре Nanodrop ND-1000 (Thermo Fisher Scientific, США). Синтез комплементарной ДНК проводили с помощью набора для обратной транскрипции M-MuLV–RH (R03-10; «Биолабмикс», Россия) в соответствии с протоколом производителя с использованием случайных гексануклеотидных праймеров на амплификаторе «БИС» М111-05-60 (ООО «БИС-Н», Россия). Все образцы комплементарной ДНК хранили при температуре −20°C до количественного анализа ПЦР.
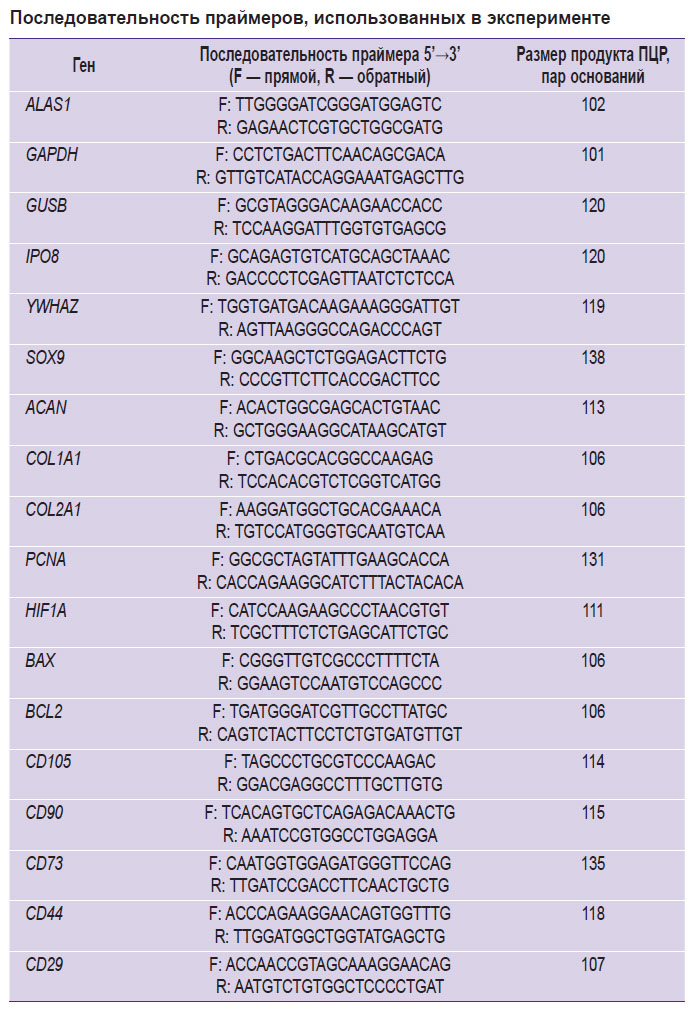
Количественную ПЦР проводили в 96-луночном планшете (B96NS-01N; GenFollower, Китай) с использованием набора «БиоМастер» HS-qPCR SYBR Blue 2× (МНС030-2040; «Биолабмикс», Россия) на приборе CFX96 Real-Time System (Bio-Rad, США). Последовательности праймеров, используемые для количественной ПЦР (см. таблицу), были сконструированы с помощью онлайн-инструмента Primer-BLAST NCBI [20]. Синтез праймеров осуществляли в ООО «Бигль» (Россия). Количественную ПЦР проводили в трех повторах для каждого образца. Предварительная денатурация — 95°C, 5 мин; 40 циклов: денатурация (95°C, 10 с), отжиг (61°C, 20 с), элонгация (72°C, 10 c). Относительные уровни экспрессии матричной РНК устанавливали с помощью метода 2–ΔCt в зависимости от референса. В коллагеновых скаффолдах и скаффолдах на основе коллагена и желатина методом 2–ΔΔCt определяли кратные изменения уровней экспрессии. Референсные гены подбирали среди пяти генов-кандидатов: ALAS1, GAPDH, GUSB, IPO8 и YWHAZ согласно методике F. Xie и соавт. [21].
|
Последовательность праймеров, использованных в эксперименте |
Статистическая обработка. Визуализацию и анализ полученных данных проводили при помощи статистического программного обеспечения R v. 3.4.1 и GraphPad Prism v. 9.5.0. Применяли однофакторный дисперсионный анализ (one-way ANOVA) совместно с критерием Тьюки. T-критерий Стьюдента использовали для оценки толщины филамента и площади ниш, U-критерий Манна–Уитни — для анализа экспрессии генов. Различия считали статистически значимыми при p<0,05.
Результаты
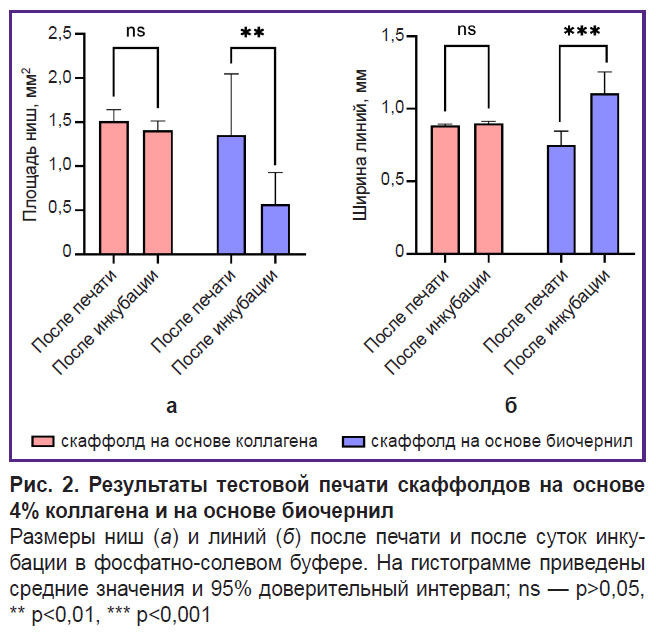
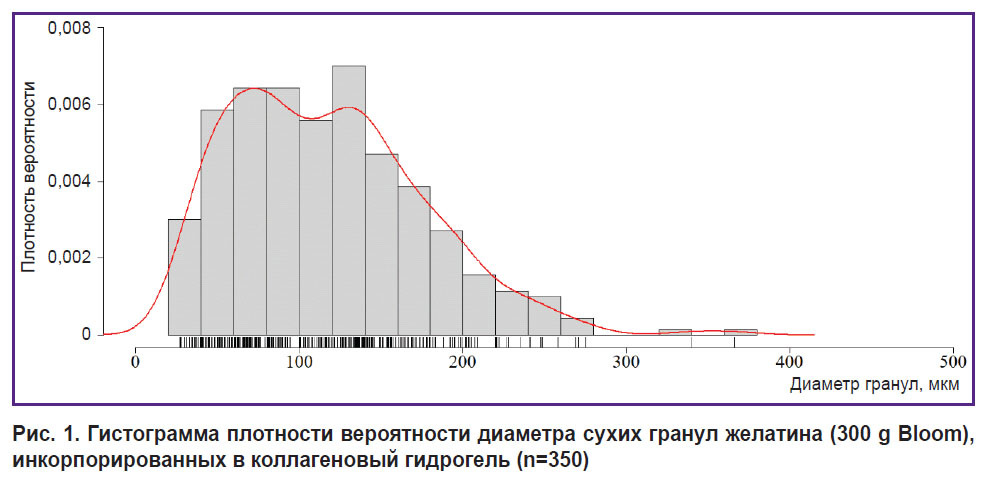
Пригодность состава биочернил для печати. Межквартильный размах диаметра гранул желатина, включенных в коллагеновый гидрогель, составил [69,26; 154,57] мкм при медиане 112,60 мкм (n=350) (рис. 1). Экструзия данного гидрогеля через иглы 21G в процессе печати тестовой пластины была стабильной, без обрыва филамента. После печати не выявлено статистически значимых различий между коллагеновым гидрогелем и биочернилами на основе коллагена и желатиновых гранул (p>0,05).
|
Рис. 1. Гистограмма плотности вероятности диаметра сухих гранул желатина (300 g Bloom), инкорпорированных в коллагеновый гидрогель (n=350) |
В результате инкубации филамента из гидрогеля на основе коллагена и желатина в растворе ФСБ произошло его набухание (рис. 2, б), что привело не только к утолщению филамента, но и к снижению объема образовавшихся ниш (рис. 2, а). Степень набухания полученного состава биочернил для линий увеличена на 47,4%, для ниш — на 42,2%. Таким образом, гидрогель из коллагена с желатиновыми гранулами проявлял свойства пористого материала, гидратация которого выражена сильнее.
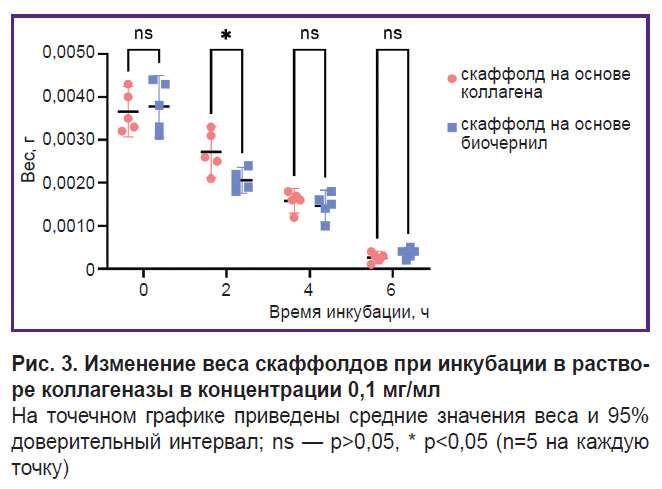
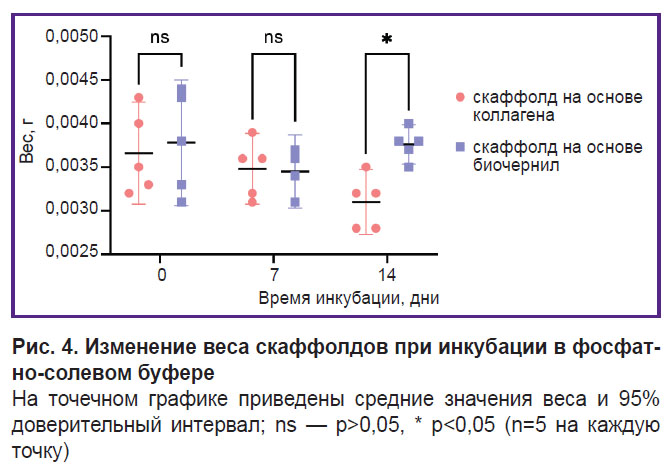
Биодеградация скаффолдов. Данные, полученные в ходе исследования биодеградации скаффолдов в растворе коллагеназы I типа, представлены на рис. 3. Статистически значимое различие наблюдается между группами после 2 ч инкубации (p<0,05). Масса скаффолдов из исследуемого состава биочернил была ниже, поскольку расщепление молекул коллагена и желатина ферментом в них началось быстрее, вероятно за счет лучшего доступа. Достоверных различий в массе скаффолдов двух групп после нахождения в растворе коллагеназы I типа в течение 4 и 6 ч не наблюдалось (p>0,05). Значения сухой массы скаффолдов, инкубированных в растворе ФСБ (рис. 4), статистически значимо различаются между группами на 14-е сутки (p<0,05). Для скаффолдов из коллагена и желатина установлено более высокое значение. Так как время сушки было одинаковым, вероятно, при добавлении гранул желатина к коллагену произошло изменение коллоидно-физических свойств гидрогеля, вследствие чего увеличилась его способность связывать молекулы воды.
|
Рис. 4. Изменение веса скаффолдов при инкубации в форсфатно-солевом буфере |
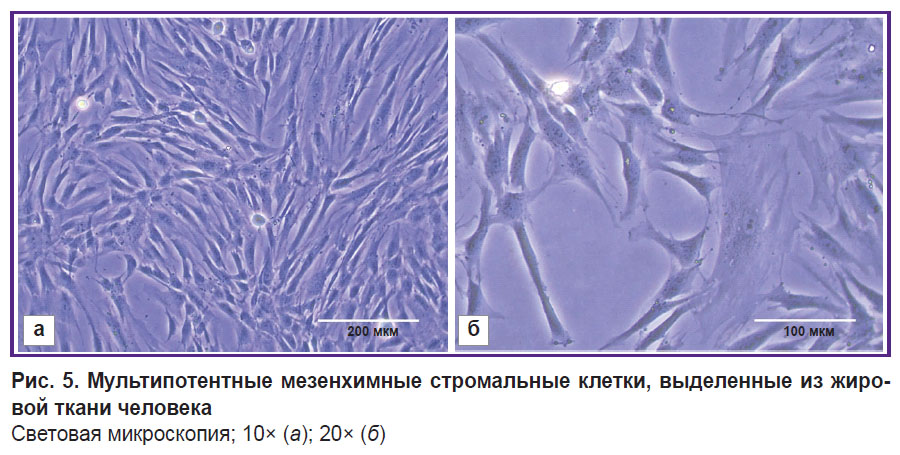
Культура мультипотентных мезенхимных стромальных клеток жировой ткани. Культивируемые в монослое ММСК-ЖТ имели фибробласто-подобную морфологию: крупные распластанные клетки веретеновидной или неправильной формы (рис. 5) с 2–4 длинными отростками; цитоплазма — однородная, прозрачная, без включений. Ядра располагались ближе к периферии (эксцентрично) с равномерным распределением хроматина. Жизнеспособность клеток 9-го пассажа составила 96,34±0,76%.
|
Рис. 5. Мультипотентные мезенхимные стромальные клетки, выделенные из жировой ткани человека Световая микроскопия; 10× (а); 20× (б) |
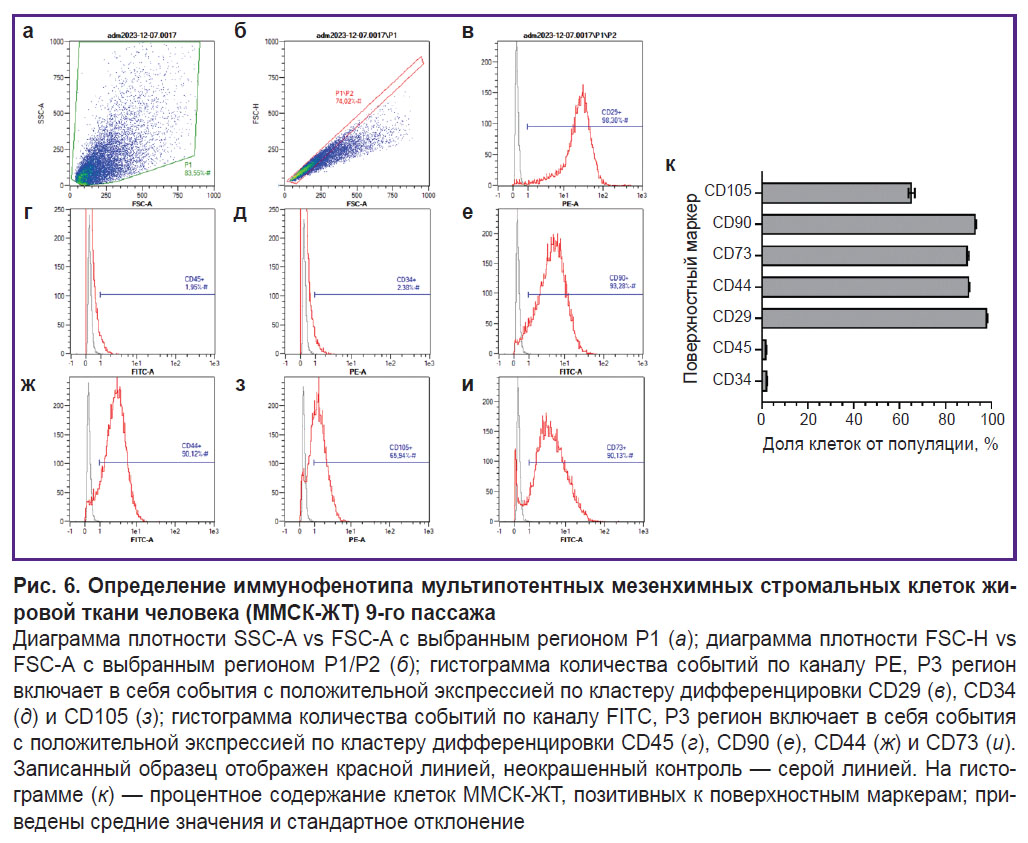
Иммунофенотипирование мультипотентных мезенхимных стромальных клеток жировой ткани. Стратегия гейтирования проточной цитометрии заключалась в отсечении всех событий от клеточного дебриса, построении региона P1 по SSC-А против FSC-A на диаграмме плотности (рис. 6, а). Для отсечения клеточных дуплетов строился регион P2 по гейту 1 (P1/P2) на диаграмме FSC-H против FSC-A (рис. 6, б). События гейта 2 откладывались на гистограмму интенсивности флуоресценции PE и FITC. Регион P3 (P1/P2/P3) учитывал события с положительным уровнем экспрессии поверхностных маркеров (рис. 6, в–и). Процент клеток, экспрессирующих поверхностные маркеры, характерные для ММСК-ЖТ, по результатам цитометрического анализа был следующим: 2,35±0,03% для CD34; 1,95±0,02% для CD454; 93,13±0,20% для CD90; 89,73±0,43% для CD73; 90,29±0,17% для CD44; 98,24±0,08% для CD29; 65,22±1,35% для CD105 (рис. 6, к).
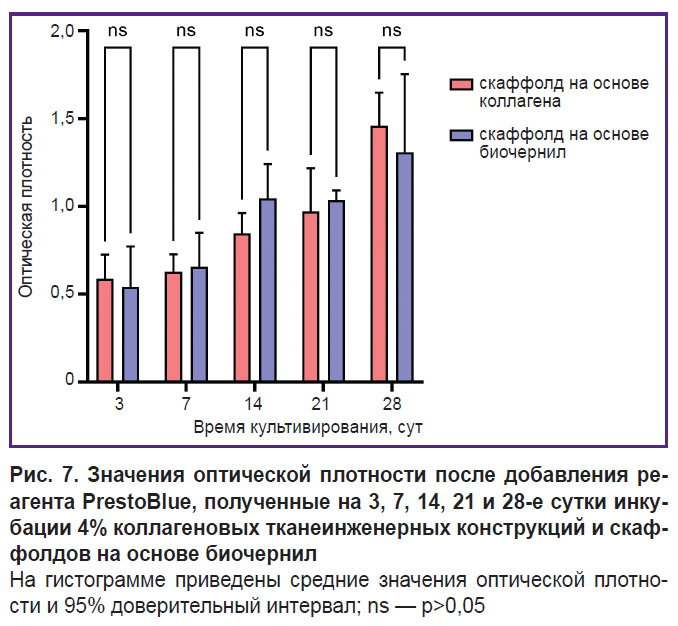
Оценка пролиферации клеток внутри созданных скаффолдов. При культивировании скаффолдов, полученных из коллагенового гидрогеля, и скаффолдов из биочернил на основе коллагена с гранулами желатина наблюдали пролиферацию инкорпорированных клеток на всем сроке наблюдения. Статистически значимой разницы средних значений оптической плотности между группами скаффолдов на 3, 7, 14, 21 и 28-е сутки культивирования не обнаружено (рис. 7).
Гистологический анализ полученных скаффолдов. Скаффолды после 28 сут инкубирования в стандартных условиях представлены на рис. 8. Пролиферацию и дифференцировку ММСК-ЖТ в хондрогенном направлении наблюдали в обеих сравниваемых группах, при этом между ними были выявлены различия. В коллагеновом скаффолде клетки располагались одиночно в толще каркаса и единым слоем на его поверхности. Коллаген II типа и гликозаминогликаны были выявлены преимущественно на поверхности коллагенового скаффолда; в центральной части окрашивание отсутствовало. В случае скаффолдов на основе коллагена и желатина наблюдалось объединение клеток в обширные группы внутри скаффолда; гликозаминогликаны и коллаген II типа распределены по всему образцу с преобладанием окрашивания клеточных скоплений.
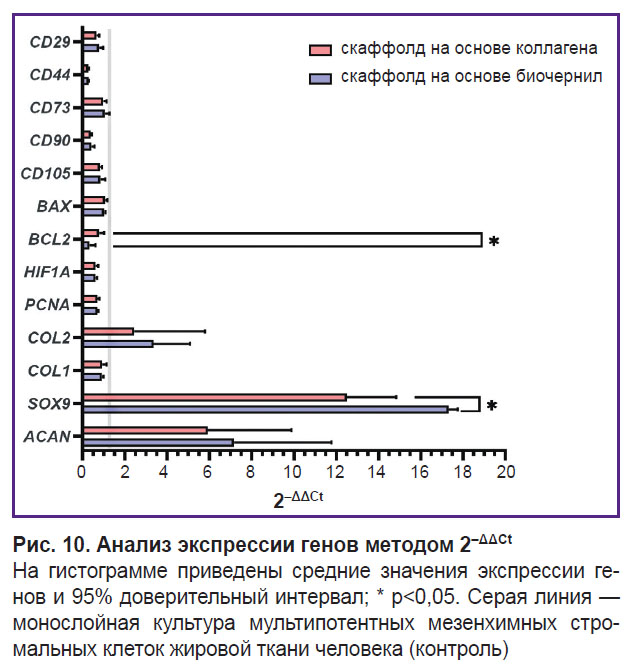
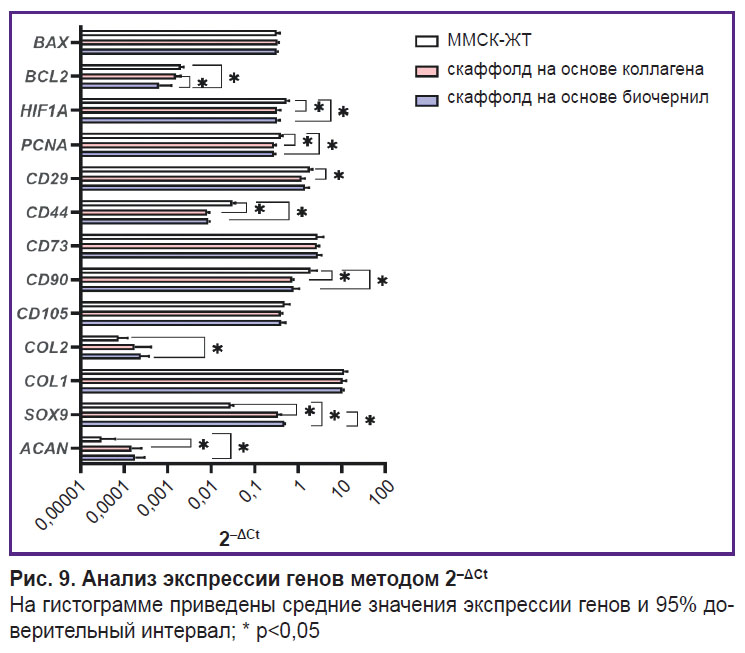
Анализ экспрессии целевых генов. В качестве референсных генов была выбрана пара GUSB и GAPDH. При применении метода 2–ΔCt в скаффолдах двух исследуемых групп наблюдался процесс дифференцировки ММСК-ЖТ, на это указывает статистически значимое уменьшение экспрессии генов поверхностных маркеров CD44 и CD90 (рис. 9). Экспрессия CD90 в ММСК-ЖТ (1,93±0,50) статистически значимо (p<0,05) отличалась от экспрессии в коллагеновом скаффолде (0,73±0,04) и в скаффолде из коллагена и желатина (0,78±0,17). Экспрессия CD44 в контроле (0,031±0,0034) статистически значимо отличалась от коллагеновых скаффолдов (0,008±0,0006) и группы исследуемого состава биочернил (0,009±0,0003). Аналогично экспрессия CD29 в ММСК-ЖТ (1,85±0,18) статистически значимо (p<0,05) отличалась от коллагенового скаффолда (1,21±0,14). Статистически значимых различий в экспрессии маркеров CD105 и CD73 между тремя группами не выявлено. Клетки внутри скаффолдов из коллагена с гранулами желатина продуцировали характерные для матрикса хрящевой ткани гены COL2A1 и ACAN, а также ген транскрипционного фактора, отвечающего за регуляцию хондрогенеза, — SOX9. Экспрессия ACAN и SOX9 в двух группах скаффолдов статистически значимо отличалась от контроля. Экспрессия гена COL2A1 методом 2–ΔCt в культуре ММСК-ЖТ (0,00008±0,000028) статистически значимо отличалась (p<0,05) от уровня экспрессии в скаффолде из коллагена с гранулами желатина (0,00024±0,000079). Статистически значимых различий в экспрессии COL1A1 в группах не выявлено. Экспрессия PCNA в ММСК-ЖТ (0,40±0,03) была существенно выше (p<0,05), чем в коллагеновом скаффолде (0,28±0,02) и скаффолде из исследуемого гидрогеля (0,28±0,01). Экспрессия HIF1A в ММСК-ЖТ (0,54±0,05) существенно отличалась (p<0,05) от экспрессии в коллагеновом скаффолде (0,33±0,04) и в скаффолде из исследуемого гидрогеля (0,33±0,03). Экспрессия гена антиапоптического фактора BCL2 для группы исследуемого состава биочернил (0,0006±0,0004) отличалась как от коллагеновых скаффолдов (0,0016±0,0003), так и от контрольной группы (0,0020±0,0002). В экспрессии BAX статистически значимых различий между группами не наблюдалось. С помощью метода 2–ΔΔCt (рис. 10) были выявлены статистически значимые различия (p<0,05) в экспрессии гена SOX9 для группы коллагеновых скаффолдов и скаффолдов из коллагена с гранулами желатина (12,50±1,47 и 17,32±0,27 соответственно). Наблюдались также различия в экспрессии BCL2 (0,78±0,15 и 0,32±0,18 соответственно).
|
Рис. 9. Анализ экспрессии генов методом 2–ΔCt На гистограмме приведены средние значения экспрессии генов и 95% доверительный интервал; * p<0,05 |
Обсуждение
Трансплантаты, созданные методом экструзионной 3D-бипечати, должны не только точно воспроизводить форму хрящевого дефекта, но и обеспечивать пролиферацию клеток внутри тканеинженерной конструкции [22]. Основным ограничением клинического применения скаффолдов, которые в должной степени воспроизводят реальный объем тканевого дефекта, является сложность доставки питательных веществ к клеткам, особенно кислорода, из-за плотной структуры биоматериалов. Использование комбинации несмешивающихся фаз позволяет создавать пористую структуру, обеспечивающую эффективную диффузию [23]. G.L. Ying и соавт. [24] применяли состав на основе желатина метакрилоила (GelMA) и полиэтиленоксида (PEO). В работе J. Tao и соавт. [25] основным компонентом служил гидрогель GelMa, а порообразующим — наночастицы β-лактоглобулина (β-LG) в растворе декстрана. Как в первом, так и во втором исследовании наблюдались равномерная миграция клеток по всей структуре пористого скаффолда, повышение их жизнеспособности и пролиферативной активности.
В настоящей работе исследовали биочернила на основе коллагена высокой концентрации (40 мг/мл), модифицированные добавлением желатиновых гранул (6,25 мг/мл), в качестве материала для биопечати пористо-структурированных гидрогелевых конструкций. Принято считать, что с точки зрения гомогенности биочернил и лучшей пригодности для печати микрогранулы должны быть не более 50 мкм [26]. В нашей работе диаметр гранул желатина составлял [69,26; 154,57] мкм при медиане 112,60 мкм, что не препятствовало процессу печати. Биочернила стабильно наносились экструзионной насадкой послойно, без обрывов филамента. Гидрогель на основе коллагена и желатина проявлял свойства пористого материала. Существенное влияние на изменение геометрии конструкций после печати оказывало инкубирование в ФСБ: в группах скаффолдов с добавлением желатиновых гранул после инкубации фиксировали увеличение объема филамента, что согласуется с результатами для пористого материала на основе желатина в работе H.W. Liu и соавт. [27]. Повышение степени набухания биочернил для линий составило 47,4%, для ниш — 42,2%. При выдерживании в растворе коллагеназы биодеградация скаффолдов из коллагена и желатина начиналась раньше, что также косвенно указывает на его пористость. Ранее проведенные исследования [28] показали, что пористость 4% коллагенового геля с концентрацией крысиных хондроцитов 20·106 мл–1 была недостаточной для обеспечения инкорпорированных клеток кислородом и питательными веществами. Это негативно сказывалось на их жизнеспособности в течение 28 сут культивирования в условиях in vitro. В текущем исследовании использовали гидрогель с ММСК-ЖТ в концентрации 2·106 мл–1, т.е. в 10 раз меньше. При культивировании в условиях in vitro наблюдалось динамическое увеличение клеточной пролиферации на протяжении 28 сут как в группе скаффолдов, полученных только из коллагенового гидрогеля, так и в группе скаффолдов из исследуемых биочернил. Однако образование клеточных скоплений внутри конструкций отмечалось преимущественно в скаффолдах, изготовленных из коллагена и гранул желатина, в то время как в коллагеновом гидрогеле присутствовали одиночные клетки, а бóльшая часть клеток находилась на поверхности. Таким образом, повышение пористости гидрогеля способствовало улучшению условий существования инкорпорированных в каркас клеток.
В ряде более ранних исследований [29–31] отмечено преимущество коллагена в качестве основного материала скаффолда по сравнению с другими материалами (GelMA, альгинат, агароза, гиалуроновая кислота, фибрин, децеллюляризированный внеклеточный матрикс). Инкапсулированные клетки демонстрировали в нем хорошую жизнеспособность, высокое содержание ДНК, а также повышенную экспрессию генов-маркеров пролиферации.
Известно, что ММСК-ЖТ способны дифференцироваться в хондрогенном направлении [32, 33]. В работе S. Ichinose и соавт. [34] описан процесс дифференцировки ММСК-ЖТ в сферических конструкциях, где на 7-й день в поверхностной зоне появлялись фибробласты, в средней — апоптотические клетки, а в глубокой — хондроцитоподобные клетки. На 21-й день культивирования происходило постепенное истончение поверхности и преобладание хондроцитоподобных клеток в хрящевых лакунах. Исследование M.J. Farrell и соавт. [35] продемонстрировало влияние условий нормоксии (~21% O2) и гипоксии (2% O2), а также глюкозы (в концентрациях 1,0 и 4,5 г/л) на жизнеспособность и хондрогенную дифференцировку клеток в скаффолдах. Авторы отметили, что недостаток глюкозы и гипоксия нарушали эти процессы, при этом отсутствие глюкозы значительно снижало жизнеспособность клеток и затрудняло функциональное созревание 3D-конструкций.
В нашем исследовании скаффолды были инкубированы в питательной среде с высоким содержанием глюкозы. Необходимым условием дифференцировки стволовых клеток в хондрогенном направлении является добавление факторов роста TGF-β3 (transforming growth factor beta 3, трансформирующий фактор роста бета 3), BMP2 (bone morphogenetic protein 2, костный морфогенетический белок 2) и декстрана, а также поддержание их концентраций путем обновления питательной среды [36]. Витамин С повышает пролиферацию ММСК-ЖТ, индуцирует хондрогенную дифференцировку и усиливает паракринный эффект [37, 38]. После имплантации скаффолдов in vivo структура гиалинового хряща может формироваться благодаря интенсивному массопереносу метаболитов [39] и наличию функционально активных макрофагов, способных к слиянию и образованию многоядерных клеток [40]. Внедрение скаффолда в хрящевой дефект стимулирует миграцию стволовых клеток пациента и предшественников хондроцитов [3, 41].
Сравнение экспрессии генов в клетках в состоянии монослоя и при культивировании в структуре скаффолда помогает ответить на вопросы о времени хондрогенной дифференцировки ММСК-ЖТ в скаффолде, изменении фенотипа, а также делении и гипоксии внутри конструкций. Экспрессия гена HIF1A подчеркивает гипоксическую природу ММСК-ЖТ в монослое в отличие от клеток внутри скаффолдов, что согласуется с работой B. Dionigi [42]. Экспрессия PCNA может быть связана как с высоким потенциалом деления ММСК-ЖТ, так и с выходом клеток в скаффолдах после 21 сут на стадию плато [43–45].
В данной работе экспрессия гена COL2A1 ММСК-ЖТ в скаффолдах на основе исследуемых биочернил статистически значимо выше по сравнению с экспрессией этого гена в клетках, культивируемых в монослое. Коллаген II типа является типичным маркером дифференцированных хондроцитов, в то время как экспрессия коллагена I типа увеличивается во время дедифференцировки [46, 47].
Адгезия к пластику, фибробластоподобная структура и экспрессия поверхностных рецепторов CD105, CD90, CD73, CD44, CD29 являются условием для типирования ММСК-ЖТ [48]. В настоящем исследовании клетки соответствовали иммунофенотипу ММСК-ЖТ: CD105 больше 65%; CD90, CD73, CD44, CD29 — больше 90%; CD34 и CD45 — больше 3%. CD29, представляющий собой белок интегрин β-1, был исследован с точки зрения его корреляции со способностью клеток дифференцироваться в хондрогенном направлении, что подтверждено работой C. Cicione и соавт. [49], где подчеркивается важность высокого уровня экспрессии CD29 при выборе ММСК-ЖТ с высоким хондрогенным потенциалом. Следует также отметить, что CD90 (Thy1) участвует во взаимодействии между клетками и внеклеточным матриксом, а повышенная экспрессия CD90 указывает на способность клеток к дифференцировке [50]. Результаты исследования C.B. Chang и соавт. показывают, что антигены CD29, CD44, CD73 и CD90 экспрессировались более чем в 60% ММСК-ЖТ на стадии их выделения. Кроме того, авторы пришли к выводу о ценности поверхностных маркеров CD105 и CD166 и связывают их с хондрогенным потенциалом [51]. Уровень экспрессии CD105 в данной работе составил более 65%, что может свидетельствовать о наличии значительного количества хондрогенных предшественников среди культивируемых ММСК-ЖТ после 9-го пассажа.
Ген SOX9 является ключевым транскрипционным фактором, регулятором хондрогенеза и действует как самостоятельно, так и в комплексе с SOX5 и SOX6, образуя хондрогенное трио [52]. Он участвует в активации экспрессии генов, таких как COL2A1 и ACAN, которые являются основными макромолекулярными компонентами хрящевой ткани, играя ключевую роль в поддержании нормальной структуры и функции суставного хряща [53, 54]. Культивирование ММСК-ЖТ в каркасах, напечатанных из гидрогеля на основе коллагена и желатиновых гранул, в хондрогенной среде на протяжении 21 сут приводит к увеличению экспрессии гена SOX9 клетками. Это свидетельствует об активном процессе их дифференцировки в хондрогенном направлении. Данные согласуются с исследованием J. Tao и соавт. [25], где по сравнению со стандартной группой использование напечатанного пористого гидрогеля привело к значительному увеличению экспрессии SOX9 в инкапсулированных клетках.
Белки BCL2 и BAX играют ключевую роль в регуляции проницаемости митохондриальных мембран и высвобождении цитохрома С [55]. В нашей работе экспрессия гена BCL2 в группе исследуемых биочернил была статистически значимо ниже по сравнению с коллагеновыми скаффолдами, а также контролем. Однако в экспрессии BAX статистически значимых различий между группами не наблюдалось. Это может указывать на запуск механизма апоптоза в результате дифференцировки ММСК-ЖТ в хондрогенном направлении. Полученные данные согласуется с работой Q. Wang и соавт. [56]. Авторы указывают на снижение уровня экспрессии BCL2 при направленной нейрогенной дифференцировке ММСК-ЖТ после 8-часовой индукции. В работе X. Yuan и соавт. [57] отмечено снижение экспрессии BCL2 на 21-е сутки после запуска направленной дифференцировки ММСК-ЖТ в астроциты.
Заключение
В работе предложен состав биочернил на основе коллагена высокой концентрации (40 мг/мл) и желатиновых гранул (6,25 мг/мл) в качестве материала для биопечати пористо-структурированных гидрогелевых конструкций. Исследование показало, что гидрогель пригоден для печати и проявляет свойства пористого материала. Гидрогель обеспечивал равномерное распределение ММСК-ЖТ в объеме скаффолда и способствовал их дифференцировке в хондрогенном направлении. Таким образом, предлагаемый состав биочернил является перспективным материалом для применения в тканевой инженерии.
Благодарности. Авторы выражают большую благодарность Дибировой Заире Гаджиевне — сотруднице лаборатории радиационной патоморфологии — за неоценимую помощь в проведении технических этапов гистологических исследований.
Финансирование. Автор А.А. Кисель поддержан грантом №16500ГУ/2021 конкурса молодежных инновационных научно-технических проектов «УМНИК-2020» ФГБУ «Фонд содействия развитию малых форм предприятий в научно-технической сфере».
Конфликт интересов. Авторы сообщают об отсутствии конфликта интересов.
Литература
- Lories R.J., Luyten F.P. The bone-cartilage unit in osteoarthritis. Nat Rev Rheumatol 2011; 7(1): 43–49, https://doi.org/10.1038/nrrheum.2010.197.
- Matai I., Kaur G., Seyedsalehi A., McClinton A., Laurencin C.T. Progress in 3D bioprinting technology for tissue/organ regenerative engineering. Biomaterials 2020; 226: 119536, https://doi.org/10.1016/j.biomaterials.2019.119536.
- Le H., Xu W., Zhuang X., Chang F., Wang Y., Ding J. Mesenchymal stem cells for cartilage regeneration. J Tissue Eng 2020; 11: 2041731420943839, https://doi.org/10.1177/2041731420943839.
- Tang X., Daneshmandi L., Awale G., Nair L.S., Laurencin C.T. Skeletal muscle regenerative engineering. Regen Eng Transl Med 2019; 5(3): 233–251, https://doi.org/10.1007/s40883-019-00102-9.
- Choudhury D., Anand S., Naing M.W. The arrival of commercial bioprinters — towards 3D bioprinting revolution! Int J Bioprint 2018; 4(2): 139, https://doi.org/10.18063/IJB.v4i2.139.
- Atala A., Yoo J.J. Essentials of 3D biofabrication and translation. 1st edition. Academic Press; 2015.
- Malda J., Visser J., Melchels F.P., Jüngst T., Hennink W.E., Dhert W.J., Groll J., Hutmacher D.W. 25th anniversary article: engineering hydrogels for biofabrication. Adv Mater 2013; 25(36): 5011–5028, https://doi.org/10.1002/adma.201302042.
- Ahn S.H., Lee J., Park S.A., Kim W.D. Three-dimensional bio-printing equipment technologies for tissue engineering and regenerative medicine. Tissue Eng Regen Med 2016; 13(6): 663–676, https://doi.org/10.1007/s13770-016-0148-1.
- Isaeva E.V., Kisel A.A., Beketov E.E., Demyashkin G.A., Yakovleva N.D., Lagoda T.S., Arguchinskaya N.V., Baranovsky D.S., Ivanov S.A., Shegay P.V., Kaprin A.D. Effect of collagen and GelMA on preservation of the costal chondrocytes’ phenotype in a scaffold in vivo. Sovremennye tehnologii v medicine 2023; 15(2): 5, https://doi.org/10.17691/stm2023.15.2.01.
- Gosset M., Berenbaum F., Thirion S., Jacques C. Primary culture and phenotyping of murine chondrocytes. Nat Protoc 2008; 3(8): 1253–1260, https://doi.org/10.1038/nprot.2008.95.
- Verbruggen G., Wang J., Wang L., Elewaut D., Veys E.M. Analysis of chondrocyte functional markers and pericellular matrix components by flow cytometry. Methods Mol Med 2004; 100: 183–208, https://doi.org/10.1385/1-59259-810-2:183.
- Mumme M., Barbero A., Miot S., Wixmerten A., Feliciano S., Wolf F., Asnaghi A.M., Baumhoer D., Bieri O., Kretzschmar M., Pagenstert G., Haug M., Schaefer D.J., Martin I., Jakob M. Nasal chondrocyte-based engineered autologous cartilage tissue for repair of articular cartilage defects: an observational first-in-human trial. Lancet 2016; 388(10055): 1985–1994, https://doi.org/10.1016/S0140-6736(16)31658-0.
- Hellingman C.A., Verwiel E.T., Slagt I., Koevoet W., Poublon R.M., Nolst-Trenité G.J., Baatenburg de Jong R.J., Jahr H., van Osch G.J. Differences in cartilage-forming capacity of expanded human chondrocytes from ear and nose and their gene expression profiles. Cell Transplant 2011; 20(6): 925–940, https://doi.org/10.3727/096368910X539119.
- Айзенштадт А.А., Енукашвили Н.И., Золина Т.Л., Александрова Л.В., Смолянинов А.Б. Сравнение пролиферативной активности и фенотипа МСК, полученных из костного мозга, жировой ткани и пупочного канатика. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова 2015; 7(2): 14–22.
- Logovskaya L.V., Bukharova T.B., Volkov A.V., Vikhrova E.B., Makhnach O.V., Goldshtein D.V. Induction of osteogenic differentiation of multipotent mesenchymal stromal cells from human adipose tissue. Bull Exp Biol Med 2013; 155(1): 145–150, https://doi.org/10.1007/s10517-013-2100-x.
- Hospodiuk M., Dey M., Sosnoski D., Ozbolat I.T. The bioink: a comprehensive review on bioprintable materials. Biotechnol Adv 2017; 35(2): 217–239, https://doi.org/10.1016/j.biotechadv.2016.12.006.
- Osidak E.O., Karalkin P.A., Osidak M.S., Parfenov V.A., Sivogrivov D.E., Pereira F.D.A.S., Gryadunova A.A., Koudan E.V., Khesuani Y.D., Кasyanov V.A., Belousov S.I., Krasheninnikov S.V., Grigoriev T.E., Chvalun S.N., Bulanova E.A., Mironov V.A., Domogatsky S.P. Viscoll collagen solution as a novel bioink for direct 3D bioprinting. J Mater Sci Mater Med 2019; 30(3): 31, https://doi.org/10.1007/s10856-019-6233-y.
- Isaeva E.V., Beketov E.E., Demyashkin G.A., Yakovleva N.D., Arguchinskaya N.V., Kisel A.A., Lagoda T.S., Malakhov E.P., Smirnova A.N., Petriev V.M., Eremin P.S., Osidak E.O., Domogatsky S.P., Ivanov S.A., Shegay P.V., Kaprin A.D. Cartilage formation in vivo using high concentration collagen-based Bioink with MSC and decellularized ECM granules. Int J Mol Sci 2022; 23(5): 2703, https://doi.org/10.3390/ijms23052703.
- Arguchinskaya N.V., Beketov E.E., Isaeva E.V., Kisel A.A., Eremin P.S., Ivanov S.A., Shegay P.V., Kaprin A.D. Riboflavin-induced photocrosslinking of highly concentrated collagen: printing accuracy, degradation time, and cytocompatibility. Appl Biochem Microbiol 2023; 59(8): 1062–1070, https://doi.org/10.1134/s0003683823080033.
- Primer-BLAST. A tool for finding specific primers. URL: https://www.ncbi.nlm.nih.gov/tools/primer-blast/index.cgi.
- Xie F., Xiao P., Chen D., Xu L., Zhang B. miRDeepFinder: a miRNA analysis tool for deep sequencing of plant small RNAs. Plant Mol Biol 2012; 80(1): 75–84, https://doi.org/10.1007/s11103-012-9885-2.
- Radisic M., Deen W., Langer R., Vunjak-Novakovic G. Mathematical model of oxygen distribution in engineered cardiac tissue with parallel channel array perfused with culture medium containing oxygen carriers. Am J Physiol Heart Circ Physiol 2005; 288(3): H1278–H1289, https://doi.org/10.1152/ajpheart.00787.2004.
- Xin S., Chimene D., Garza J.E., Gaharwar A.K., Alge D.L. Clickable PEG hydrogel microspheres as building blocks for 3D bioprinting. Biomater Sci 2019; 7(3): 1179–1187, https://doi.org/10.1039/c8bm01286e.
- Ying G.L., Jiang N., Maharjan S., Yin Y.X., Chai R.R., Cao X., Yang J.Z., Miri A.K., Hassan S., Zhang Y.S. Aqueous two-phase emulsion Bioink-enabled 3D bioprinting of porous hydrogels. Adv Mater 2018; 30(50): e1805460, https://doi.org/10.1002/adma.201805460.
- Tao J., Zhu S., Zhou N., Wang Y., Wan H., Zhang L., Tang Y., Pan Y., Yang Y., Zhang J., Liu R. Nanoparticle-stabilized emulsion Bioink for digital light processing based 3D bioprinting of porous tissue constructs. Adv Healthc Mater 2022; 11(12): e2102810, https://doi.org/10.1002/adhm.202102810.
- Kim M.K., Jeong W., Lee S.M., Kim J.B., Jin S., Kang H.W. Decellularized extracellular matrix-based bio-ink with enhanced 3D printability and mechanical properties. Biofabrication 2020; 12(2): 025003, https://doi.org/10.1088/1758-5090/ab5d80.
- Liu H.W., Su W.T., Liu C.Y., Huang C.C. Highly organized porous gelatin-based scaffold by microfluidic 3D-foaming technology and dynamic culture for cartilage tissue engineering. Int J Mol Sci 2022; 23(15): 8449, https://doi.org/10.3390/ijms23158449.
- Isaeva E.V., Beketov E.E., Yuzhakov V.V., Arguchinskaya N.V., Kisel A.A., Malakhov E.P., Lagoda T.S., Yakovleva N.D., Shegay P.V., Ivanov S.A., Kaprin A.D. The use of collagen with high concentration in cartilage tissue engineering by means of 3D-bioprinting. Cell and Tissue Biology 2021; 15(5): 493–502, https://doi.org/10.1134/s1990519x21050059.
- Tabatabaei F., Moharamzadeh K., Tayebi L. Fibroblast encapsulation in gelatin methacryloyl (GelMA) versus collagen hydrogel as substrates for oral mucosa tissue engineering. J Oral Biol Craniofac Res 2020; 10(4): 573–577, https://doi.org/10.1016/j.jobcr.2020.08.015.
- Krouwels A., Melchels F.P.W., van Rijen M.H.P., Öner F.C., Dhert W.J.A., Tryfonidou M.A., Creemers L.B. Comparing hydrogels for human nucleus pulposus regeneration: role of osmolarity during expansion. Tissue Eng Part C Methods 2018; 24(4): 222–232, https://doi.org/10.1089/ten.TEC.2017.0226.
- Ma X., Yu C., Wang P., Xu W., Wan X., Lai C.S.E., Liu J., Koroleva-Maharajh A., Chen S. Rapid 3D bioprinting of decellularized extracellular matrix with regionally varied mechanical properties and biomimetic microarchitecture. Biomaterials 2018; 185: 310–321, https://doi.org/10.1016/j.biomaterials.2018.09.026.
- Shirasawa S., Sekiya I., Sakaguchi Y., Yagishita K., Ichinose S., Muneta T. In vitro chondrogenesis of human synovium-derived mesenchymal stem cells: optimal condition and comparison with bone marrow-derived cells. J Cell Biochem 2006; 97(1): 84–97, https://doi.org/10.1002/jcb.20546.
- Богдан В.Г., Зафранская М.М., Гаин Ю.М., Демидчик Ю.Е. Мультипотентные мезенхимные стромальные клетки жировой ткани и фибробласты — выбор клеточной составляющей для биологических трансплантатов. Гены и клетки 2012; 7(4): 48–54.
- Ichinose S., Tagami M., Muneta T., Sekiya I. Morphological examination during in vitro cartilage formation by human mesenchymal stem cells. Cell Tissue Res 2005; 322(2): 217–226, https://doi.org/10.1007/s00441-005-1140-6.
- Farrell M.J., Shin J.I., Smith L.J., Mauck R.L. Functional consequences of glucose and oxygen deprivation on engineered mesenchymal stem cell-based cartilage constructs. Osteoarthritis Cartilage 2015; 23(1): 134–142, https://doi.org/10.1016/j.joca.2014.09.012.
- Shirasawa S., Sekiya I., Sakaguchi Y., Yagishita K., Ichinose S., Muneta T. In vitro chondrogenesis of human synovium-derived mesenchymal stem cells: optimal condition and comparison with bone marrow-derived cells. J Cell Biochem 2006; 97(1): 84–97, https://doi.org/10.1002/jcb.20546.
- Kim J.H., Kim W.K., Sung Y.K., Kwack M.H., Song S.Y., Choi J.S., Park S.G., Yi T., Lee H.J., Kim D.D., Seo H.M., Song S.U., Sung J.H. The molecular mechanism underlying the proliferating and preconditioning effect of vitamin C on adipose-derived stem cells. Stem Cells Dev 2014; 23(12): 1364–1376, https://doi.org/10.1089/scd.2013.0460.
- Barlian A., Judawisastra H., Alfarafisa N.M., Wibowo U.A., Rosadi I. Chondrogenic differentiation of adipose-derived mesenchymal stem cells induced by L-ascorbic acid and platelet rich plasma on silk fibroin scaffold. PeerJ 2018; 6: e5809, https://doi.org/10.7717/peerj.5809.
- Brown D.A., MacLellan W.R., Laks H., Dunn J.C., Wu B.M., Beygui R.E. Analysis of oxygen transport in a diffusion-limited model of engineered heart tissue. Biotechnol Bioeng 2007; 97(4): 962–975, https://doi.org/10.1002/bit.21295.
- Hussey G.S., Dziki J.L., Badylak S.F. Extracellular matrix-based materials for regenerative medicine. Nat Rev Mater 2018; 3(7): 159–173, https://doi.org/10.1038/s41578-018-0023-x.
- Ibragimova S.I., Medvedeva E.V., Romanova I.A., Istranov L.P., Istranova E.V., Lychagin A.V., Nedorubov A.A., Timashev P.S., Telpukhov V.I., Chagin A.S. Implantation of various cell-free matrixes does not contribute to the restoration of hyaline cartilage within full-thickness focal defects. Int J Mol Sci 2021; 23(1): 292, https://doi.org/10.3390/ijms23010292.
- Dionigi B., Ahmed A., Pennington E.C., Zurakowski D., Fauza D.O. A comparative analysis of human mesenchymal stem cell response to hypoxia in vitro: implications to translational strategies. J Pediatr Surg 2014; 49(6): 915–918, https://doi.org/10.1016/j.jpedsurg.2014.01.023.
- Jeon B.G., Kwack D.O., Rho G.J. Variation of telomerase activity and morphology in porcine mesenchymal stem cells and fibroblasts during prolonged in vitro culture. Anim Biotechnol 2011; 22(4): 197–210, https://doi.org/10.1080/10495398.2011.624651.
- Dmitrieva R.I., Minullina I.R., Bilibina A.A., Tarasova O.V., Anisimov S.V., Zaritskey A.Y. Bone marrow- and subcutaneous adipose tissue-derived mesenchymal stem cells: differences and similarities. Cell Cycle 2012; 11(2): 377–383, https://doi.org/10.4161/cc.11.2.18858.
- Russell A.L., Lefavor R., Durand N., Glover L., Zubair A.C. Modifiers of mesenchymal stem cell quantity and quality. Transfusion 2018; 58(6): 1434–1440, https://doi.org/10.1111/trf.14597.
- Diaz-Romero J., Gaillard J.P., Grogan S.P., Nesic D., Trub T., Mainil-Varlet P. Immunophenotypic analysis of human articular chondrocytes: changes in surface markers associated with cell expansion in monolayer culture. J Cell Physiol 2005; 202(3): 731–742, https://doi.org/10.1002/jcp.20164.
- Albrecht C., Schlegel W., Bartko P., Eckl P., Jagersberger T., Vécsei V., Marlovits S. Changes in the endogenous BMP expression during redifferentiation of chondrocytes in 3D cultures. Int J Mol Med 2010; 26(3): 317–323, https://doi.org/10.3892/ijmm_00000468.
- Maldonado V.V., Patel N.H., Smith E.E., Barnes C.L., Gustafson M.P., Rao R.R., Samsonraj R.M. Clinical utility of mesenchymal stem/stromal cells in regenerative medicine and cellular therapy. J Biol Eng 2023; 17(1): 44, https://doi.org/10.1186/s13036-023-00361-9.
- Cicione C., Díaz-Prado S., Muiños-López E., Hermida-Gómez T., Blanco F.J. Molecular profile and cellular characterization of human bone marrow mesenchymal stem cells: donor influence on chondrogenesis. Differentiation 2010; 80(2–3): 155–165, https://doi.org/10.1016/j.diff.2010.06.001.
- Fernandes T.L., Kimura H.A., Pinheiro C.C.G., Shimomura K., Nakamura N., Ferreira J.R., Gomoll A.H., Hernandez A.J., Bueno D.F. Human synovial mesenchymal stem cells good manufacturing practices for articular cartilage regeneration. Tissue Eng Part C Methods 2018; 24(12): 709–716, https://doi.org/10.1089/ten.TEC.2018.0219.
- Chang C.B., Han S.A., Kim E.M., Lee S., Seong S.C., Lee M.C. Chondrogenic potentials of human synovium-derived cells sorted by specific surface markers. Osteoarthritis Cartilage 2013; 21(1): 190–199, https://doi.org/10.1016/j.joca.2012.10.005.
- Raftery R.M., Gonzalez Vazquez A.G., Chen G., O’Brien F.J. Activation of the SOX-5, SOX-6, and SOX-9 trio of transcription factors using a gene-activated scaffold stimulates mesenchymal stromal cell chondrogenesis and inhibits endochondral ossification. Adv Healthc Mater 2020; 9(10): e1901827, https://doi.org/10.1002/adhm.201901827.
- Lefebvre V., Angelozzi M., Haseeb A. SOX9 in cartilage development and disease. Curr Opin Cell Biol 2019; 61: 39–47, https://doi.org/10.1016/j.ceb.2019.07.008.
- Song H., Park K.H. Regulation and function of SOX9 during cartilage development and regeneration. Semin Cancer Biol 2020; 67(Pt 1): 12–23, https://doi.org/10.1016/j.semcancer.2020.04.008.
- King L.E., Hohorst L., García-Sáez A.J. Expanding roles of BCL-2 proteins in apoptosis execution and beyond. J Cell Sci 2023; 136(22): jcs260790, https://doi.org/10.1242/jcs.260790.
- Wang Q., Zhang L., Yuan X., Ou Y., Zhu X., Cheng Z., Zhang P., Wu X., Meng Y., Zhang L. The relationship between the Bcl-2/Bax proteins and the mitochondria-mediated apoptosis pathway in the differentiation of adipose-derived stromal cells into neurons. PLoS One 2016; 11(10): e0163327, https://doi.org/10.1371/journal.pone.0163327.
- Yuan X., Zhang L., Wang S., Ou Y., Wang Q., Peng W., Luo H., Cheng Z., Zhu X. Mitochondrial apoptosis and autophagy in the process of adipose-derived stromal cell differentiation into astrocytes. Cell Biol Int 2016; 40(2): 156–165, https://doi.org/10.1002/cbin.10548.