Генетическая шкала прогнозирования феномена no-reflow при инфаркте миокарда
Цель исследования — изучить связь отобранных однонуклеотидных полиморфизмов (ОНП) с развитием феномена no-reflow при выполнении чрескожных коронарных вмешательства (ЧКВ) у пациентов с инфарктом миокарда с подъемом сегмента ST (ИМпST) и создать генетическую шкалу прогнозирования данного осложнения.
Материалы и методы. Проведено одноцентровое сопоставленное исследование «случай–контроль». В исследование включено 80 пациентов с ИМпST: 40 (50%) с no-reflow и 40 (50%) без (соотношение 1:1 по полу и возрасту). No-reflow определяли как TIMI flow grade <3 или Myocardial blush grade <2 после ЧКВ. Оценивали следующие ОНП: rs4961 (ADD1), rs699 и rs4762 (AGT), rs5186 (AGTR1), rs1403543 (AGTR2), rs1799998 (CYP11B2), rs5443 (GNB3), rs2070744 и rs1799983 (eNOS), rs5370 (EDN1), rs1799963 (F2), rs6025 (F5), rs6046 (F7), rs5985 (F13), rs1800790 (FGB), rs1126643 (ITGA2), rs5918 (ITGB3), rs1799762 (PAI-1), rs1801133 и rs1801131 (MTHFR), rs1805087 (MTR) и rs1801394 (MTRR).
Результаты. С развитием феномена no-reflow были ассоциированы следующие ОНП: rs4961 (генотип GT или TT) в гене ADD1, rs1799998 (CC) в гене CYP11B2 и rs1801133 (CC) в гене MTHFR (p<0,05, тест МакНемара). Данные ОНП были объединены в генетическую прогностическую шкалу, где за каждый ассоциированный с no-reflow генотип присваивался 1 балл. Прогностическая ценность положительного результата для максимального значения (3 балла) составила 0,91. Площадь под ROC-кривой была равна 0,724 (0,611–0,838). Отношение шансов развития no-reflow составило 5,39 (1,09–26,66) на каждый балл (p=0,04; многофакторный анализ методом условной логистической регрессии).
Введение
Несмотря на достижения современной фармакотерапии в отношении профилактики сердечно-сосудистой патологии, заболеваемость инфарктом миокарда (ИМ) остается на стабильно высоком уровне. Наиболее эффективным методом лечения является чрескожное коронарное вмешательство (ЧКВ), повсеместное внедрение которого позволило радикально снизить летальность при ИМ и частоту его осложнений [1].
Примерно у 15% пациентов с ИМ с подъемом сегмента ST (ИМпST) при выполнении ЧКВ наблюдается феномен no-reflow. Под no-reflow понимают состояние, когда восстановление просвета эпикардиальной инфаркт-ответственной коронарной артерии (ИОА) в ходе ЧКВ не приводит к адекватной перфузии миокарда из-за наличия коронарной микрососудистой обструкции. Развитие данного осложнения существенно увеличивает риск смерти и прогрессирования хронической сердечной недостаточности [2].
Известно, что к формированию no-reflow приводят несколько патологических механизмов. Наиболее частыми причинами являются исходно тяжелое ишемическое повреждение, дистальная микроэмболия элементами тромба или атеросклеротической бляшки, а также эндотелиальная дисфункция [2, 3]. Многообразие патофизиологических механизмов, лежащих в основе no-reflow, обусловливает существенные трудности профилактики и эффективного лечения обсуждаемого осложнения.
С целью повышения эффективности профилактики no-reflow были созданы несколько прогностических шкал, учитывающих различные клинические, ангиографические и лабораторные предикторы. Наиболее известные модели — шкала J.W. Wang и соавт. [4]; No-reflow score [5]; модель Y. Xiao и соавт. [6]; модель И.С. Бессонова и соавт. [7]; RECOVER score [8]; PIANO score [9]. Однако стоит подчеркнуть, что ни одна из указанных шкал не имеет внешней валидации на независимых данных. Кроме того, точность прогнозирования с помощью упомянутых моделей остается умеренной со средней площадью под ROC-кривой (AUC) около 0,800. По всей видимости, это объясняется тем, что предлагаемые шкалы не содержат параметры, отражающие индивидуальную предрасположенность пациента к развитию no-reflow, и не оценивают все известные патогенетические механизмы. Большинство указанных моделей включают факторы объема коронарных тромботических масс или общего времени ишемии, но ни одна из них не учитывает наличие эндотелиальной дисфункции или состояние тромбоцитов. Мы предполагаем, что персональные генетические особенности могут влиять на риск развития феномена no-reflow. Соответственно, прогностические модели, учитывающие определенные генетические детерминанты no-reflow, могут обладать большей прогностической точностью.
Известно небольшое количество работ, описывающих связь некоторых вариантов однонуклеотидных полиморфизмов (ОНП) с состоянием коронарного микрососудистого русла. В крупном исследовании S. Yoshino и соавт. [10] описывается связь определенных ОНП с дисфункцией коронарной микроциркуляции у стабильных пациентов с клиникой стенокардии, но без значимой обструкции эпикардиальных коронарных артерий. В рамках этой работы подобная связь была найдена для ОНП rs3025039 в гене VEGFA и ОНП rs10757274, rs2383206, rs1004638, rs2383207, rs1333049 в гене CDKN2B-AS1. Отношение шансов (ОШ) наличия микрососудистой дисфункции для указанных ОНП находилось в диапазоне от 1,44 до 1,68.
В некоторых исследованиях изучалась связь определенных ОНП с развитием no-reflow у пациентов с ИМ. Например, в работе S. Dharma и соавт. [11] наличие генотипа АА в ОНП rs2305619 гена PTX3 увеличивало шанс развития no-reflow в 4,48 раза. F. Fracassi и соавт. [12] связали с развитием no-reflow генотип TT ОНП rs1333040 в гене CDKN2B-AS1. Однако, учитывая многофакторность патогенеза no-reflow, разумно предположить, что для точного прогнозирования необходимо одновременно учитывать несколько генетических факторов, связанных с разными механизмами no-reflow. Иными словами, следует создать генетическую шкалу прогнозирования no-reflow.
Наибольший интерес для включения в потенциальную генетическую шкалу представляют ОНП, связанные с механизмами no-reflow, которые нельзя оценить, опираясь на параметры, рутинно доступные в клинической практике. В нашей работе мы решили сделать акцент именно на подобных генетических детерминантах (подробнее в подразделе «Интерпретация результатов») [2, 3, 10–14].
Цель исследования — изучение ассоциации между отобранными ОНП генов ренин-ангиотензин-альдостероновой системы, эндотелиальной функции, фолатного цикла, тромбоцитарной функции и системы гемостаза с развитием no-reflow при выполнении ЧКВ у пациентов с ИМпST, а также создание генетической шкалы прогнозирования данного осложнения.
Материалы и методы
Проведено одноцентровое исследование «случай–контроль».
Исследование одобрено локальным этическим комитетом Приволжского исследовательского медицинского университета (протокол №5 от 08.04.2022). Протокол исследования зарегистрирован на clinicaltrial.gov (NCT05355532). Исследование проведено в соответствии со стандартами Good Clinical Practice и принципами Хельсинкской декларации (2024). Всеми участниками подписано добровольное информированное согласие.
Участники исследования и источники данных. Включение пациентов в исследование проводилось в течение 2022–2023 гг. Отобрано 80 пациентов с ИМпST I типа, которым было проведено экстренное ЧКВ: 40 (50%) в группу с no-reflow (случай) и 40 (50%) в группу без no-reflow (контроль). Группы были сопоставимы по полу и возрасту (±5 лет) в соотношении 1:1 и сформированы с использованием «метода подобранных пар». В исследование включали всех последовательно поступивших пациентов, которые соответствовали критериям включения и не имели критериев исключения.
Критерии исключения: подострый ИМ (более 48 ч от начала ангинозного статуса) или ранняя постинфарктная стенокардия; диссекция, перфорация или острый интраоперационный тромбоз ИОА; ИМ на фоне процедуры реваскуляризации (IV тип); смерть в ходе выполнения ЧКВ, не обусловленная развитием no-reflow; сопутствующая терминальная патология, не связанная с основным заболеванием, с ожидаемой продолжительностью жизни менее 1 мес; исходное ограничение перфузии миокарда вследствие наличия кардиогенного шока, развившегося до проведения ЧКВ.
Развитие no-reflow в ИОА подтверждали с помощью ангиографических критериев на момент окончания ЧКВ: кровоток по TIMI flow grade [15] менее 3-й степени или перфузия по Myocardial blush grade [16] менее 2-й степени.
Подписание добровольного информированного согласия и включение пациентов в исследование происходили в катетеризационной лаборатории после завершения ЧКВ. Все анализируемые в работе данные собирались проспективно.
Генетический анализ. В качестве потенциальных факторов риска развития no-reflow были отобраны 5 групп ОНП, связанных с генами эндотелиальной функции, ренин-ангиотензин-альдостероновой системы, коагуляционного каскада, функции тромбоцитов и метаболизма фолатов (всего 22 ОНП). Выбор был обусловлен данными литературы, согласно которым эти ОНП были связаны с биохимическими механизмами, являющимися компонентами патогенеза no-reflow (подробнее в подразделе «Интерпретация результатов») [2, 3, 10–14]. Перечень проанализированных ОНП в формате «группа генов: идентификатор ОНП (ген, кодируемый белок)» представлен ниже.
Гены эндотелиальной функции: rs4961 (ADD1, α-аддуцин), rs5443 (GNB3, β-3 субъединица протеина G), rs2070744 (eNOS, эндотелин NO-синтаза), rs1799983 (eNOS, эндотелин NO-синтаза) и rs5370 (EDN1, эндотелин-1). Гены ренин-ангиотензин-альдостероновой системы: rs4762 (AGT, ангиотензиноген), rs699 (AGT, ангиотензиноген), rs5186 (AGTR1, рецептор ангиотензина II типа 1), rs1403543 (AGTR2, рецептор ангиотензина II типа 2) и rs1799998 (CYP11B2, альдостеронсинтаза). Гены коагуляционного каскада: rs1799963 (F2, протромбин), rs6025 (F5, проакцелерин), rs6046 (F7, проконвертин), rs5985 (F13, фибриназа) и rs1800790 (FGB, фибриноген). Гены функции тромбоцитов: rs1126643 (ITGA2, α-2-интегрин), rs5918 (ITGB3, β-3-интегрин) и rs1799762 (PAI-1, серпин). Гены метаболизма фолатов: rs1801133 (MTHFR, метилентетрагидрофолатредуктаза), rs1801131 (MTHFR, метилентетрагидрофолатредуктаза), rs1805087 (MTR, B12-зависимая метионинсинтаза) и rs1801394 (MTRR, метионинсинтаза-редуктаза).
Для генетического анализа производили забор цельной периферической крови. В качестве антикоагулянта применяли соли этилендиаминтетраацетата в конечной концентрации 2,0 мг/мл. Образцы хранили при температуре 2–8°С и транспортировали в лабораторию в течение 24 ч.
Генетическое исследование проводили методом полимеразной цепной реакции в режиме реального времени с анализом кривой плавления в высоком разрешении с использованием флуоресцентных зондов TaqMan и функции амплификатора «горячий» старт. Использовали следующие наборы реагентов: «КардиоГенетика Гипертония», «КардиоГенетика Тромбофилия» и «Генетика Метаболизма Фолатов» (все производства «ДНК-Технология», Россия), а также комплект для выявления ОНП Lys198Asn в гене EDN1 «SNP-Экспресс-Кардиогенетика» РВ («Литех», Россия). Для исключения ошибок генотипирования все исследуемые ОНП для всех включенных в работу пациентов регенотипировались двумя независимыми генетиками.
Поскольку все анализируемые ОНП находились в аутосомах (парных хромосомах), в ходе генетического анализа определяли аллельные варианты (сочетания) указанных ОНП. Делалось заключение о наличии референсных («диких», более распространенных) аллелей, альтернативных («мутантных», менее распространенных) аллелей или их сочетании. Учитывая дизайн исследования («случай–контроль»), при последующем сравнении групп использовали бинарные генетические модели: рецессивную модель (группы сравниваются по доле пациентов, имеющих хотя бы один альтернативный аллель в анализируемом ОНП) и доминантную модель (группы сравниваются по доле пациентов, имеющих хотя бы один референсный аллель в анализируемом ОНП). Все пациенты, включенные в исследование, проживали в европейской части России. Информация о том, какой аллель является референсным для данных пациентов, была взята из международной базы данных ОНП — dbSNP (курируется Национальным центром биотехнологической информации (NCBI, США).
Показатели и исходы. Лечение всех пациентов осуществлялось в соответствии с актуальными клиническими рекомендациями [1]. В дополнение к сопоставлению пациентов по полу и возрасту, с целью контроля конфаундеров и предотвращения «смещения» результатов исследования, в статистическом анализе учитывались показатели, являющиеся предикторами развития no-reflow и включенные в известные прогностические шкалы [4–9]. Ряд показателей, использованных в данных шкалах, не анализировали в силу организационных причин (подробнее в подразделе «Ограничения и перспективы»).
Кроме упомянутых ранее TIMI flow grade [15] и Myocardial blush grade [16] в работе использовали шкалу Rentrop [17] для оценки выраженности коллатералей к ИОА, классификацию Killip [18] для определения тяжести острой сердечной недостаточности и шкалу Thrombus burden classification [19] для измерения выраженности тромбоза ИОА.
Период наблюдения соответствовал длительности госпитализации. Регистрировали развитие Q-образующего ИМ и летальные исходы. На 10-е сутки госпитализации выполняли эхокардиографию с измерением фракции выброса левого желудочка по методу Симпсона.
Статистические методы. Необходимый объем выборки (80 пациентов) был рассчитан исходя из следующих показателей: уровень альфа-ошибки — 5%, мощность исследования — 80%, соотношение пациентов в группах сравнения — 1:1, минимальное ОШ для обнаружения — 4,0; диапазон распространенности в популяции планируемых к изучению вариантов ОНП — от 12 до 69% (в среднем 50%). Из 40 планируемых к набору пар 20 пар должны быть дискордантными (пациенты в паре должны отличаться по наличию или отсутствию предиктора).
При статистическом анализе для определения характера распределения применяли критерий Лиллиефорса. Для сравнения групп в рамках однофакторного анализа использовали критерии МакНемара и Вилкоксона. Для многофакторного анализа и контроля конфаундеров применяли условную логистическую регрессию (conditional logistic regression) или модель с фиксированными эффектами (fixed effect model). Для оценки соответствия распределения аллелей закону Харди–Вайнберга использовали хи-квадрат Пирсона. Различия считали статистически значимыми при р<0,05. Количественные данные представляли в виде медиан и межквартильных интервалов (Me [Q1; Q3]); качественные — в виде абсолютных значений и процентных долей — n (%).
В лабораторных и инструментальных данных присутствовали пропуски значений, классифицированные как «случайные пропуски» (missing at random, MAR). Для обработки пропусков применяли многомерный способ заполнения пропущенных данных с помощью цепных уравнений (multivariate imputation by chained equations, MICE) с использованием деревьев классификации и регрессии (classification and regression trees, CART) [20]. Результаты генетического анализа у малого количества пациентов также содержали пропуски данных. Причиной пропуска данных был гемолиз образца крови при транспортировке, что классифицировалось как «полностью случайные пропуски» (missing completely at random, MCAR). Пациенты с пропусками генетических данных исключались из соответствующего анализа.
Статистическую обработку проводили в среде программирования RStudio (Posit Software, США, версия 2023.06.1+524). Использовали следующие библиотеки: DescTools, dlookr, dplyr, exact2x2, flextable, ggplot2, gtsummary, HardyWeinberg, MESS, mice, reporter, reshape2, ROCit, sjPlot, stringr, survival и tibble.
Результаты
Описание выборки и сравнение групп. Медиана возраста среди 80 включенных в исследование пациентов составила 65 [60; 72] лет. Было включено 58 мужчин (73%) и 22 женщины (27%). Медиана продолжительности госпитализации составила 11 [8; 13] дней. На госпитальном этапе умерло 8 пациентов (10%), из них у шести причиной смерти являлось прогрессирование острой левожелудочковой недостаточности, у одного — механическое осложнение ИМ, еще у одного — фибрилляция желудочков.
В выборке из 80 отобранных для исследования пациентов пропущенные данные были отмечены в лабораторных и инструментальных показателях: нейтрофилы (пропущено 1,3% значений), глюкоза (2,5%), фракция выброса левого желудочка (32,5%).
Пропуски данных были отмечены среди следующих анализируемых ОНП: AGT (rs4762) — 1 (1%), AGTR2 (rs1403543) — 1 (1%), CYP11B2 (rs1799998) — 1 (1%), eNOS (rs2070744) — 1 (1%), F7 (rs6046) — 2 (3%), MTHFR (rs1801133) — 2 (3%), MTRR (rs1801394) — 3 (4%), AGT (rs699) — 4 (5%), AGTR1 (rs5186) — 4 (5%), EDN1 (rs5370) — 4 (5%), F2 (rs1799963) — 4 (5%), F5 (rs6025) — 4 (5%), F13 (rs5985) — 4 (5%), ITGB3 (rs5918) — 4 (5%), MTHFR (rs1801131) — 4 (5%), FGB (rs1800790) — 7 (9%), ITGA2 (rs1126643) — 7 (9%), PAI-1 (rs1799762) — 7 (9%), MTR (rs1805087) — 7 (9%) пропусков.
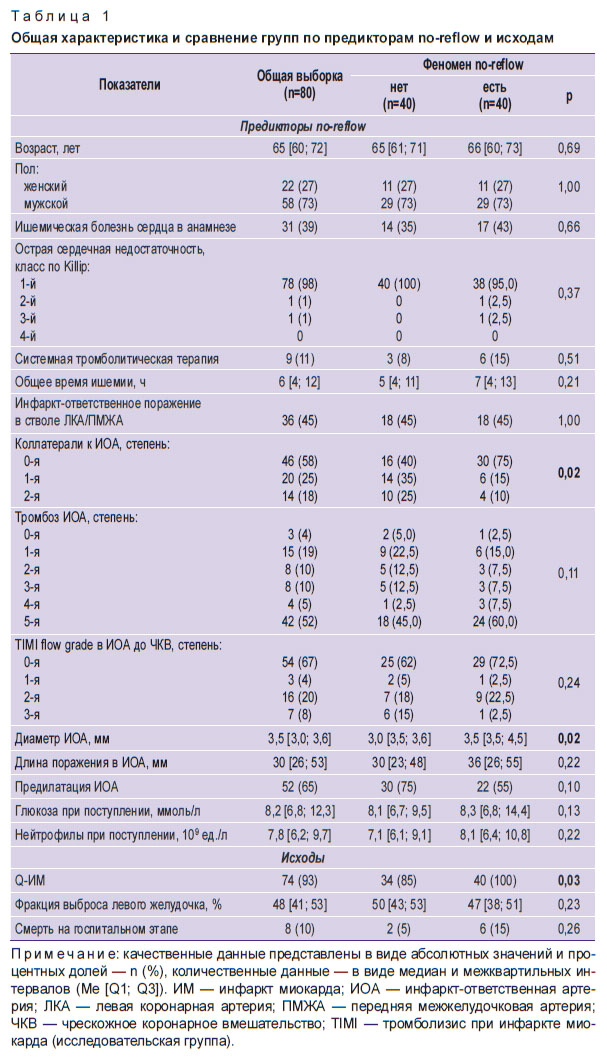
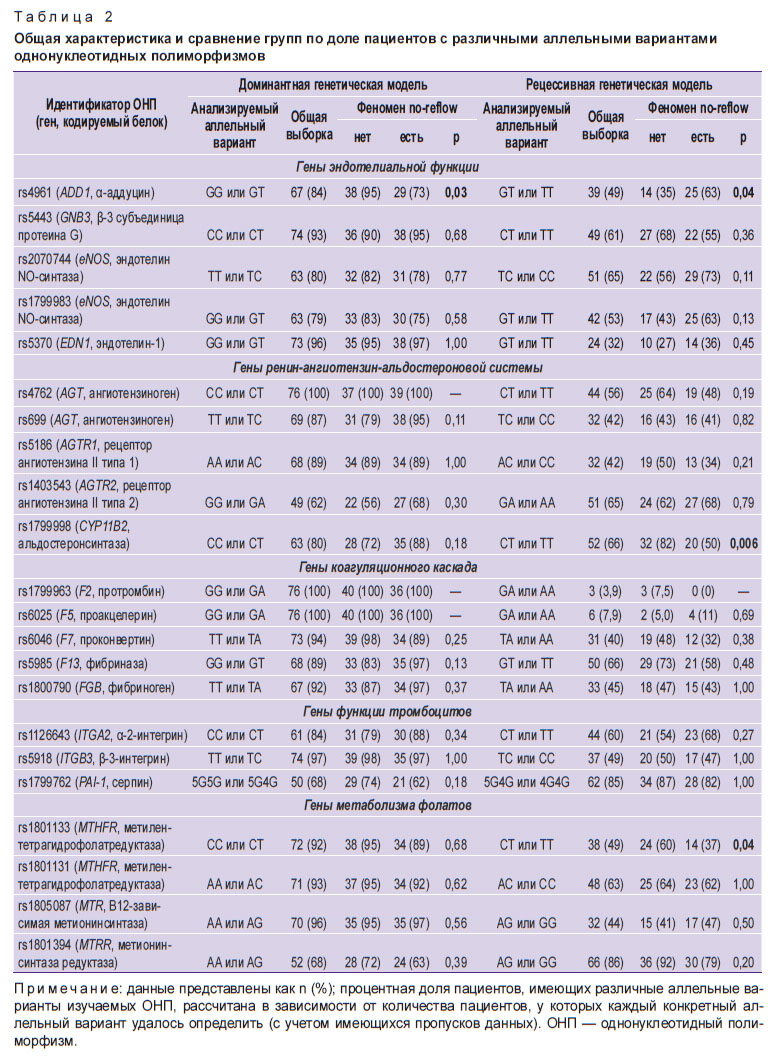
Общая характеристика пациентов и сравнение исследуемых групп по предикторам no-reflow и исходам представлены в табл. 1. Однофакторный анализ различий групп по доле пациентов, имеющих разные аллельные варианты исследуемых ОНП, представлен в табл. 2.
|
Таблица 1. Общая характеристика и сравнение групп по предикторам no-reflow и исходам |
|
Таблица 2. Общая характеристика и сравнение групп по доле пациентов с различными аллельными вариантами однонуклеотидных полиморфизмов |
Распределение частот аллелей в группе пациентов с no-reflow не отклонялось от равновесия Харди–Вайнберга для всех исследуемых ОНП (p>0,05). Однако в группе пациентов без no-reflow отклонение от равновесия Харди–Вайнберга было отмечено для ОНП rs1403543 (ген AGTR2), rs1799983 (eNOS) и rs1801394 (MTRR) (p<0,05).
Создание и оценка генетической прогностической шкалы. С целью создания генетической шкалы, прогнозирующей развитие no-reflow, отбирали ОНП, для которых различия между исследуемыми группами в рамках однофакторного анализа были статистически значимыми (см. табл. 2). В шкалу не включались ОНП, у которых было более 5% пропущенных значений, для которых не соблюдалось равновесие Харди–Вайнберга и у которых доля альтернативных аллелей была менее 5%. Среди вариантов кодирования предпочтение было отдано рецессивной генетической модели, так как для этой модели было получено максимальное количество статистически значимых различий между группами.
В результате, согласно указанным выше критериям, в шкалу были включены три ОНП: rs4961 (ген ADD1), rs1799998 (ген CYP11B2) и rs1801133 (ген MTHFR). Подчеркнем, что использовались аллельные варианты указанных ОНП, которые в рамках рецессивной модели были ассоциированы именно с увеличением риска развития no-reflow: для rs4961 в гене ADD1 генотипы, содержащие альтернативный аллель (T) — GT или TT; для rs1799998 в гене CYP11B2 генотип, содержащий только референсные аллели (C) — CC; для rs1801133 в гене MTHFR также генотип, содержащий только референсные аллели (C) — CC. Для указанных выше генотипов, отобранных ОНП, были рассчитаны ОШ и 95% доверительный интервал развития no-reflow: rs4961 (ADD1), генотипы GT или TT — 2,83 (1,12–7,19), p=0,03; rs1799998 (CYP11B2), генотип CC — 5,33 (1,55–18,30), p=0,008; rs1801133 (MTHFR), генотип CC — 4,00 (1,13–14,17), p=0,03.
Шкала для прогнозирования развития no-reflow при выполнении ЧКВ у пациентов с ИМпST была составлена следующим образом. Балл начислялся в случае наличия у пациента какого-либо из указанных выше аллельных вариантов ОНП, ассоциированных с повышенным риском развития no-reflow. После оценки всех трех ОНП баллы суммировались. Таким образом, максимальное число баллов было равно 3 (ассоциировано с максимальным риском развития no-reflow), минимальное — 0 (ассоциировано с минимальным риском развития no-reflow). Из 77 пациентов (с учетом имеющихся пропусков данных) баллы в выборке распределились следующим образом: 0 баллов — 21 пациент (27%), 1 балл — 20 (26%), 2 балла — 25 (33%), 3 балла — 11 (14%). ОШ развития no-reflow для предложенной шкалы составило 2,93 (1,42–6,02), p=0,004. ОШ в случае одновременного наличия всех трех генотипов, ассоциированных с no-reflow, составило 10,00 (1,28–78,12).
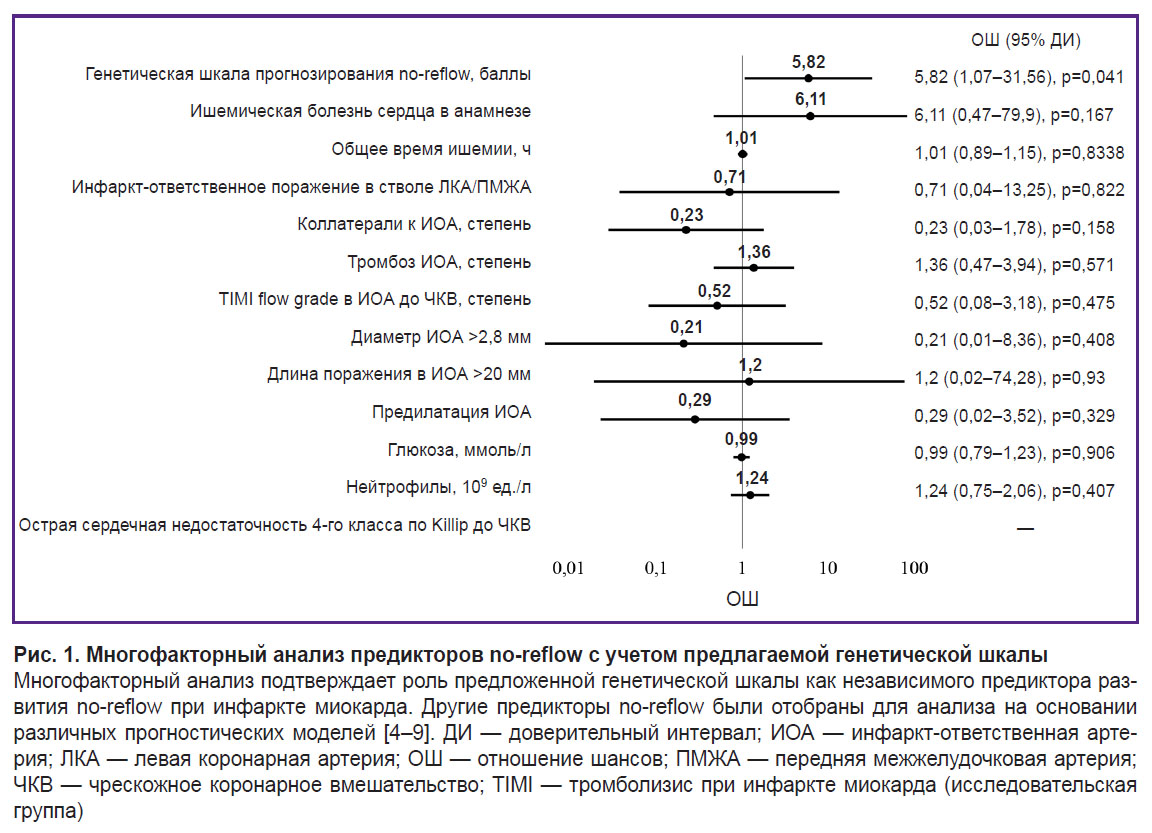
Результаты многофакторного анализа представлены на рис. 1. С учетом влияния конфаундеров ОШ развития no-reflow для предложенной модели составило 5,82 (1,07–31,56), p=0,04.
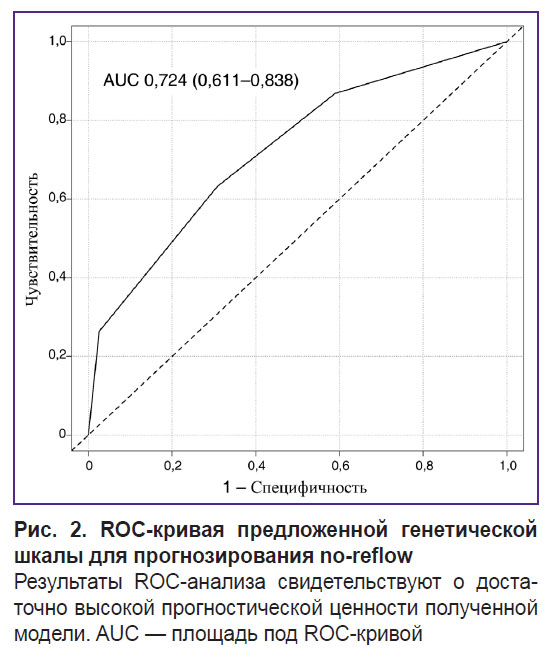
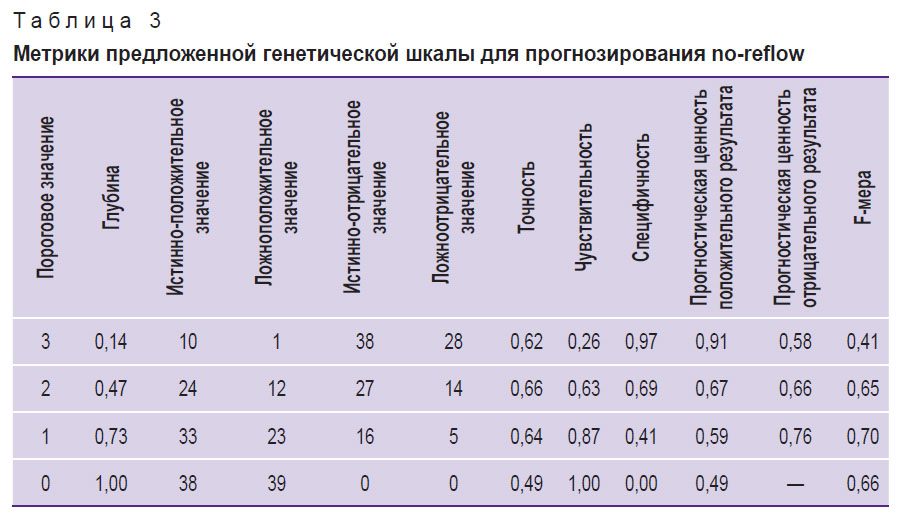
По результатам ROC-анализа предложенной генетической шкалы AUC составила 0,724 (0,611–0,838) (рис. 2). Расчет основных прогностических метрик шкалы представлен в табл. 3.
|
Таблица 3. Метрики предложенной генетической шкалы для прогнозирования no-reflow |
На созданную генетическую шкалу был получен патент [21].
Обсуждение
Интерпретация результатов. Согласно данным литературы [2, 3, 13, 14], основными механизмами развития no-reflow при ИМ являются ишемическое повреждение (экстравазальная компрессия микрососудистого русла), дистальная микроэмболизация (обструкция просвета микрососудов изнутри) и эндотелиальная дисфункция (нарушение регуляции тонуса и проницаемости сосудистой стенки). Некоторые из указанных механизмов ассоциированы с общедоступными показателями, рутинно определяемыми в реальной клинической практике. Ишемическое повреждение в первую очередь связано со сроками реперфузии, локализацией поражения, развитостью коллатералей и кровотоком в ИОА до ЧКВ. Риск развития дистальной микроэмболии во многом определяется объемом тромботических масс и тактикой выполнения ЧКВ. Однако показателей, четко ассоциированных с наличием и тяжестью эндотелиальной дисфункции, в рутинной клинической практике нет. Уровень острой гликемии зависит от многих факторов и связан с функцией эндотелия лишь опосредованно [2, 3, 14]. Нет также маркеров, характеризующих структуру интракоронарного тромба и риск его фрагментации.
Для исследования нами были отобраны пять групп ОНП, анализ которых мог бы дать недостающую информацию об указанных выше механизмах формирования no-reflow. Мы проанализировали ОНП, связанные с ренин-ангиотензин-альдостероновой системой, функцией эндотелия, коагуляционным каскадом, функцией тромбоцитов и фолатным обменом. Статистически значимые различия были получены для аллельных вариантов трех ОНП из разных групп (см. табл. 2).
В группе no-reflow было статистически значимо больше пациентов с альтернативными аллелями ОНП rs4961 (генотипы GT или TT, p=0,02). Данный ОНП локализуется в гене ADD1, который ответственен за синтез α-аддуцина. Указанный белок является частью цитоскелета, участвует в транспорте ионов через клеточную мембрану и во многом обеспечивает стабильность эндотелиального барьера [22]. В результате замены нуклеотида гуанина (G) на тимин (Т) меняется структура α-аддуцина (аминокислота глицин замещается на триптофан). Хорошо изучена связь rs4961 с артериальной гипертензией. Измененный белок активирует натрий-калиевую аденозинтрифосфатазу в почечных канальцах и способствует задержке натрия в организме [23]. Ассоциации rs4961 с no-reflow ранее описано не было. Мы предполагаем, что связь rs4961 с no-reflow можно объяснить влиянием данного ОНП на развитие эндотелиальной дисфункции [22], которая является частью патогенеза no-reflow [2, 3, 14].
Статистически значимые различия также получены при анализе ОНП rs1799998. Частота аллельного варианта CC была выше среди пациентов с no-reflow (p=0,006). Этот ОНП локализуется в гене CYP11B2, который кодирует альдостерон-синтазу — ключевой фермент ренин-ангиотензин-альдостероновой системы, регулирующий синтез гормона альдостерона. Данные относительно влияния CC генотипа rs1799998 на синтез альдостерона разнятся. Известны работы, в которых показана связь CC генотипа с избыточной продукцией альдостерона и, как следствие, с артериальной гипертензией, снижением экскреции ионов натрия и накоплением жидкости в интерстициальном пространстве [24]. Известны работы с противоположным результатом [25]. Информации относительно связи rs1799998 с развитием no-reflow в литературе не представлено. Однако можно предположить, что склонность к накоплению жидкости в интерстициальном пространстве, характерная для аллельного варианта CC, играет роль при развитии экстравазальной компрессии микрососудистого русла при феномене no-reflow.
Ген MTHFR регулирует активность ключевого фермента фолатного цикла — метилентетрагидрофолатредуктазы. Данный фермент играет основную роль в превращении фолиевой кислоты в доступное для усваивания организмом производное — 5-метилтетрагидрофолат. С фолатным циклом тесно сопряжен процесс метаболизма гомоцистеина, в ходе которого происходит восстановление 5-метилтетрагидрофолата и перенос метильной группы на витамин B12 и далее на гомоцистеин с образованием аминокислоты метионина [26]. Наличие ОНП rs1801133 в гене MTHFR ассоциировано с низкой активностью метилентетрагидрофолатредуктазы и соответственно высоким уровнем гомоцистеина в сыворотке крови, что в итоге ведет к эндотелиальной дисфункции, окислительному стрессу, воспалению и повышенному тромбообразованию [26]. Доказана связь гомоцистеина и no-reflow [27]. Кроме того, при дисфункции фолатного цикла страдает процесс метилирования дезоксирибонуклеиновых кислот, что также вносит вклад в развитие ишемической болезни сердца [26].
Актуальные данные о роли ОНП rs1801133 противоречивы. Некоторые авторы указывают на связь аллельных вариантов CT и TT с развитием ИМ [26], особенно у пациентов с диабетом и эндотелиальной дисфункцией [28]. Есть работы, где демонстрируется связь rs1801133 и no-reflow [29]. При этом опубликованы исследования, где указанные закономерности не подтверждаются [30]. В некоторых работах показана связь уровня гомоцистеина с периоперационным повреждением миокарда, но ассоциации между повреждением и вариантом rs1801133 не установлено [31].
В нашей работе мы получили несколько неожиданный результат. Нами также была установлена ассоциация ОНП rs1801133 с развитием no-reflow, но для генотипа CC (p=0,04). Это расходится с другими исследованиями [26, 28, 29], где данный генотип связывают с благоприятным прогнозом. Объяснений полученного результата может быть несколько. Все приведенные выше работы [26, 28, 29] получены на европейской популяции пациентов. Однако есть данные, что частоты аллелей rs1801133 у жителей России могут существенно отличаться [32]. Кроме того, причинно-следственные связи между аллельным вариантом rs1801133 и развитием no-reflow сложнее, чем было указанно выше [29, 30]. Известно, что на процесс переработки гомоцистеина существенно влияют уровни потребления пациентом фолиевой кислоты и витамина B12. Всасывание данных метаболитов может дополнительно ограничиваться при наличии хронической инфекции Helicobacter pylori [33]. Есть работы, где показана связь данной инфекции непосредственно с развитием no-reflow [33]. Хроническое воспаление, вызванное Helicobacter pylori, предрасполагает к развитию обструктивной и необструктивной ишемической болезни сердца [34]. Восприимчивость же организма к указанной инфекции в свою очередь может зависеть от варианта ОНП rs1801133 [35].
В результате проведенного многофакторного анализа была подтверждено, что полученная шкала является независимым предиктором развития no-reflow. Для анализа были отобраны все значимые предикторы развития no-reflow, доступные в нашей рутинной клинической практике. Показатели для анализа были взяты из крупных прогностических моделей последних лет [4–9]. Некоторые предикторы, используемые в этих моделях, не были проанализированы, поскольку они не входят в наш протокол обследования пациента с ИМпST в приемном покое (активированное время свертываемости, лимфоциты, фракция выброса до ЧКВ, креатинфосфокиназа и D-димер).
В заключение отметим, что, ориентируясь на полученные характеристики шкалы (см. табл. 3), оптимальным пороговым значением для предложенной модели следует считать наличие хотя бы одного из указанных ОНП (значение F-меры при этом максимальное — 0,70). В случае же наличия всех трех ОНП у одного пациента прогностическая ценность положительного результата будет максимальной — 0,91.
Ограничения и перспективы. Проведенное исследование имеет ряд ограничений. Объем выборки (80 пациентов) является достаточно небольшим для работ, посвященных поиску генетических предикторов. Однако нами был выполнен многофакторный анализ, который учитывал большинство значимых клинических, лабораторных и инструментальных предикторов развития no-reflow. По результатам анализа была подтверждена роль созданной шкалы как независимого предиктора no-reflow.
Основываясь на данных литературы, можно предположить, что выявленные генетические маркеры приводят к развитию no-reflow через реализацию сложных биохимических механизмов. Хотя в настоящей работе контролировались многие потенциальные конфаундеры, очевидно, что все факторы, влияющие на патофизиологические механизмы развития no-reflow, не были учтены. Некоторые предикторы не анализировались в силу организационных причин; необходимость учета других стала очевидной только после завершения работы.
Для ряда ОНП в контрольной группе не соблюдалось равновесие Харди–Вайнберга. По всей видимости, это связано с тем, что группу «контроль» искусственно подбирали под группу «случай» по полу и возрасту, что, по всей вероятности, стало причиной смещения. Кроме того, некоторые пробы были повреждены при транспортировке. Однако подчеркнем, что ОНП, в отношении которых были сомнения, в шкалу не включались. Обращают на себя внимание также данные по ОНП rs1801133, которые вступают в некоторое противоречие с работами, опубликованными ранее [26, 28, 29]. Учитывая все вышесказанное, необходимо подчеркнуть, что полученные результаты требуют подтверждения в более крупных исследованиях, а созданная шкала нуждается во внешней валидации на независимой выборке.
Несмотря на озвученные ограничения, исследование имеет теоретическую и практическую ценность. С позиций теоретической ценности результаты исследования дают новую информацию о патогенезе no-reflow и расширяют спектр средств для прогнозирования данного осложнения. Перспективы практического применения могут быть различными. Так, например, реализация концепции персонифицированной медицины [36] путем интеграции предложенной генетической модели в существующие клинические шкалы позволит существенно повысить качество прогнозирования no-reflow. Кроме того, в будущем на основе шкалы возможно будет создать генетическую тест-систему, использование которой непосредственно в катетеризационной лаборатории позволит точно оценивать риск no-reflow и модифицировать оперативную тактику с целью профилактики развития этого осложнения.
Заключение
Развитие феномена no-reflow в ходе выполнения ЧКВ при ИМпST ассоциировано с определенными аллельными вариантами трех ОНП: GT или TT для ОНП rs4961 в гене ADD1, CC для rs1799998 в гене CYP11B2 и CC для rs1801133 в гене MTHFR. Указанные ОНП связаны с различными патофизиологическими механизмами развития no-reflow и относятся к ренин-ангиотензин-альдостероновой системе (ADD1), эндотелиальной функции (CYP11B2) и фолатному циклу (MTHFR). Полученные ОНП объединены в генетическую прогностическую шкалу (один балл за каждый ассоциированный с no-reflow аллельный вариант). При максимальной сумме, равной трем баллам, прогностическая ценность положительного результата достигает значения 0,91.
Финансирование. Исследование выполнено в рамках программы стратегического академического лидерства «Приоритет 2030».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Byrne R.A., Rossello X., Coughlan J.J., Barbato E., Berry C., Chieffo A., Claeys M.J., Dan G.A., Dweck M.R., Galbraith M., Gilard M., Hinterbuchner L., Jankowska E.A., Jüni P., Kimura T., Kunadian V., Leosdottir M., Lorusso R., Pedretti R.F.E., Rigopoulos A.G., Rubini Gimenez M., Thiele H., Vranckx P., Wassmann S., Wenger N.K., Ibanez B.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J 2023; 44(38): 3720–3826, https://doi.org/10.1093/eurheartj/ehad191.
- Ciofani J.L., Allahwala U.K., Scarsini R., Ekmejian A., Banning A.P., Bhindi R., De Maria G.L. No-reflow phenomenon in ST-segment elevation myocardial infarction: still the Achilles’ heel of the interventionalist. Future Cardiol 2021; 17(2): 383–397, https://doi.org/10.2217/fca-2020-0077.
- Kaur G., Baghdasaryan P., Natarajan B., Sethi P., Mukherjee A., Varadarajan P., Pai R.G. Pathophysiology, diagnosis, and management of coronary no-reflow phenomenon. Int J Angiol 2021; 30(1): 15–21, https://doi.org/10.1055/s-0041-1725979.
- Wang J.W., Zhou Z.Q., Chen Y.D., Wang C.H., Zhu X.L. A risk score for no reflow in patients with ST-segment elevation myocardial infarction after primary percutaneous coronary intervention. Clin Cardiol 2015; 38(4): 208–215, https://doi.org/10.1002/clc.22376.
- Gupta A., Habung H., Kaur N., Batra A., Gupta A., Doomra M., Thakur P., Mahajan K. Current concepts in the pathogenesis and management of coronary no-reflow phenomenon. BOHR International Journal of General and Internal Medicine 2022; 1(1): 54–58, https://doi.org/10.54646/bijgim.011.
- Xiao Y., Fu X., Wang Y., Wu Y., Wang W., Zhang Q. Development and validation of risk nomogram model predicting coronary microvascular obstruction in patients with ST-segment elevation myocardial infarction (STEMI) undergoing primary percutaneous catheterization. Med Sci Monit 2019; 25: 5864–5877, https://doi.org/10.12659/MSM.915960.
- Бессонов И.С., Кузнецов В.А., Горбатенко Е.А., Зырянов И.П., Сапожников С.С., Дьякова А.О. Прямое стентирование инфаркт-связанной артерии у пациентов с острым инфарктом миокарда с подъемом сегмента ST и гипергликемией. Патология кровообращения и кардиохирургия 2019; 23(1S): S44–S51, https://doi.org/10.21688/1681-3472-2019-1S-S44-S52.
- Xu H., Song C., Xu B., Yin D., Zhu C., Feng L., Zhang D., Gao G., Song W., Qiao S., Wang Y., Li S., Yang Y., Dou K. A scoring system to predict no-reflow phenomenon in elective percutaneous coronary intervention: the RECOVER score. Curr Probl Cardiol 2021; 46(3): 100676, https://doi.org/10.1016/j.cpcardiol.2020.100676.
- Dai C., Liu M., Zhou Y., Lu D., Li C., Chang S., Chen Z., Qian J., Ge J. A score system to predict no-reflow in primary percutaneous coronary intervention: the PIANO score. Eur J Clin Invest 2022; 52(2): e13686, https://doi.org/10.1111/eci.13686.
- Yoshino S., Cilluffo R., Best P.J., Atkinson E.J., Aoki T., Cunningham J.M., de Andrade M., Choi B.J., Lerman L.O., Lerman A. Single nucleotide polymorphisms associated with abnormal coronary microvascular function. Coron Artery Dis 2014; 25(4): 281–289, https://doi.org/10.1097/MCA.0000000000000104.
- Dharma S., Sari N.Y., Parlautan A., Sukmawan R., Wijaya S., Ekawati E., Santoso A. The 3q25 rs2305619 polymorphism is associated with coronary microvascular obstruction following primary angioplasty for acute ST-segment-elevation myocardial infarction. Circ Cardiovasc Interv 2019; 12(12): e008228, https://doi.org/10.1161/CIRCINTERVENTIONS.119.008228.
- Fracassi F., Niccoli G., Vetrugno V., Cauteruccio M., Buffon A., Gatto I., Giarretta I., Tondi P., Pola R., Crea F. The 9p21 Rs 1333040 polymorphism is associated with coronary microvascular obstruction in ST-segment elevation myocardial infarction treated by primary angioplasty. Eur Heart J Acute Cardiovasc Care 2019; 8(8): 703–707, https://doi.org/10.1177/2048872617735808.
- Konijnenberg L.S.F., Damman P., Duncker D.J., Kloner R.A., Nijveldt R., van Geuns R.M., Berry C., Riksen N.P., Escaned J., van Royen N. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovasc Res 2020; 116(4): 787–805, https://doi.org/10.1093/cvr/cvz301.
- Niccoli G., Montone R.A., Ibanez B., Thiele H., Crea F., Heusch G., Bulluck H., Hausenloy D.J., Berry C., Stiermaier T., Camici P.G., Eitel I. Optimized treatment of ST-elevation myocardial infarction. Circ Res 2019; 125(2): 245–258, https://doi.org/10.1161/CIRCRESAHA.119.315344.
- TIMI Study Group. The thrombolysis in myocardial infarction (TIMI) trial. Phase I findings. N Engl J Med 1985; 312(14): 932–936, https://doi.org/10.1056/NEJM198504043121437.
- van‘t Hof A.W., Liem A., Suryapranata H., Hoorntje J.C., de Boer M.J., Zijlstra F. Angiographic assessment of myocardial reperfusion in patients treated with primary angioplasty for acute myocardial infarction: myocardial blush grade. Zwolle Myocardial Infarction Study Group. Circulation 1998; 97(23): 2302–2306, https://doi.org/10.1161/01.cir.97.23.2302.
- Rentrop K.P., Feit F., Sherman W., Thornton J.C. Serial angiographic assessment of coronary artery obstruction and collateral flow in acute myocardial infarction. Report from the second Mount Sinai-New York University Reperfusion Trial. Circulation 1989; 80(5): 1166–1175, https://doi.org/10.1161/01.cir.80.5.1166.
- Killip T. 3rd, Kimball J.T. Treatment of myocardial infarction in a coronary care unit. A two year experience with 250 patients. Am J Cardiol 1967; 20(4): 457–464, https://doi.org/10.1016/0002-9149(67)90023-9.
- Sianos G., Papafaklis M.I., Serruys P.W. Angiographic thrombus burden classification in patients with ST-segment elevation myocardial infarction treated with percutaneous coronary intervention. J Invasive Cardiol 2010; 22(10 Suppl B): 6B–14B.
- Austin P.C., White I.R., Lee D.S., van Buuren S. Missing data in clinical research: a tutorial on multiple imputation. Can J Cardiol 2021; 37(9): 1322–1331, https://doi.org/10.1016/j.cjca.2020.11.010.
- Починка И.Г., Щелчкова Н.А., Фролов А.А., Першин В.И., Максимова Н.С., Кузьмичев К.В., Будкина М.Л., Предеина И.В. Способ диагностики генетической предрасположенности к развитию феномена коронарной микрососудистой обструкции при выполнении чрескожных коронарных вмешательств у пациентов с инфарктом миокарда с элевацией сегмента ST. Патент RU 2 811 933. 2023.
- Moztarzadeh S., Radeva M.Y., Sepic S., Schuster K., Hamad I., Waschke J., García-Ponce A. Lack of adducin impairs the stability of endothelial adherens and tight junctions and may be required for cAMP-Rac1-mediated endothelial barrier stabilization. Sci Rep 2022; 12(1): 14940, https://doi.org/10.1038/s41598-022-18964-5.
- Jin H., Huang Y., Yang G. Association between α-adducin rs4961 polymorphism and hypertension: a meta-analysis based on 40 432 subjects. J Cell Biochem 2019; 120(3): 4613–4619, https://doi.org/10.1002/jcb.27749.
- Bress A., Han J., Patel S.R., Desai A.A., Mansour I., Groo V., Progar K., Shah E., Stamos T.D., Wing C., Garcia J.G., Kittles R., Cavallari L.H. Association of aldosterone synthase polymorphism (CYP11B2 -344T>C) and genetic ancestry with atrial fibrillation and serum aldosterone in African Americans with heart failure. PLoS One 2013; 8(7): e71268, https://doi.org/10.1371/journal.pone.0071268.
- Nouhi Y., Aboubakr F.Z., Brini O.E., Benazzouz B., Akhouayri O. Association of combined -344T/C and K173R polymorphisms in aldosterone synthase gene with type 2 diabetes mellitus in the Moroccan population. Rom J Intern Med 2024; 62(3): 323–330, https://doi.org/10.2478/rjim-2024-0011.
- Samii A., Aslani S., Imani D., Razi B., Samaneh Tabaee S., Jamialahmadi T., Sahebkar A. MTHFR gene polymorphisms and susceptibility to myocardial infarction: evidence from meta-analysis and trial sequential analysis. IJC Heart & Vasculature 2023; 49: 101293, https://doi.org/10.1016/j.ijcha.2023.101293.
- Yu H., Wang B.B., Zhao M., Feng F., Li H.D. Homocysteine levels in patients with coronary slow flow phenomenon: a meta-analysis. PLoS One 2023; 18(7): e0288036, https://doi.org/10.1371/journal.pone.0288036.
- Mallhi T.H., Shahid M., Rehman K., Khan Y.H., Alanazi A.S., Alotaibi N.H., Akash M.S.H., Butt M.H. Biochemical association of MTHFR C677T polymorphism with myocardial infarction in the presence of diabetes mellitus as a risk factor. Metabolites 2023; 13(2): 251, https://doi.org/10.3390/metabo13020251.
- Tang O., Wu J., Qin F. Relationship between methylenetetrahydrofolate reductase gene polymorphism and the coronary slow flow phenomenon. Coron Artery Dis 2014; 25(8): 653–657, https://doi.org/10.1097/MCA.0000000000000151.
- Hmimech W., Idrissi H.H., Diakite B., Baghdadi D., Korchi F., Habbal R., Nadifi S. Association of C677T MTHFR and G20210A FII prothrombin polymorphisms with susceptibility to myocardial infarction. Biomedical Reports 2016; 5(3): 361–366, https://doi.org/10.3892/br.2016.717.
- Verdoia M., Schaffer A., Cassetti E., Barbieri L., Di Giovine G., Marino P., De Luca G.; Novara Atherosclerosis Study Group (NAS). MTHFR polymorphism and risk of periprocedural myocardial infarction after coronary stenting. Nutr Metab Cardiovasc Dis 2014; 24(5): 532–537, https://doi.org/10.1016/j.numecd.2013.10.027.
- Дрибноходова О.П., Корчагин В.И., Миронов К.О., Дунаева Е.А., Титков А.В., Аксельрод Э.В., Раскуражев А.А., Танашян М.М., Иллариошкин С.Н., Платонов А.Е., Шипулин Г.А. Сравнительный анализ частот аллельных вариантов rs1801133 и rs1801131 гена MTHFR в выборке пациентов, перенесших ишемический инсульт, и у здорового населения в Московском регионе. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019; 119(3–2): 18–23, https://doi.org/10.17116/jnevro201911903218.
- Evrengul H., Tanriverdi H., Kuru O., Enli Y., Yuksel D., Kilic A., Kaftan A., Kirac S., Kilic M. Elevated homocysteine levels in patients with slow coronary flow: relationship with Helicobacter pylori infection. Helicobacter 2007; 12(4): 298–305, https://doi.org/10.1111/j.1523-5378.2007.00505.x.
- Wärme J., Sundqvist M.O., Hjort M., Agewall S., Collste O., Ekenbäck C., Frick M., Henareh L., Hofman-Bang C., Spaak J., Sörensson P., Y-Hassan S., Svensson P., Lindahl B., Hofmann R., Tornvall P. Helicobacter pylori and pro-inflammatory protein biomarkers in myocardial infarction with and without obstructive coronary artery disease. Int J Mol Sci 2023; 24(18): 14143, https://doi.org/10.3390/ijms241814143.
- Oliveira A.P.G., de Matos G.C.B., Vieira M.C.D.S., Corvelo T.C.O. Retrospective cohort study of the MTHFR C677T/A1298C polymorphisms and human homocysteine levels in Helicobacter pylori infection. Diagn Microbiol Infect Dis 2024; 109(3): 116243, https://doi.org/10.1016/j.diagmicrobio.2024.116243.
- Jain K.K. Personalized management of cardiovascular disorders. Med Princ Pract 2017; 26(5): 399–414, https://doi.org/10.1159/000481403.