Трехмерная визуализация коллагеновых волокон миокарда человека с помощью окраски трипановым синим
Цель исследования — оценить возможность использовать окрашивание трипановым синим срезов миокарда человека для изучения коллагеновых волокон сердца и, в частности, их трехмерной реконструкции.
Материалы и методы. Срезы миокарда человека (n=9) окрашивали 1% водным раствором трипанового синего (Panreac, Испания) с предварительной обработкой фосфорномолибденовой кислотой (патентная заявка №RU 2024/22564). Для сравнения параллельные срезы окрашивали по аналогичной методике 2% водным раствором анилинового синего (Unisource Chemicals Pvt. Ltd., Индия). Анализ полученных препаратов проводили с помощью светового микроскопа Leica DM750 (Leica Microsystems, Германия) и конфокального лазерного микроскопа LSM800 (Carl Zeiss AG, Германия). Трехмерную реконструкцию выполняли с помощью программного обеспечения ZEN-2012 (Carl Zeiss AG, Германия).
Результаты. Трипановый синий избирательно окрашивает коллагеновые волокна. При микроскопии проходящего света видимого диапазона наиболее четко визуализируются толстые рыхло расположенные волокна, в то время как тонкие волокна окрашиваются менее интенсивно и недоступны для детального изучения данным методом. Цитоплазма кардиомиоцитов остается неокрашенной. Анилиновый синий окрашивает тонкие волокна сравнительно более интенсивно, а также неспецифически окрашивает цитоплазму кардиомиоцитов.
Флуоресценцию коллагеновых волокон, окрашенных трипановым синим, возбуждали лазером с длиной волны 640 нм. Цитоплазма неокрашенных кардиомиоцитов автофлуоресцирует при возбуждении лазером с длиной волны 488 нм. Трехмерная визуализация эндомизия показала, что он представляет собой сеть. Следовательно, стало возможно описание структур низшего порядка, входящих в состав толстых волокон. Помимо хода волокон трехмерная визуализация позволяет определить их поперечное сечение, дифференцируя его от тангенциального.
Заключение. Результаты исследования показали, что окрашивание трипановым синим срезов сердца человека является эффективным методом для выявления коллагеновых волокон, изучения их структуры на светооптическом уровне с помощью конфокальной лазерной микроскопии и создания детализированных трехмерных реконструкций. Преимущества данного метода по сравнению с другими способами трехмерной визуализации коллагеновых волокон заключаются в общедоступности реагентов, высокой избирательности окрашивания соединительнотканного матрикса, возможности получения контрастных и детализированных изображений изучаемых объектов с высоким разрешением.
Введение
Коллагеновые волокна являются основным компонентом внеклеточного матрикса и определяют ряд его свойств и функций. Во-первых, коллаген — источник жесткости межклеточного вещества и органа в целом, т.е. он обеспечивает способность сопротивляться деформации [1, 2]. Это достигается за счет собственных механических свойств коллагенового волокна, обусловленных его молекулярной структурой, а также пространственной организации волокон. Во-вторых, молекулы коллагена имеют участки связывания молекул клеточной адгезии (интегринов), фибронектина и ламинина, а также гликозаминогликанов, совокупность которых регулирует жизнедеятельность клеток [3], в том числе путем осуществления процесса механотрансдукции [1, 4]. Ответы клеток на механические стимулы стали известны в основном благодаря работам, выполненным на культурах клеток. Так, для культуры мезенхимальных стволовых клеток человека установлено, что сниженная механическая нагрузка на ткань обусловливает дифференцировку преимущественно в адипогенную, а не остеогенную линию [5]. Для культуры стволовых клеток поперечно-полосатых скелетных мышц показано, что придание субстрату эластических свойств, аналогичных свойствам нативного внеклеточного матрикса, позволяет сохранить способность данных клеток к самовоспроизведению, которую они обычно утрачивают in vitro [6]. В других работах была выявлена переориентация клеток остеосаркомы и актиновых фибрилл в цитоплазме относительно направления циклической нагрузки, частоты этой нагрузки и эластических свойств матрикса [7].
Ответ на механические сигналы не ограничивается реакциями на клеточном уровне и в конечном итоге приводит к изменению окружающего клетки матрикса — его ремоделированию. Данный процесс наиболее активно изучается в контексте патологических состояний миокарда. Установлено, что увеличение преднагрузки на правый желудочек обусловливает изменение метаболизма коллагена в сердце с преобладанием его синтеза, что способствует увеличению массы миокарда за счет соединительнотканного компонента [8]. Показано, что существенное изменение внутрисердечной гемодинамики, развивающееся в результате атрезии трехстворчатого клапана, вызывает утолщение коллагеновых волокон разных уровней организации [9]. Утолщению подвергаются как волокна, окружающие сосуды и пучки кардиомиоцитов, так и волокна, образующие поперечные мостики между коллагеновыми чехлами отдельных кардиомиоцитов [9]. Важным направлением в исследовании волокон соединительной ткани является поиск терапевтически значимых молекулярных мишеней, воздействие на которые предотвращает или уменьшает фиброз [10, 11].
На сегодняшний день исследователям коллагенового матрикса доступен ряд способов его визуализации. Во-первых, это рутинные методы окраски. Так, окраска по Массону применяется для окрашивания коллагеновых волокон анилиновым синим ортохроматически. Такой подход эффективен для оценки площади фиброза [12]. Анилиновый синий также может использоваться в качестве монокрасителя [13]. Данная окраска предназначена для микроскопии проходящего света видимого диапазона, однако не подходит для конфокальной лазерной микроскопии, позволяющей создавать трехмерные реконструкции срезов. Аналогичным недостатком обладает и рутинный метод окрашивания пикрофуксином по Ван-Гизону: данные о том, что срезы, окрашенные таким способом, пригодны для изучения с помощью конфокального микроскопа, отсутствуют. Вторым методом является окрашивание пикросириусом красным [14], который, в отличие от анилинового синего, способен к флуоресценции [15]. Однако в работе [16], где, в частности, осуществляли трехмерную визуализацию коллагеновых волокон с использованием данного красителя, было показано, что его сродство к соединительной ткани существенно зависит от типа фиксации. В-третьих, метод генерации второй гармоники [17]. Он позволяет визуализировать расположение коллагеновых волокон в объеме образца и проводить вычисления для построения пространственных моделей соединительной ткани [12, 18]. И хотя данный метод разработан на базе мультифотонных микроскопов, он доступен не для всех представителей данного класса оптических приборов, что накладывает аппаратное ограничение на методику. В-четвертых, предлагается использование сканирующей электронной микроскопии, однако получение трехмерных изображений волокон межклеточного вещества требует предварительной процедуры децелюлляризации матрикса [9], что делает невозможным изучение взаимодействий клеток с матриксом.
Указанные выше недостатки существующих методик обусловливают поиск других решений. Альтернативой может служить окрашивание трипановым синим. Данный краситель до настоящего времени использовался для оценки выживаемости клеток в различных условиях за счет своей способности проникать исключительно в погибшие клетки [19], а также в хирургии органа зрения для визуализации структур глаза [20]. Кроме того, трипановый синий применяется для витального окрашивания соединительной ткани [21]. Поскольку данный краситель способен флуоресцировать, он представляется перспективным для окрашивания срезов с целью их дальнейшего изучения методом конфокальной лазерной микроскопии.
Цель исследования — оценить возможность использования окрашивания трипановым синим срезов миокарда человека для изучения коллагеновых волокон сердца и, в частности, их трехмерной реконструкции.
Материалы и методы
Объектом исследования послужили срезы миокарда человека (n=9). Блоки фиксированных в формалине и залитых в парафин образцов получены из архива гистологического материала отдела общей и частной морфологии Института экспериментальной медицины (архив создан на основании решения локального этического комитета, заключение №58-9/1-684 от 11.12.2009 г.). Были изготовлены срезы толщиной 5 мкм (n=18). Перед окрашиванием со срезов удаляли парафин с помощью ксилола и регидратировали в этаноле нисходящей концентрации.
Окрашивание трипановым синим (Panreac, Испания) проводили по следующей методике (патентная заявка №RU 2024/22564): на срезы наносили 1% водный раствор фосфорномолибденовой кислоты на 15 мин при комнатной температуре, который впоследствии удаляли. Далее, не промывая препараты, наносили 1% водный раствор трипанового синего на 5 мин при тех же условиях. После этого краситель со срезов удаляли и промывали их в воде. Окрашивание 2% водным раствором анилинового синего (Unisource Chemicals Pvt. Ltd., Индия) выполняли по аналогичной методике. После окрашивания все срезы дегидратировали в изопропаноле и ксилоле и заключали в перманентную среду Bio Mount HM (Bio-Optica, Италия).
Снимки препаратов получали с помощью светового микроскопа Leica DM750 и цифровой фотокамеры ICC50 (Leica Microsystems, Германия; объектив Plan 10×/0.22), а также конфокального микроскопа LSM800 (Carl Zeiss AG, Германия; объектив Plan-Apochromat 63×/1.40 Oil DIC M27). Трехмерную реконструкцию осуществляли с использованием программного обеспечения ZEN-2012 (Carl Zeiss AG, Германия). Толщину волокон измеряли в программе ImageJ с помощью встроенного инструмента «прямая линия» (straight) и функции «измерить» (measure). Статистическую обработку данных выполняли в Microsoft Excel (Microsoft, США).
Результаты
Окрашивание трипановым синим дает различную по контрастности картину при микроскопии проходящего света видимого диапазона и при конфокальной микроскопии (рис. 1, б, в). Визуально трипановый синий высокоизбирательно окрашивает волокна соединительной ткани. Интенсивность видимого окрашивания зависит от времени приготовления фосфорномолибденовой кислоты и красителя. Наилучший результат окрашивания достигается при использовании кислоты и красителя, приготовленных непосредственно перед окрашиванием. Краситель, приготовленный 3 мес назад, обладает сниженным сродством к соединительной ткани, что проявляется ее бледной окраской. Фосфорномолибденовая кислота в водном растворе даже при хранении в непрозрачной таре не обеспечивает высокой селективности окрашивания уже через неделю.
При микроскопии проходящего света видимого диапазона волокна разной толщины визуализированы неодинаково. Крупные коллагеновые волокна, имеющие в среднем толщину 7,583±3,426 мкм, окрашиваются интенсивно. Тонкие, лежащие отдельно волокна, имеющие толщину в среднем 1,589±0,421 мкм, окрашиваются слабо, а волокна, имеющие диаметр в среднем 0,557±0,174 мкм, почти не окрашиваются. Наименьший выявленный диаметр волокна составил 0,279 мкм. Прослойки соединительной ткани, окружающие каждый кардиомиоцит (эндомизий), также окрашиваются, но при малом увеличении объектива рассмотреть их и тем более выявить волокна, их составляющие, не представляется возможным. Анилиновым синим данный тип волокон окрашивается сравнительно более интенсивно (рис. 1, а). Однако следует отметить, что анилиновый синий обладает некоторым, хотя и малым, сродством к цитоплазме кардиомиоцитов, окрашивая ее в серый цвет, что не характерно для трипанового синего.
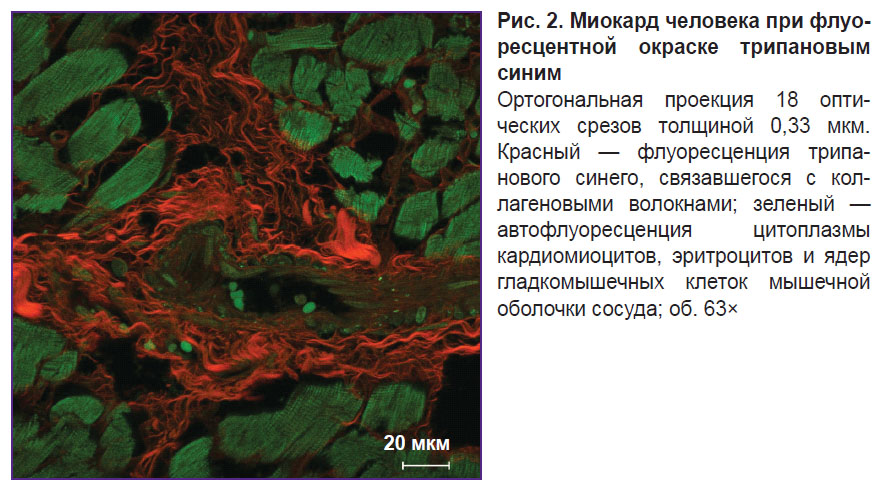
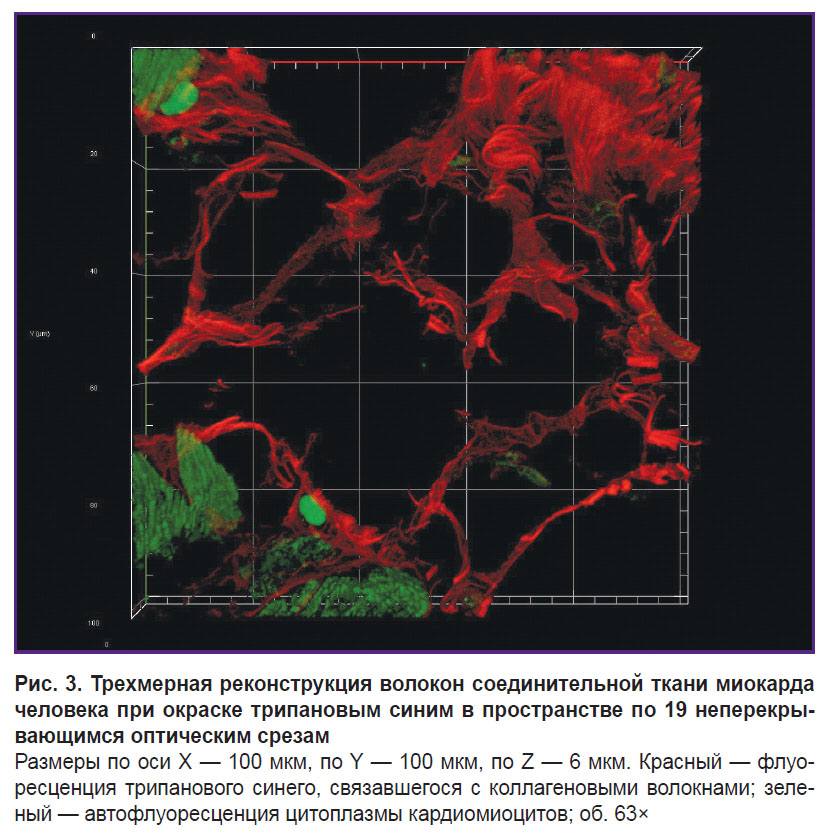
Флуоресценция коллагеновых волокон, окрашенных трипановым синим, наблюдается при возбуждении лазером с длиной волны 640 нм (рис. 2). Цитоплазма неокрашенных кардиомиоцитов флуоресцирует при возбуждении лазером с длиной волны 488 нм. Исходное изображение обладает высокой контрастностью и, следовательно, не требует тонкой настройки при обработке, что позволяет ускорить и упростить процесс анализа изображений с помощью программного обеспечения (ImageJ). Причем по сравнению с изображениями, полученными в ходе микроскопии проходящего света видимого диапазона, на изображениях, сделанных при помощи конфокального микроскопа, программа более избирательно и точно определяет коллагеновые волокна, включая самые тонкие, которые не были контрастно выявлены на светооптическом уровне. Интенсивность флуоресцентного сигнала от волокон диаметром более 0,4 мкм сопоставима с интенсивностью сигнала от волокон диаметром 4,0±1,0 мкм. Наименьший выявленный диаметр волокна составил 0,201 мкм. Трехмерная визуализация эндомизия (рис. 3) показала, что он представляет собой сеть, элементы которой не могут быть дифференцированы как отдельные структуры. Это свидетельствует о том, что размеры элементов меньше разрешающей способности конфокального микроскопа. Для толстых волокон стало возможным дать описание структур низшего порядка, входящих в их состав (см. рис. 2). Выявлено, что между близлежащими волокнами диаметром более 1,5 мкм располагаются волокна толщиной в среднем 0,315±0,040 мкм, идущие косо-поперечно по отношению к более толстым. Помимо хода волокон трехмерная визуализация позволяет определить поперечное сечение коллагеновых волокон: оно имеет неправильную, близкую к овальной, форму. С учетом полного пространственного положения волокна становится очевидным, что данную форму имеет именно поперечное, а не тангенциальное сечение волокон, как можно было бы предположить, основываясь на одном оптическом срезе.
Обсуждение
Трипановый синий является общедоступным реагентом, использующимся в медико-биологических исследованиях. Свое применение он находит в первую очередь в экспериментах, в которых необходимо оценить жизнеспособность клеток: как в культуре [22, 23], так и в многоклеточном организме на различных стадиях смоделированного патологического процесса [24]. Во-вторых, трипановый синий используют в хирургии глаза в целях визуализации физиологических и патологических структур, а именно внутренней глиальной пограничной мембраны и эпиретинальной мембраны [25], передней части капсулы хрусталика [26], а также для выявления разрывов сетчатки [27] и контрастирования трабекулярной сети при микроинвазивной хирургии глаукомы [28].
В указанных выше цитологических методах, а также при витальном окрашивании соединительной ткани трипановым синим [21, 29] используется способность красителя окрашивать ткани как ортохроматически, так и с проявлением флуоресценции. Причем последнее свойство открывает возможности для применения широкого спектра методов флуоресцентной микроскопии, включая собственно флуоресцентную микроскопию, конфокальную лазерную микроскопию, конфокальную лазерную микроскопию повышенного разрешения, мультифотонную микроскопию и микроскопию сверхвысокого разрешения. Все перечисленные методы позволяют получать детализированные изображения с высоким разрешением, а современные программы обработки — выполнять трехмерную реконструкцию срезов.
Применение фосфорномолибденовой кислоты позволило нам получить селективно окрашенные соединительнотканные волокна. Данный прием используется в многоцветных окрасках по Массону [30], по Маллори [31], по Гейденгайну [32], по Слинченко [33], а также при окраске пикросириусом красным [15]. Как и анилиновый синий, трипановый синий относят к анионным красителям, имеющим основные группы, в частности аминогруппы [34]. В свою очередь фосфорномолибденовая кислота является поливалентным анионом и связывается с положительно заряженными структурами, препятствуя прямому действию анионных красителей. Связывание фосфорномолибденовой кислоты с различными структурами неодинаково: наиболее интенсивно она связывается с цитоплазмой клеток и менее интенсивно — с соединительнотканными волокнами, оставляя доступной для связывания с молекулой трипанового синего положительно заряженную аминокислоту гистидин [35]. Таким образом, предварительная обработка ткани фосфорномолибденовой кислотой обеспечивает связывание красителя только с коллагеновыми волокнами.
Сравнение результатов флуоресценции при окрашивании трипановым синим по предложенной нами методике с результатами при окрашивании пикросириусом красным, представленными в литературе [15, 36], показало, что трипановый синий позволяет получить высококонтрастные изображения, сопоставимые при окрашивании пикросириусом красным с предварительной обработкой фосфорномолибденовой кислотой. При этом нет существенных различий ни в размерах наименьших выявляемых волокон, ни в высокой контрастности выявляемых структур по отношению к фону. В случае окрашивания трипановым синим флуоресценция коллагеновых волокон характеризуется длиной волны, отличной от длины волны флуоресценции цитоплазмы кардиомиоцитов, что позволяет получать эти сигналы изолированно. Благодаря данному обстоятельству такую окраску можно использовать как для избирательной визуализации коллагеновых волокон, так и для совизуализации клеток и соединительнотканного матрикса, их окружающих, причем без потери детализации структуры волокон.
Трехмерная реконструкция срезов, окрашенных пикросириусом красным, была выполнена в одной работе, где H.J. Kim и соавт. [16] представили полный протокол изготовления препарата почки мыши, начиная с фиксации. Опубликованные авторами иллюстрации свидетельствуют о недостаточной специфичности связывания красителя с элементами внеклеточного матрикса почки, что особенно заметно при сравнении с результатами иммуногистохимической реакции на коллаген I типа на том же материале. При окрашивании трипановым синим флуоресценция детектируется исключительно от волокон соединительной ткани, морфологические характеристики которых соответствуют коллагеновым волокнам [37].
Трехмерная визуализация коллагеновых волокон методом генерации второй гармоники является эффективным способом изучения коллагена. Преимущества данного метода заключаются, во-первых, в возможности изучать как нативные, так и фиксированные и окрашенные ткани, а во-вторых, в получении изображений высокого разрешения [38]. Этот метод в большей степени применим к коллагену I типа, который имеет высокоупорядоченную структуру и способен генерировать вторую гармонику. Сигнал второй гармоники от коллагенов III, IV и V типов может быть сниженным по интенсивности или вовсе отсутствовать. В таком случае судить о содержании этих коллагенов можно либо по суммарному сигналу от образца, либо после окрашивания, например пикросириусом красным [17, 39]. Трипановый синий в свою очередь связывается как с коллагеновыми волокнами соединительной ткани, представленными преимущественно коллагеном I типа, так и с базальными мембранами клеток, представленными коллагеном IV типа. Следует отметить, что микроскопия генерации второй гармоники обладает высокой информативностью, однако ее реализация требует дорогостоящего и высокоточного оборудования, установка которого является сложной технической задачей. Это снижает доступность методики [40].
Ограничения исследования. Несмотря на указанные достоинства предлагаемой нами методики, следует обратить внимание и на ограничения доказательной базы проведенного исследования, которые связаны с отсутствием параллельного представления полученных данных с использованием дополнительных референсных методов, таких как многофотонная микроскопия в режиме генерации второй гармоники и иммуногистохимическое исследование на коллагены I и III типа.
Заключение
Результаты исследования показали, что окрашивание трипановым синим позволяет изучать структуру коллагеновых волокон сердца человека на светооптическом уровне с помощью флуоресцентной микроскопии, а также создавать детализированные трехмерные реконструкции данных волокон. Представленный метод обладает рядом преимуществ по сравнению с другими методами трехмерной визуализации коллагеновых волокон, а именно: общедоступностью реагентов, высокой избирательностью окрашивания, возможностью получения контрастных и детализированных изображений изучаемых объектов с высоким разрешением.
Финансирование. Работа выполнена за счет средств государственного задания ФГБНУ «ИЭМ» FGWG-2024-0015.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Humphrey J.D., Dufresne E.R., Schwartz M.A. Mechanotransduction and extracellular matrix homeostasis. Nat Rev Mol Cell Biol 2014; 15(12): 802–812, https://doi.org/10.1038/nrm3896.
- Smoluk L., Protsenko Y. Viscoelastic properties of the papillary muscle: experimental and theoretical study. Acta Bioeng Biomech 2012; 14(4): 37–44.
- Orgel J.P., San Antonio J.D., Antipova O. Molecular and structural mapping of collagen fibril interactions. Connect Tissue Res 2011; 52(1): 2–17, https://doi.org/10.3109/03008207.2010.511353.
- Potekhina Y.P., Filatova A.I., Tregubova E.S., Mokhov D.E. Mechanosensitivity of cells and its role in the regulation of physiological functions and the implementation of physiotherapeutic effects (review). Sovremennye tehnologii v medicine 2021; 12(4): 77–89, https://doi.org/10.17691/stm2020.12.4.10.
- Meyers V.E., Zayzafoon M., Douglas J.T., McDonald J.M. RhoA and cytoskeletal disruption mediate reduced osteoblastogenesis and enhanced adipogenesis of human mesenchymal stem cells in modeled microgravity. J Bone Miner Res 2005; 20(10): 1858–1866, https://doi.org/10.1359/JBMR.050611.
- Gilbert P.M., Havenstrite K.L., Magnusson K.E., Sacco A., Leonardi N.A., Kraft P., Nguyen N.K., Thrun S., Lutolf M.P., Blau H.M. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science 2010; 329(5995): 1078–1081, https://doi.org/10.1126/science.1191035.
- Tondon A., Kaunas R. The direction of stretch-induced cell and stress fiber orientation depends on collagen matrix stress. PLoS One 2014; 9(2): e89592, https://doi.org/10.1371/journal.pone.0089592.
- Bishop J.E., Rhodes S., Laurent G.J., Low R.B., Stirewalt W.S. Increased collagen synthesis and decreased collagen degradation in right ventricular hypertrophy induced by pressure overload. Cardiovasc Res 1994; 28(10): 1581–1585, https://doi.org/10.1093/cvr/28.10.1581.
- Sanchez-Quintana D., Climent V., Ho S.Y., Anderson R.H. Myoarchitecture and connective tissue in hearts with tricuspid atresia. Heart 1999; 81(2): 182–191, https://doi.org/10.1136/hrt.81.2.182.
- Mishra P.K., Givvimani S., Chavali V., Tyagi S.C. Cardiac matrix: a clue for future therapy. Biochim Biophys Acta 2013; 1832(12): 2271–2276, https://doi.org/10.1016/j.bbadis.2013.09.004.
- González A., López B., Ravassa S., San José G., Díez J. The complex dynamics of myocardial interstitial fibrosis in heart failure. Focus on collagen cross-linking. Biochim Biophys Acta Mol Cell Res 2019; 1866(9): 1421–1432, https://doi.org/10.1016/j.bbamcr.2019.06.001.
- Perestrelo A.R., Silva A.C., Oliver-De La Cruz J., Martino F., Horváth V., Caluori G., Polanský O., Vinarský V., Azzato G., de Marco G., Žampachová V., Skládal P., Pagliari S., Rainer A., Pinto-do-Ó P., Caravella A., Koci K., Nascimento D.S., Forte G. Multiscale analysis of extracellular matrix remodeling in the failing heart. Circ Res 2021; 128(1): 24–38, https://doi.org/10.1161/CIRCRESAHA.120.317685.
- Nikitina I.A., Razenkova V.A., Fedorova E.A., Kirik O.V., Korzhevskii D.E. Technology of combined identification of macrophages and collagen fibers in liver samples. Sovremennye tehnologii v medicine 2024; 16(3): 24–29, https://doi.org/10.17691/stm2024.16.3.03.
- Junqueira L.C., Bignolas G., Brentani R.R. Picrosirius staining plus polarization microscopy, a specific method for collagen detection in tissue sections. Histochem J 1979; 11(4): 447–455, https://doi.org/10.1007/BF01002772.
- Dolber P.C., Spach M.S. Conventional and confocal fluorescence microscopy of collagen fibers in the heart. J Histochem Cytochem 1993; 41(3): 465–469, https://doi.org/10.1177/41.3.7679127.
- Kim H.J., Kim J., Choi J., Sun W. Chemical fluorescence-based dye staining for 3-dimensional histopathology analysis. Anim Cells Syst (Seoul) 2022; 26(2): 45–51, https://doi.org/10.1080/19768354.2022.2049641.
- Cox G., Kable E., Jones A., Fraser I., Manconi F., Gorrell M.D. 3-dimensional imaging of collagen using second harmonic generation. J Struct Biol 2003; 141(1): 53–62, https://doi.org/10.1016/s1047-8477(02)00576-2.
- Wülfers E.M., Greiner J., Giese M., Madl J., Kroll J., Stiller B., Kohl P., Rog-Zielinska E.A., Fürniss H.E. Quantitative collagen assessment in right ventricular myectomies from patients with tetralogy of Fallot. Europace 2021; 23(23 Suppl 1): i38–i47, https://doi.org/10.1093/europace/euaa389.
- Zanatta G., Steffens D., Braghirolli D.I., Fernandes R.A., Netto C.A., Pranke P. Viability of mesenchymal stem cells during electrospinning. Braz J Med Biol Res 2012; 45(2): 125–130, https://doi.org/10.1590/s0100-879x2011007500163.
- Dada V.K., Sharma N., Sudan R., Sethi H., Dada T., Pangtey M.S. Anterior capsule staining for capsulorhexis in cases of white cataract: comparative clinical study. J Cataract Refract Surg 2004; 30(2): 326–333, https://doi.org/10.1016/S0886-3350(03)00573-X.
- King L.S. Vital staining of the connective tissues. J Exp Med 1938; 68(1): 63–72, https://doi.org/10.1084/jem.68.1.63.
- Srivastava V.K., Singh R.K., Malhotra S.N., Singh A. To evaluate cytotoxicity of resin-based restorative materials on human lymphocytes by trypan blue exclusion test: an in vitro study. Int J Clin Pediatr Dent 2010; 3(3): 147–152, https://doi.org/10.5005/jp-journals-10005-1070.
- Hammoudeh S.M., Hammoudeh A.M., Hamoudi R. High-throughput quantification of the effect of DMSO on the viability of lung and breast cancer cells using an easy-to-use spectrophotometric trypan blue-based assay. Histochem Cell Biol 2019; 152(1): 75–84, https://doi.org/10.1007/s00418-019-01775-7.
- Procel N., Camacho K., Verboven E., Baroja I., Guerrero P.A., Hillen H., Estrella-García C., Vizcaíno-Rodríguez N., Sansores-Garcia L., Santamaría-Naranjo A., Romero-Carvajal A., Caicedo A., Halder G., Moya I.M. In vivo tracking and 3D mapping of cell death in regeneration and cancer using trypan blue. Cells 2024; 13(16): 1379, https://doi.org/10.3390/cells13161379.
- Teba F.A., Mohr A., Eckardt C., Wong D., Kusaka S., Joondeph B.C., Feron E.J., Stalmans P., Van Overdam K., Melles G.R. Trypan blue staining in vitreoretinal surgery. Ophthalmology 2003; 110(12): 2409–2412, https://doi.org/10.1016/s0161-6420(03)00716-4.
- Fridman G., Rizzuti A.E., Liao J., Rolain M., Deutsch J.A., Kaufman S.C. Trypan blue as a surgical adjunct in pediatric cataract surgery. J Cataract Refract Surg 2016; 42(12): 1774–1778, https://doi.org/10.1016/j.jcrs.2016.10.012.
- Jackson T.L., Kwan A.S., Laidlaw A.H., Aylward W. Identification of retinal breaks using subretinal trypan blue injection. Ophthalmology 2007; 114(3): 587–590, https://doi.org/10.1016/j.ophtha.2006.05.079.
- Parker J.S., Parker A., Parker J.S. Trypan blue-assisted microinvasive glaucoma surgery. J Cataract Refract Surg 2017; 43(12): 1613, https://doi.org/10.1016/j.jcrs.2017.10.031.
- Adams C.W., Bayliss O.B. Permeability of inner and outer layers of rat and rabbit aortic wall. Two new microscopic test with trypan blue. Atherosclerosis 1977; 26(4): 419–426, https://doi.org/10.1016/0021-9150(77)90112-5.
- Masson P. Some histological methods. Trichrome stainings and their preliminary technique. J Tech Methods 1929; 12: 75–90.
- Mallory F.B. A contribution to staining methods: I. A differential stain for connective-tissue fibrillae and reticulum. II. Chloride of iron haematoxylin for nuclei and fibrin. III. Phosphotungstic acid haematoxylin for neuroglia fibres. J Exp Med 1900; 5(1): 15–20, https://doi.org/10.1084/jem.5.1.15.
- Heidenhain M. Über die Mallorysche Bindegewebsfärbung mit Karmin und Azokarmin als Vorfarben. Z Wiss Mikrosk 1915; 32: 361–372.
- Слинченко Н.З. Быстрая и прочная окраска соединительной ткани, гиалина, фибрина и фибриноидов. Архив патологии 1964; 26: 84.
- Puchtler H., Isler H. The effect of phosphomolybdic acid on the stainability of connective tissues by various dyes. J Histochem Cytochem 1958; 6(4): 265–270, https://doi.org/10.1177/6.4.265.
- Everett M.M., Miller W.A. The role of phosphotungstic and phosphomolybdic acids in connective tissue staining. I. Histochemical studies. Histochem J 1974; 6(1): 25–34, https://doi.org/10.1007/BF01011535.
- Weis S.M., Emery J.L., Becker K.D., McBride D.J. Jr, Omens J.H., McCulloch A.D. Myocardial mechanics and collagen structure in the osteogenesis imperfecta murine (oim). Circ Res 2000; 87(8): 663–669, https://doi.org/10.1161/01.res.87.8.663.
- Ushiki T. Collagen fibers, reticular fibers and elastic fibers. A comprehensive understanding from a morphological viewpoint. Arch Histol Cytol 2002; 65(2): 109–126, https://doi.org/10.1679/aohc.65.109.
- Bancelin S., Aimé C., Gusachenko I., Kowalczuk L., Latour G., Coradin T., Schanne-Klein M.C. Determination of collagen fibril size via absolute measurements of second-harmonic generation signals. Nat Commun 2014; 5: 4920, https://doi.org/10.1038/ncomms5920.
- Ajeti V., Nadiarnykh O., Ponik S.M., Keely P.J., Eliceiri K.W., Campagnola P.J. Structural changes in mixed Col I/Col V collagen gels probed by SHG microscopy: implications for probing stromal alterations in human breast cancer. Biomed Opt Express 2011; 2(8): 2307–2316, https://doi.org/10.1364/BOE.2.002307.
- Cicchi R., Pavone F.S. Probing collagen organization: practical guide for second-harmonic generation (SHG) imaging. Methods Mol Biol 2017; 1627: 409–425, https://doi.org/10.1007/978-1-4939-7113-8_27.