Ассоциация вариантов полиморфизма 786T>C (rs2070744) гена NOS3 с возрастными электрофизиологическими нарушениями миокарда
Цель исследования — изучить ассоциации показателей микроальтернаций ЭКГ-сигнала с различными вариантами полиморфизма 786T>C (rs2070744) гена NOS3 у мужчин-северян зрелого и пожилого возраста.
Материалы и методы. В исследование включены 140 жителей Магаданской области (мужчины в возрасте 25–80 лет). Выборка была разделена на зрелый и пожилой период онтогенеза. В соответствии с наличием/отсутствием аллеля NOS3*С в генотипе мужчин в различных возрастных периодах были сформированы 2-е группы: 1-я группа — гомозиготные мужчины (генотип ТТ); 2-я группа — гетерозиготные и гомозиготные носители аллеля NOS3*C (генотипы ТС+СС). В работе использовали методы генетического SNP-тестирования и методы оценки характеристик дисперсионного картирования сердца.
Результаты. Выявлены возраст-ассоциированное нарушение дисперсионных характеристик ЭКГ-сигнала — индексов «Миокард» и «Ритм», а также электрофизиологические нарушения миокарда, которые в большей степени были характерны для мужчин пожилого возраста из группы носителей минорного аллеля NOS3*С (генотипы ТС+СС). Это сопровождалось синхронным возрастанием «жесткости» матрицы показателей дисперсионного картирования ЭКГ. Результаты двухфакторного дисперсионного анализа позволили установить, что варианты полиморфизма 786T>C (rs2070744) гена NOS3 имеют значимое влияние на гипертрофию желудочков (G9) при одновременном совокупном воздействии с фактором «Возраст» на индекс «Миокард», реполяризацию правого и левого желудочков (G5, G6) и их симметрию деполяризации (G7).
Заключение. Полученные результаты указывают на необходимость проведения мониторинговых исследований основных характеристик дисперсионного картирования ЭКГ в сочетании с оценкой полиморфизма 786T>C (rs2070744) гена NOS3 как базы в формировании основ персонализированной и превентивной медицины. Установлено, что наличие минорного аллеля NOS3*Сполиморфизма 786T>C (rs2070744) локуса NOS3 может рассматриваться в качестве дополнительного фактора риска возраст-ассоциированных электрофизиологических нарушений миокарда.
Введение
В настоящее время в клинической практике и при скрининге населения широко применяется метод дисперсионного картирования электрокардиограммы (ДК ЭКГ), преимуществом которого является ранняя диагностика и выявление изменений микроальтернаций ЭКГ-сигнала. Данный метод позволяет оценивать ионно-электролитные и метаболические изменения различных областей сердца, проявляющиеся в отклонениях процессов де- и реполяризации миокарда [1–3]. Однако на современном этапе развития медико-биологических наук в области изучения физиологических механизмов адаптационных перестроек сердечно-сосудистой системы необходимо учитывать молекулярно-генетические детерминанты, влияющие на развитие гемодинамических нарушений.
Известно, что оксид азота (NO) — это плейотропная молекула, играющая решающую роль в поддержании равновесия сердечно-сосудистой системы. NO осуществляет ряд важных функций, включая модуляцию кровотока и кровообращения, регуляцию тромбообразования, воспаления и иммунных реакций. NO также участвует в нейронной активности. Получены доказательства влияния NO на регуляцию функций сердечно-сосудистой системы [4]. В организме человека NO эндогенно синтезируется из аргинина тремя изоформами фермента синтазы окиси азота, кодируемыми различными генами. Функциональные аспекты сердца в значительной степени зависят от эндотелиальной синтазы NO (eNOS) [5], являющейся продуктом экспрессии гена NOS3 (хромосомная локализация гена 7q35-7q36). Полиморфизмы в гене NOS3 тесно связаны с более высокой частотой возникновения сердечно-сосудистых заболеваний. Например, аллель C локуса NOS3 — полиморфизм 786T>C (rs2070744) — приводит к снижению экспрессии eNOS и, как следствие, к уменьшению выработки NO, что в свою очередь может сопровождаться увеличением риска развития гипертонии [6], преэклампсии [7], диабетической нефропатии [8] и мигрени [9]. Доказана ассоциация данного аллеля с более частыми эпизодами коронарного вазоспазма, разрывом аневризмы с последующим субарахноидальным кровоизлиянием и вазоспазмом [10, 11]. Ген NOS3 экспрессируется не только эндотелием сосудов, но и в кардиомиоцитах [12, 13], тромбоцитах [14] и эритроцитах [15].
Помимо молекулярно-генетических детерминант необходимо принимать во внимание факторы окружающей среды. Известно, что проживание в экстремальных условиях Севера вызывает напряжение в работе сердечно-сосудистой системы. Это обусловлено тем, что длительная экспозиция холода приводит к повышению тонуса периферических сосудов и энергозатрат организма [16]. Установлены существенное снижение продолжительности жизни в арктических и северных регионах по сравнению с регионами с благоприятными климатическими условиями, а также более высокая (в некоторых регионах до 30%) мужская смертность от болезней системы кровообращения [17, 18].
В связи с вышесказанным особую актуальность приобретают исследования, посвященные изучению молекулярно-генетических детерминант в развитии электрофизиологических нарушений миокарда у людей, проживающих и работающих в арктических и субарктических климатических зонах.
Цель исследования — изучить ассоциации показателей микроальтернаций ЭКГ-сигнала с различными вариантами полиморфизма 786T>C (rs2070744) гена NOS3 у мужчин-северян зрелого и пожилого возраста.
Материалы и методы
Проведено обследование 140 мужчин в возрасте 25–80 лет, постоянно проживающих в г. Магадане. Согласно возрастной периодизации, принятой на Международном симпозиуме по возрастной физиологии (Москва, 1965 г.), сформировано две выборки: зрелого (среднего) возраста — 75 человек (25–55 лет), пожилого и старческого возраста (далее — пожилой возраст) — 65 человек (61–80 лет).
Исследование проведено в соответствии с Хельсинкской декларацией и одобрено локальным этическим комитетом Научно-исследовательского центра «Арктика» Дальневосточного отделения Российской академии наук (НИЦ «Арктика» ДВО РАН) (протокол №002/021 от 26.11.2021 г.). До включения в исследование от каждого пациента было получено информированное согласие.
Материалом для генетического тестирования послужила кровь из локтевой вены добровольцев, взятая в пробирки с консервантом ЭДТА в количестве 15 мл. Геномную ДНК выделяли с использованием фенол-хлороформа. Генотипирование полиморфизма 786Т>С (rs 2070744) гена NOS3 проводили методом полимеразной цепной реакции на базе лаборатории молекулярной генетики человека кафедры медико-биологических дисциплин Белгородского государственного национального исследовательского университета с использованием коммерческих наборов «SNP-Скрин» («Синтол», Россия).
Показатели дисперсионного картирования ЭКГ сердца получали с использованием прибора «Кардиовизор-06С» (ООО «Медицинские компьютерные системы», Россия). Оценивали индекс микроальтернаций миокарда — «Миокард»: значения менее 15% — «норма»; от 15 до 19% — свидетельствуют о пограничных состояниях («пограничные значения» — граница «нормы» и «патологии»); от 20% и более — свидетельствуют о вероятной патологии («патология»). Для индекса «Ритм», отражающего вариабельность сердечного ритма, отсутствие существенных отклонений соответствует значениям меньше 20%; значения, равные 100%, указывают на максимально выраженные изменения характеристик вариабельности R–R-интервалов, что свойственно аритмиям или сильному стрессу. Степень выраженности и локализации электрофизиологических изменений де- и реполяризации миокарда предсердий и желудочков отражает «Код детализации», включающий в себя временны́е интервалы кардиокомплекса PQRST: G1–G2 — деполяризация правого и левого предсердий; G3–G4 — деполяризация правого (ПЖ) и левого желудочков (ЛЖ); G5–G6 — реполяризация ПЖ и ЛЖ; G7 — симметрия деполяризации желудочков; G8 — внутрижелудочковые блокады; G9 — гипертрофия желудочков [19].
Статистическую обработку данных проводили с использованием программы Statistica 6.0. Частоты генотипов и аллелей рассчитывали в соответствии с законом Харди–Вайнберга; сравнение частот генотипов осуществляли с применением критерия χ2. Проверку на нормальность распределения измеренных переменных проводили на основе теста Шапиро–Уилка. Для характеристики признаков рассчитывали среднюю арифметическую величину (M) и стандартное отклонение (SD). Межгрупповые различия определяли в каждой возрастной группе с помощью t-критерия Стьюдента для независимых выборок. Для множественных сравнений использовали факторный анализ c применением метода главных компонент с вращением Varimax и нормализацией Кайзера, а также двуфакторный дисперсионный анализ (ANOVA). Для выявления статистически значимых различий между группами проводили апостериорный анализ с помощью теста для множественных сравнений Шеффе. Критический уровень значимости принимали при р≤0,05.
Результаты и обсуждение
Установлено, что популяционное распределение частот генотипов и аллелей исследуемого локуса соответствует равновесию Харди–Вайнберга. Результаты SNP-генотипирования свидетельствуют о наличии двух аллелей в выборке — NOS3*T и NOS3*С.
Наиболее распространенным является аллель NOS3*T, который встречается с частотой 0,68 среди мужчин зрелого возраста и с частотой 0,64 среди пожилых мужчин. Частота минорного аллеля NOS3*С, связанного с физиологически сниженной продукцией NO, составила 0,32 и 0,36 у мужчин зрелого и пожилого возраста соответственно.
Для дальнейшего анализа каждая возрастная выборка была разделена на 2 группы в соответствии с наличием/отсутствием аллеля NOS3*С в генотипе: 1-я группа — гомозиготные мужчины (генотип ТТ), у которых отсутствует минорный аллель NOS3*C и генетически сохранена нормальная продукция физиологических концентраций NO (зрелый возраст — 34 человека, пожилой возраст — 21 человек) и 2-я группа — гетерозиготные и гомозиготные носители аллеля NOS3*C (генотипы ТС+СС), у которых наблюдается генетически обусловленная сниженная выработка NO эндотелием сосудов (зрелый возраст — 41 человек, пожилой возраст — 44 человека).
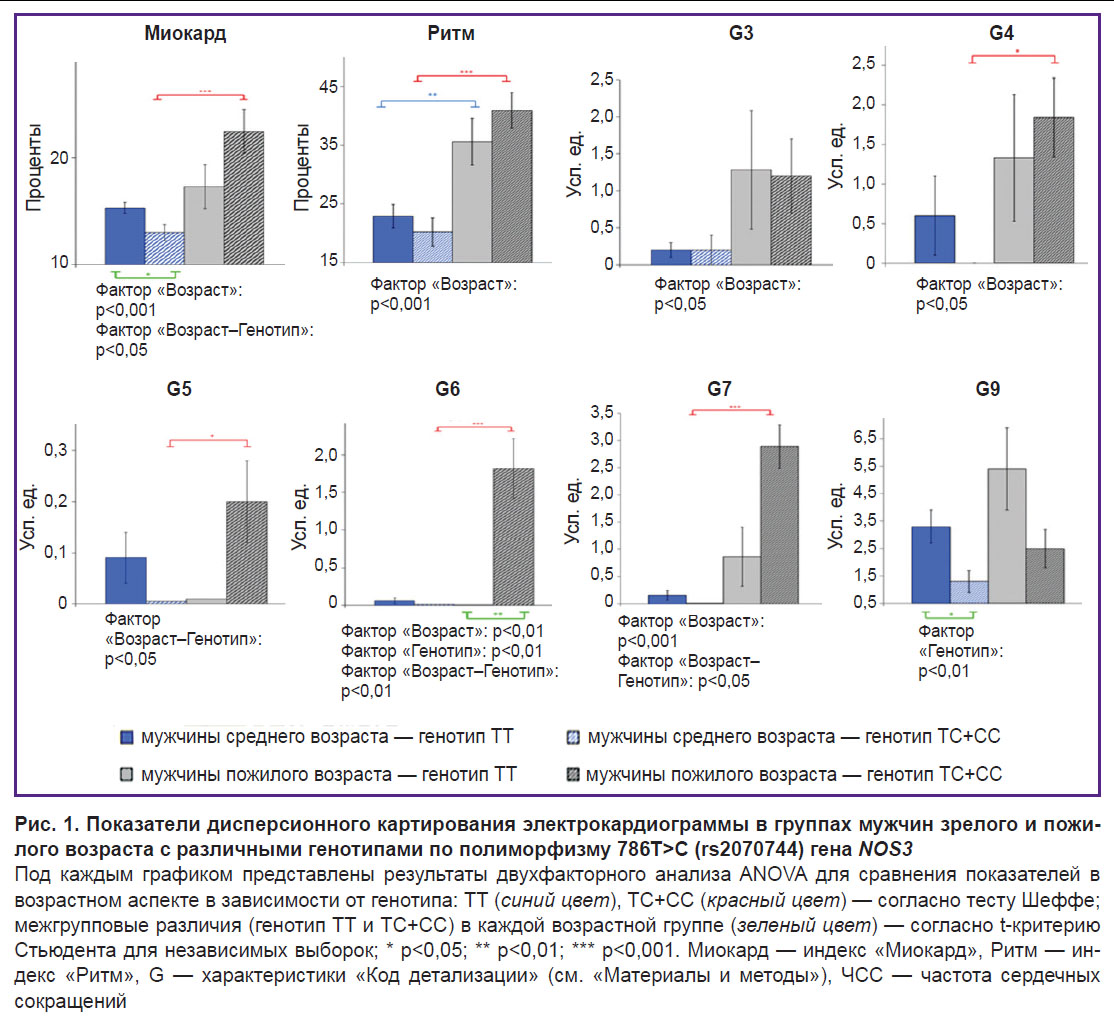
Полученные данные указывают, что значения индекса «Ритм» ассоциированы с возрастом обследуемых добровольцев. Так, в 1-й группе индекс возрастает с увеличением возраста с 23±12 до 36±18%; р=0,003. Аналогичная динамика наблюдается и во 2-й группе (ТС+СС) — показатель возрастает с 20±15 до 41±20%; р<0,001. По индексу «Миокард» у мужчин зрелого возраста, вне зависимости от проявления в генотипе аллеля NOS3*С, в целом преобладали средние значения нормы (≥15%). У пожилых мужчин 1-й группы значение данного индекса составило 17±9%, что указывает на незначительные изменения работы миокарда в сторону проявления пограничных состояний, у пожилых мужчин 2-й группы — 23±13%; р<0,01. Патологические проявления среди пожилых мужчин 2-й группы (носители минорного аллеля, генотипы ТС+СС) в сравнении с мужчинами зрелого возраста обусловлены деполяризацией ПЖ и ЛЖ (G3–G4), реполяризацией ЛЖ сердца (G6) и симметрией деполяризации желудочков (G7); р<0,05.
На рис. 1 представлены наиболее информативные результаты двухфакторного дисперсионного анализа показателей ДК ЭКГ у мужчин с различными генотипами по полиморфизму 786T>C (rs2070744) гена NOS3 (G1–G2 и G8 исключены, так как отсутствовали статистически значимые различия). Установлено, что фактор «Возраст» влияет на индексы «Миокард» (р=0,004) и «Ритм» (р<0,001), а также на микроальтернации при деполяризации ПЖ и ЛЖ (G3–G4; р=0,03), симметрию де- и реполяризации желудочков (G7) (р<0,001) и реполяризацию ЛЖ сердца (G6) (р=0,005). При этом совокупное взаимное влияние как возрастного, так и генетического (полиморфизм 786T>C (rs2070744) гена NOS3)факторов наблюдается относительно индекса «Миокард» (p=0,02), а также G5 (p=0,02), G6 (р=0,002) и G7 (р=0,04). Статистически значимое влияние только генетического фактора (на рис. 1 — «Генотип») было отмечено относительно G6 (p=0,005) и G9 (p=0,007), что может свидетельствовать о возраст-ассоциированном и генетически обусловленном их влиянии на ДК ЭКГ.
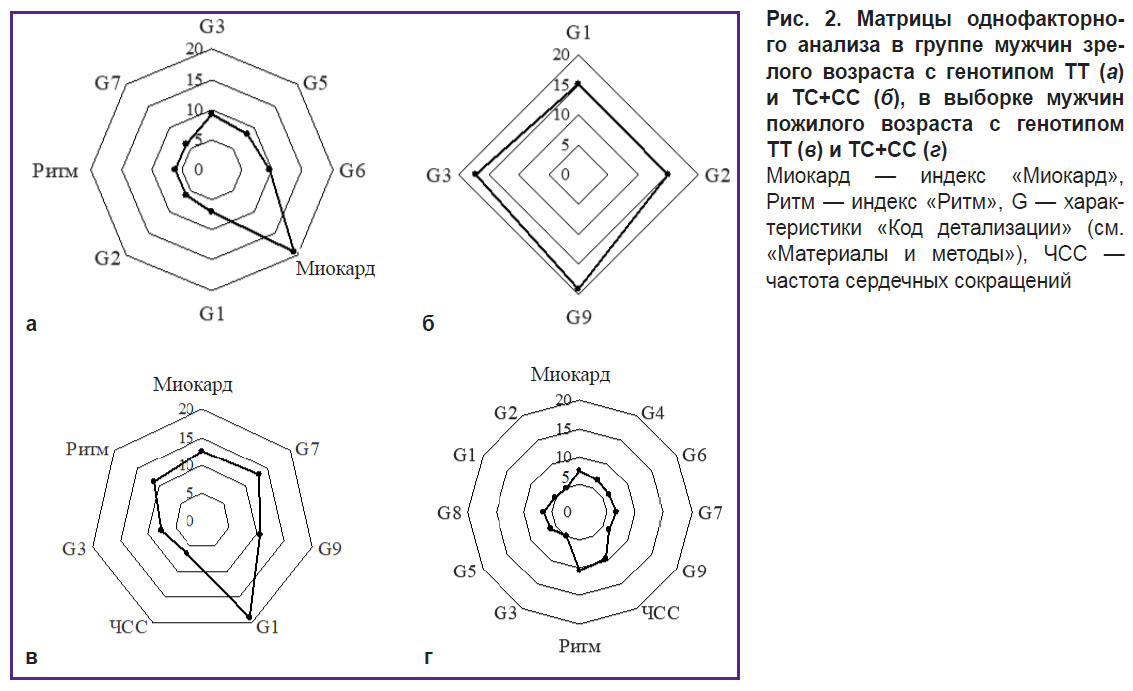
Для комплексной оценки ассоциаций показателей ДК ЭКГ и исследованного полиморфизма 786T>C (rs2070744) гена NOS3 в каждой возрастной группе был проведен факторный анализ. Рассчитана количественная оценка влияния фактора на ДК ЭКГ (в процентах), а также удельное значение ЭКГ (в процентах) каждого из показателей, входящего в структуру фактора (табл. 1 и 2). Исходя из удельных значений построены матрицы основных показателей ДК ЭКГ (рис. 2).
|
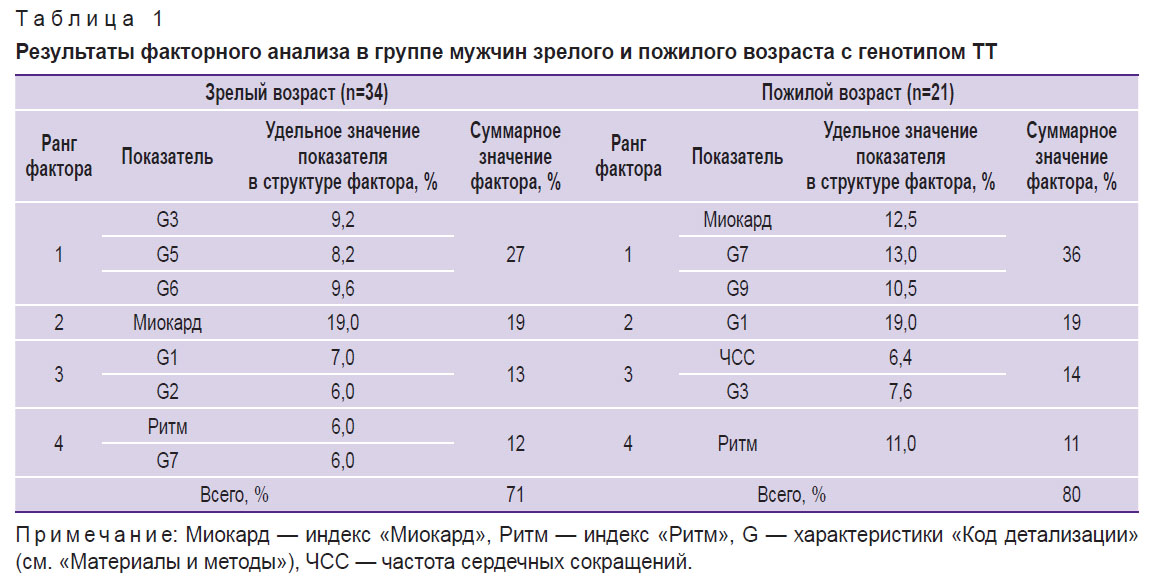
Таблица 1. Результаты факторного анализа в группе мужчин зрелого и пожилого возраста с генотипом ТТ |
|
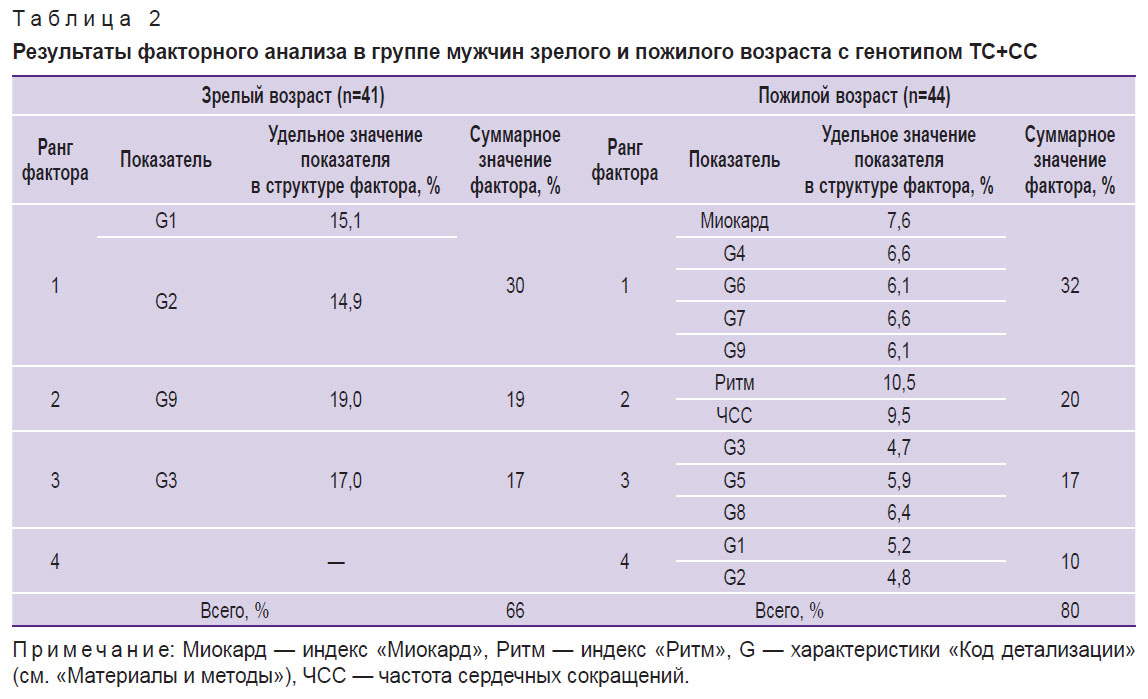
Таблица 2. Результаты факторного анализа в группе мужчин зрелого и пожилого возраста с генотипом ТС+СС |
В выборке мужчин 1-й группы (гомозиготы ТТ) по мере увеличения возраста отмечаются незначительные изменения в де- и реполяризации миокарда на фоне негативного сдвига в регуляции сердечного ритма: увеличение средних значений индекса «Ритм» и увеличение доли лиц со значениями данного показателя более 50%. Аналогичную картину можно наблюдать во 2-й группе (ТС+СС), однако с более выраженными отклонениями в де- и реполяризации миокарда. Данные изменения свидетельствуют об отклонениях вариабельности сердечного ритма от нормы и напряжении систем регуляции ритма сердца [19]. Полученные нами данные согласуются с результатами исследования, проведенного среди жителей Европейского Севера (г. Сыктывкар), в котором также отражено увеличение индекса «Ритм» в возрастном аспекте [20]. В работе Г.Г. Иванова и соавт. [21] при анализе данных 537 820 человек из 25 регионов Российской Федерации было показано, что зависимость индекса «Миокард» от возраста и пола практически отсутствует. Однако существует возрастная зависимость от распространенности диапазонов значений индекса «Миокард»: «норма», «пограничные значения» и «патология». В исследовании установлена зависимость снижения доли обследуемых с нормальными значениями индекса «Миокард» одновременно с увеличением распространенности патологических и пограничных значений индекса с 55 и 35 лет соответственно.
Согласно нашим данным, в рассматриваемых группах встречаются единичные случаи с индексом «Миокард» более 20% среди мужчин зрелого возраста. В пожилом возрасте количество случаев увеличивается в 1-й и 2-й группах до 6 и 13 человек соответственно. Из 13 человек 2-й группы (ТС+СС) высокая вероятность патологии сердца (индекс «Миокард» ≥50%) диагностирована у 6 пожилых мужчин.
Отметим, что во 2-й группе мужчин зрелого возраста (ТС+СС), несмотря на исходные значения индекса «Миокард», не выходящие за пределы нормативного диапазона, отмечаются изменения микроальтернаций при де- и реполяризации миокарда сердца. Частота проявления данных нарушений возрастает в выборке мужчин пожилого возраста: преобладали комбинированные изменения реполяризации в боковых и передних отделах ЛЖ (G6). Кроме того, у пожилых мужчин значительно чаще встречались изменения по G6 относительно сверстников из 1-й группы (ТТ).
Из приведенных на рис. 1 данных видно, что только у мужчин 2-й группы (ТС+СС) была отмечена статистически значимая возрастная динамика G4 и G7, которые в совокупности являются признаком нарушений коронарного кровотока [1, 19]. Негативная динамика также наблюдалась относительно дисперсионных колебаний зубца Т (G5–G6), возрастание которых часто сопутствует недостаточной оксигенации миокарда. При этом проведенный двухфакторный дисперсионный анализ свидетельствует о суммарном влиянии возраста и генотипа на данные характеристики ДК ЭКГ. Необходимо учитывать индивидуальную совокупность проявлений характеристик G1–G9 «Кода детализации», которые могут демонстрировать различное происхождение отклонений. Случаи отклонений одновременно по G3–G4, G7 указывают на патологические признаки ишемии миокарда, а изменения по G7 при отсутствии отклонений G3–G4 — на отклонения неишемического генеза [1, 19]. Согласно нашим данным, среди пожилых мужчин 1-й группы (ТТ) на фоне преобладания «пограничных значений» вышеописанных показателей зафиксирован лишь один случай возможной ишемии миокарда, тогда как у пожилых мужчин 2-й группы (ТС+СС) совокупная встречаемость пограничных значений G3–G7 отмечалась у 5 человек, что, несомненно, требует их клинического дообследования.
Результаты двухфакторного дисперсионного анализа (см. рис. 1) свидетельствуют о статистически значимом влиянии фактора «Возраст» на микроальтернации при деполяризации ПЖ и ЛЖ (G3–G4), на симметрию деполяризации желудочков (G7) и реполяризацию ЛЖ (G6) сердца. Кроме того, возраст комплексно влияет на изменение показателей индексов «Миокард» и «Ритм». Совместное статистически значимое влияние факторов «Возраст» и «Генотип» было зафиксировано относительно G5, G6, G7 и индекса «Миокард», а влияние лишь генетического фактора было отмечено для G6 и G9.
Результаты проведенного факторного анализа показали, что у мужчин зрелого возраста 1-й группы (ТТ) из всех 12 включенных в анализ показателей ДК ЭКГ 8 характеристик были объединены в 4 фактора с общим удельным значением 71%. У пожилых мужчин той же группы структура матрицы состояла из 4 факторов и 7 показателей с возрастанием суммарного значения матрицы до 80% (см. табл. 1; рис. 2, а, в).
Во 2-й группе (ТС+СС) у мужчин зрелого возраста только 4 из 12 показателей ДК ЭКГ (3 фактора) были включены в структуру матрицы с общим удельным значением 66%. В пожилом возрасте совокупность факторов, определяющих матрицу, увеличилась до четырех с включением в нее всех 12 анализируемых показателей ДК ЭКГ с общим удельным значением 80% (см. табл. 2; рис. 2, б, г).
В настоящее время индекс «Миокард» является главным маркером клинической интерпретации скрининг-заключения [19]. Результаты нашего исследования показали, что в 1-й группе (отсутствие аллеля NOS3*С, гомозиготы ТТ) у мужчин зрелого возраста данный индекс представлен во 2-м факторе с наибольшим удельным значением, равным 19%. У мужчин пожилого возраста он смещается в 1-й фактор, где имеет значение в структуре матрицы 12,5%. У мужчин 2-й группы (носителей минорного аллеля NOS3*С, генотипы ТС+СС) индекс «Миокард» появляется в структуре факторов лишь у представителей пожилого возраста.
Показатель G9 считается наиболее чувствительным индикатором компенсаторных и патологических реакций миокарда желудочков [1, 19]. Так, у мужчин зрелого возраста 1-й группы (гомозиготы ТТ) G9 не имел значимого вклада в совокупности анализируемых показателей и не был включен в структуру матрицы. В выборке мужчин пожилого возраста G9 был зафиксирован в структуре 1-го фактора с удельным значением 10,5%. Для мужчин зрелого возраста 2-й группы (ТС+СС) G9 выступал в качестве самостоятельного фактора (2-й фактор) — 19%.
Из представленных матриц (см. рис. 2) видно, что ключевым показателем у мужчин зрелого возраста 1-й группы (ТТ) является индекс «Миокард». У мужчин пожилого возраста наибольший вклад в матрицу вносит G1, отражающий совокупность вегетативных реакций, в частности усиления/дефицита вагусных влияний на ритм сердца [22].
Совершенно иная картина наблюдается у мужчин 2-й группы (ТС+СС). У представителей зрелого возраста наибольшее удельное значение в матрице принадлежало G1–G2 (1-му фактору, 30%), которые отражают дисперсионные колебания зубца Р. Это может свидетельствовать о значительных отклонениях вегетативного обеспечения организма уже на данном возрастном этапе. В пожилом возрасте кластер G1–G2 перемещается в последний (4-й) фактор и мы наблюдаем трансформацию (разворачивание) матрицы: включение в нее всех 12 проанализированных показателей ДК ЭКГ.
Данный факт изменения структуры матрицы, с одной стороны, демонстрирует способность сердечно-сосудистой системы поддерживать свое функционирование в изменяющихся условиях (в данном случае это возрастной аспект), а с другой — приводит к снижению ее пластичности. Это можно рассматривать как «цену», которую организм платит за обеспечение своей жизнедеятельности в условиях влияния экстремальных факторов среды.
Заключение
Полученные результаты указывают на необходимость проведения мониторинговых исследований основных показателей ДК ЭКГ в сочетании с оценкой полиморфизма гена NOS3 как основы для формирования персонализированной и превентивной медицины. Установлено, что наличие минорного аллеля NOS3*C полиморфизма 786T>C (rs2070744) гена NOS3 может рассматриваться в качестве дополнительного фактора риска возраст-ассоциированных электрофизиологических нарушений миокарда у мужчин, проживающих в экстремальных условиях Севера.
Финансирование. Работа выполнена за счет бюджетного финансирования НИЦ «Арктика» ДВО РАН в рамках выполнения темы «Изучение межсистемных и внутрисистемных механизмов реакций в формировании функциональных адаптивных резервов организма человека “северного типа” на разных этапах онтогенеза лиц, проживающих в дискомфортных и экстремальных условиях с определением интегральных информативных индексов здоровья» (рег. номер АААА-А21-121010690002-2).
Конфликт интересов отсутствует.
Литература
- Иванов Г.Г., Сула А.С. Дисперсионное ЭКГ-картирование: теоретические основы и клиническая практика. М: Техносфера; 2009.
- Esina E.Y., Zuikova A.A., Dobrynina I.S., Lyutov V.V., Tsygan V.N. ECG dispersion mapping in preclinical diagnosis of cardiovascular diseases. Sovremennye tehnologii v medicine 2021; 12(5): 87–92, https://doi.org/10.17691/stm2020.12.5.10.
- Масленникова О.М., Ардашев В.Н., Новиков Е.М., Степанов М.М., Стеблецов С.В., Кириллова Т.Б., Тарабарина Н.Б., Перец Е.М., Фурсов А.Н. Оценка предтестовой вероятности ишемической болезни сердца по данным дисперсионного картирования электрокардиограммы и анализа вариабельности сердечного ритма. Клиническая медицина 2022; 100(4–5): 178–184, https://doi.org/10.30629/0023-2149-2022-100-4-5-178-184.
- McIntyre M., Dominiczak A.F. Nitric oxide and cardiovascular disease. Postgrad Med J 1997; 73(864): 630–634, https://doi.org/10.1136/pgmj.73.864.630.
- Tran N., Garcia T., Aniqa M., Ali S., Ally A., Nauli S.M. Endothelial nitric oxide synthase (eNOS) and the cardiovascular system: in physiology and in disease states. Am J Biomed Sci Res 2022; 15(2): 153–177.
- Niu W., Qi Y. An updated meta-analysis of endothelial nitric oxide synthase gene: three well-characterized polymorphisms with hypertension. PLoS One 2011; 6(9): e24266, https://doi.org/10.1371/journal.pone.0024266.
- Dai B., Liu T., Zhang B., Zhang X., Wang Z. The polymorphism for endothelial nitric oxide synthase gene, the level of nitric oxide and the risk for pre-eclampsia: a meta-analysis. Gene 2013; 519(1): 187–193, https://doi.org/10.1016/j.gene.2013.01.004.
- Shoukry A., Shalaby S.M., Abdelazim S., Abdelazim M., Ramadan A., Ismail M.I., Fouad M. Endothelial nitric oxide synthase gene polymorphisms and the risk of diabetic nephropathy in type 2 diabetes mellitus. Genet Test Mol Biomarkers 2012; 16(6): 574–579, https://doi.org/10.1089/gtmb.2011.0218.
- Eröz R., Bahadir A., Dikici S., Tasdemir S. Association of endothelial nitric oxide synthase gene polymorphisms (894G/T, -786T/C, G10T) and clinical findings in patients with migraine. Neuromolecular Med 2014; 16(3): 587–593, https://doi.org/10.1007/s12017-014-8311-0.
- Hendrix P., Foreman P.M., Harrigan M.R., Fisher W.S. Rd, Vyas N.A., Lipsky R.H., Lin M., Walters B.C., Tubbs R.S., Shoja M.M., Pittet J.F., Mathru M., Griessenauer C.J. The role of endothelial nitric oxide synthase -786 T/C polymorphism in cardiac instability following aneurysmal subarachnoid hemorrhage. Nitric Oxide 2017; 71: 52–56, https://doi.org/10.1016/j.niox.2017.10.008.
- Hendrix P., Foreman P.M., Harrigan M.R., Fisher W.S. 3rd, Vyas N.A., Lipsky R.H., Lin M., Walters B.C., Tubbs R.S., Shoja M.M., Pittet J.F., Mathru M., Griessenauer C.J. Endothelial nitric oxide synthase polymorphism is associated with delayed cerebral ischemia following aneurysmal subarachnoid hemorrhage. World Neurosurg 2017; 101: 514–519, https://doi.org/10.1016/j.wneu.2017.02.062.
- Balligand J.L., Kobzik L., Han X., Kaye D.M., Belhassen L., O’Hara D.S., Kelly R.A., Smith T.W., Michel T. Nitric oxide-dependent parasympathetic signaling is due to activation of constitutive endothelial (type III) nitric oxide synthase in cardiac myocytes. J Biol Chem 1995; 270(24): 14582–14586, https://doi.org/10.1074/jbc.270.24.14582.
- Petroff M.G., Kim S.H., Pepe S., Dessy C., Marbán E., Balligand J.L., Sollott S.J. Endogenous nitric oxide mechanisms mediate the stretch dependence of Ca2+ release in cardiomyocytes. Nat Cell Biol 2001; 3(10): 867–873, https://doi.org/10.1038/ncb1001-867.
- Wallerath T., Gath I., Aulitzky W.E., Pollock J.S., Kleinert H., Förstermann U. Identification of the NO synthase isoforms expressed in human neutrophil granulocytes, megakaryocytes and platelets. Thromb Haemost 1997; 77(1): 163–167.
- Kleinbongard P., Schulz R., Rassaf T., Lauer T., Dejam A., Jax T., Kumara I., Gharini P., Kabanova S., Ozüyaman B., Schnürch H.G., Gödecke A., Weber A.A., Robenek M., Robenek H., Bloch W., Rösen P., Kelm M. Red blood cells express a functional endothelial nitric oxide synthase. Blood 2006; 107(7): 2943–2951, https://doi.org/10.1182/blood-2005-10-3992.
- Бебякова Н.А., Левицкий С.Н., Первухина О.А. Полиморфизм генов ренин-ангиотензиновой системы у жителей Европейского Севера. Современные проблемы науки и образования 2019; 3, https://science-education.ru/ru/article/view?id=28793.
- Данилова И.А. Межрегиональное неравенство в продолжительности жизни в России и его составляющие по возрасту и причинам смерти. Социальные аспекты здоровья населения 2017; 5(57): 3, https://doi.org/10.21045/2071-5021-2017-57-5-3.
- Ревич Б.А., Харькова Т.Л., Кваша Е.А. Динамика, структура и особенности смертности трудоспособного населения Арктического макрорегиона. Анализ риска здоровью 2023; (1): 13–26, https://doi.org/10.21668/health.risk/2023.1.02.
- Программное обеспечение для скрининговых исследований сердца «КардиоВизор-06с» (руководство пользователя). М; 2004.
- Солонин Ю.Г., Марков А.Л., Бойко Е.Р., Лысенков И.И., Ефимов А.В. Особенности показателей дисперсионного картирования электрокардиограммы у практически здоровых жителей Севера. Профилактическая медицина 2013; 16(5): 48–52.
- Иванов Г.Г., Буланова Н.А., Николаева М.В., Щелыкалина С.П., Николаев Д.В., Халаби Г. Индекс микроальтернаций “Миокард”: влияние пола, возраста и частота нормальных значений при скрининговых обследованиях населения. Медицинский вестник Северного Кавказа 2018; 13(4): 589–593, https://doi.org/10.14300/mnnc.2018.13111.
- Поскотинова Л.В., Зенченко Т.А., Медведева А.А., Овсянкина М.А. Соотношение показателей вариабельности сердечного ритма и дисперсионного картирования электрокардиограммы у человека в условиях пробы с фиксированным темпом дыхания. Вестник Российской академии медицинских наук 2012; 67(7): 44–49, https://doi.org/10.15690/vramn.v67i7.340.