Мисфолдинг белков в патогенезе и диагностике нейродегенеративных заболеваний (обзор)
В обзоре выполнена систематизация имеющихся сведений о мисфолдинге белков в патогенезе нейродегенеративных заболеваний (с акцентом на α-синуклеине, β-амилоиде и тау-белке). Рассматриваются современные лабораторные и нейровизуализационные методы, применяемые для клинической диагностики и научных исследований протеинопатий. В работе приводится описание перспективных методик белковой амплификации, позволяющих обнаруживать сверхнизкие концентрации аберрантных форм белков в биологических жидкостях организма. Рассматриваются также проблемы и перспективы ранней диагностики нейродегенеративных заболеваний путем детекции мисфолдинга белков.
Введение
Нейродегенеративные заболевания (НДЗ) — это обширная группа патологий, характеризующихся гибелью нейронов и прогрессирующей дисфункцией различных областей нервной системы, что приводит к стойкой инвалидизации пациентов [1]. Широкая распространенность НДЗ, обусловленная увеличением средней продолжительности жизни, а также высокие расходы здравоохранения на лечение пожилых людей обусловливают актуальность поиска эффективных методов ранней диагностики этой группы заболеваний [2].
Хорошо известно, что в основе патогенеза ряда НДЗ лежит процесс мисфолдинга (неправильного сворачивания) белков и накопления протеиновых фибрилл и олигомеров [3]. Так, при болезни Альцгеймера (БА) происходит внеклеточное накопление β-амилоида (Аβ) и тау-белка в веществе головного мозга. При этом агрегация тау-белка в нервной ткани также наблюдается и при других НДЗ, например при лобно-височной деменции (ЛВД) [4]. Другое распространенное НДЗ, болезнь Паркинсона (БП), характеризуется накоплением в нейронах агрегатов α-синуклеина, который тоже является причиной деменции с тельцами Леви и (при глиальном накоплении) мультисистемной атрофии [5]. В свою очередь боковой амиотрофический склероз обусловлен накоплением SOD1, FUS, TDP-43 в мотонейронах головного мозга [6]. Кроме того, прионные заболевания, входящие в группу губчатых энцефалопатий, также сопровождаются отложением аберрантных форм белка PrPC (PrPSC) [7, 8].
На сегодняшний день диагноз НДЗ ставится на основании клинических признаков заболевания, патологоанатомического исследования и с помощью методов нейровизуализации [9, 10]. Вместе с тем известно, что при нейродегенерации признаки протеинопатии могут наблюдаться за много лет до клинической манифестации заболевания и морфологических проявлений [11, 12], поэтому обнаружение аберрантных белков в биологических жидкостях организма является перспективным подходом к разработке новых методов ранней диагностики НДЗ.
В текущем обзоре рассматриваются патогенетические аспекты мисфолдинга белков (с акцентом на α-синуклеин и Аβ) как механизма развития нейродегенерации; современные лабораторные и нейровизуализационные методы, которые используются для клинической диагностики церебральных протеинопатий. Кроме того, в работе приводится описание перспективных методик белковой амплификации, позволяющих обнаруживать очень низкие концентрации аберрантных форм белков в биологических жидкостях организма.
Роль аберрантных белков и их агрегатов в развитии нейродегенеративных заболеваний
Наиболее распространенные протеинопатии, приводящие к НДЗ, связаны с накоплением Aβ, тау-белка и α-синуклеина [13]. Aβ содержит 37–49 аминокислотных остатков и образуется в результате протеолитического расщепления трансмембранного белка APP (амилоидного предшественника) под действием β- и γ-секретаз [13]. APP в свою очередь экспрессируется во многих тканях, включая головной мозг, и является важным регулятором пролиферации клеток и нейрогенеза [14]. Одним из патогенетических звеньев в нейродегенерации альцгеймеровского типа выступает формирование амилоидных бляшек (рис. 1), преимущественным компонентом которых являются пептиды Aβ40/42 [15–17]. Есть данные, указывающие на наибольшую токсичность олигомеров Aβ40/42 по сравнению с другими формами [17]. Вместе с тем показано, что присутствие аллоформ пептидов Aβ37, 38 и 40 в гетерогенных смесях (например, интерстициальной жидкости мозга) ингибирует агрегацию более токсичной формы Aβ42 [18].
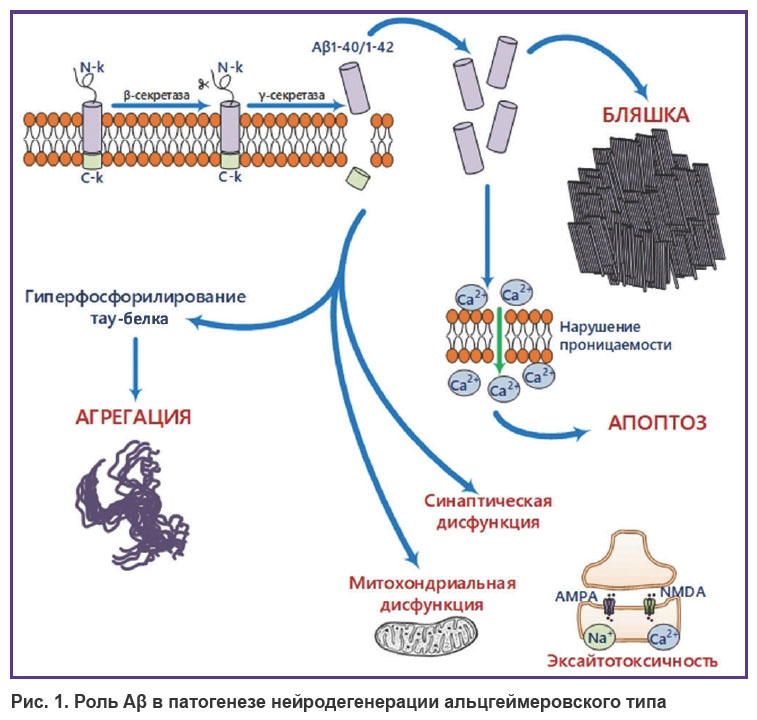
|
Рис. 1. Роль Aβ в патогенезе нейродегенерации альцгеймеровского типа |
Накопление тау-белка наблюдается при различных заболеваниях, включая БА, ЛВД, прогрессирующий надъядерный паралич, кортикобазальную дегенерацию и болезнь Пика [19, 20]. В здоровых нейронах тау-белок обнаруживается преимущественно в аксонах, и одной из его главных функций является стабилизация микротрубочек [21]. В результате альтернативного сплайсинга возможно образование разных форм тау-белка [19]. Так, в зависимости от наличия и количества N-концевых фрагментов в молекуле форма белка может быть обозначена как 0N/1N/2N. Наличие или отсутствие R2 домена определяет форму 4R или 3R соответственно [22]. К таупатиям, обусловленным накоплением 3R-формы, относят болезнь Пика и ЛВД, накоплением 4R-формы — кортикобазальную дегенерацию и прогрессирующий надъядерный паралич, а к смешанной форме 3R/4R — БА и некоторые виды ЛВД [23, 24]. Показано также, что фосфорилирование тау-белка при НДЗ стимулирует его агрегацию и ведет к дальнейшему развитию заболевания, которое этот белок вызывает [25]. При этом для фосфорилированного тау-белка также существует несколько изоформ, которые могут определяться при лабораторной диагностике НДЗ (p-tau 181, 217, 231 и др.) [26, 27].
Пресинаптический нейрональный белок α-синуклеин, регулирующий движение синаптических везикул и последующее высвобождение нейромедиаторов, играет важную роль в развитии БП и других синуклеинопатий (рис. 2) [28]. Известно, что α-синуклеин состоит из 140 аминокислот, структурированных в три участка: N-концевой алифатический (аминокислоты 1–60), гидрофобный (аминокислоты 61–95) и C-концевой (аминокислоты 96–140) [29, 30]. Агрегация аберрантных форм α-синуклеина приводит к формированию внутриклеточных включений в нейронах при БП и деменции с тельцами Леви, а также глиальных включений при мультисистемной атрофии [31].
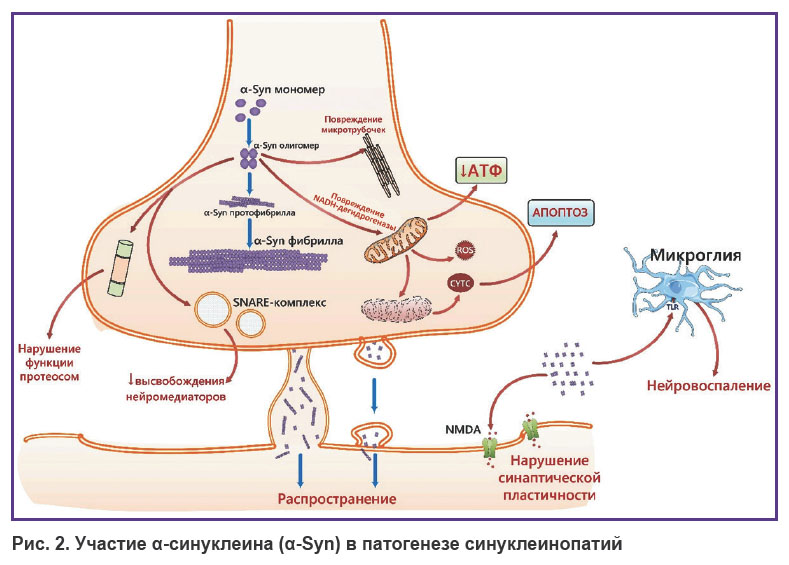
|
Рис. 2. Участие α-синуклеина (α-Syn) в патогенезе синуклеинопатий |
Одним из ключевых звеньев патогенеза НДЗ является мисфолдинг белка, приводящий к образованию его аберрантных форм и прогрессированию патологии [32]. В результате неправильного фолдинга белок может приобретать множество различных конформаций, некоторые из которых склонны к агрегации и формированию высокоорганизованных фибриллярных структур (амилоидогенезу) [33]. С помощью рентгеноструктурного анализа было выявлено, что в основе структуры таких белков лежат повторяющиеся β-листы, расположенные антипараллельно друг другу и перпендикулярно длинной оси фибриллы [34]. Амилоидные фибриллы являются устойчивыми к многим воздействиям, например детергентам и протеазам, и связываются с некоторыми красителями, такими как тиофлавин (ThT) и конго красный, что делает их доступными для детекции фотометрическими методами [35].
Мисфолдингу белков и последующему фибриллогенезу может способствовать ряд факторов (например, генетические мутации, вызывающие изменения в первичной структуре белка или в ферментах, обеспечивающих метаболизм белка) [36]. Так, мутации гена APP, изменяющие структуру белка-предшественника амилоида, мутации генов PSEN1 и PSEN2, влияющие на функционирование гамма-секретазы, и вариант гена APOE-ε4 часто встречаются у пациентов с семейной формой БА [37, 38]. Факторы окружающей среды — токсины, инфекции, стресс [39, 40], а также нейровоспаление, оксидативный стресс, нарушение системы протеостаза (аутофагия, HSP70/90, убиквитин) — и посттрансляционные модификации белка предрасполагают к формированию аберрантных вариаций белка [41–43].
Процесс фибриллогенеза включает в себя несколько стадий: лаг-фаза, фаза роста и фаза плато [44, 45]. В лаг-фазу происходит формирование «ядра» из мономеров путем взаимодействия между собой особых участков молекулы — так называемых APR (aggregation prone region — участков, склонных к агрегации), которые представлены преимущественно гидрофобными аминокислотами, обращенными к ядру белка. Именно на основе этих участков будет происходить дальнейшая агрегация белка [46, 47]. В фазу элонгации наблюдается рост протофибрилл на основе ранее сформированных «ядер», выступающих в качестве затравки, к которой присоединяются мономеры. Фаза плато характеризуется истощением мономеров, остановкой роста протофибрилл и формированием из них фибрилл [45].
Распространение амилоида при НДЗ часто происходит в определенной последовательности. Так, при БП внутриклеточные включения α-синуклеина на ранних стадиях встречаются в двигательных ядрах языкоглоточного и блуждающего нервов, а также в обонятельных трактах, постепенно распространяясь рострально с вовлечением вышележащих отделов головного мозга [48, 49]. При БА нейрофибриллярные клубки тау-белка изначально наблюдаются в области голубого пятна и трансэнторинальной коры, с последующим вовлечением лимбической системы и неокортекса. Отложения Aβ также постепенно распространяются по определенному паттерну, отличному от паттерна тау-белка, с начальным отложением в неокортексе и дальнейшим распространением на гиппокамп и глубокие структуры [50, 51]. Схожие паттерны распространения Aβ и тау-белка были обнаружены при позитронно-эмиссионной томографии (ПЭТ) у пациентов с диагностированной БА, хотя иногда наблюдались и отличия, которые могут быть объяснены влиянием других факторов на патологический процесс [52]. Такое распространение агрегации белка может происходить в связи с высокой степенью уязвимости определенных нейронных популяций к нейродегенеративному процессу, что, по всей вероятности, связано с различием в экспрессии ряда генов в нейронах, глиальных клетках или, например, с более высокой потребностью в энергии ряда нейронов [53–55].
Согласно другой точке зрения, распространение аберрантных белков может происходить по механизму, схожему с механизмом распространения прионных белков [56, 57]. Этот механизм характеризуется взаимодействием инфекционного агента, представленным PrPSC — аберрантной формой прионного белка, с эндогенным прионным белком PrPS. Такое взаимодействие приводит к приобретению PrPS β-складчатой структуры и его конверсии в PrPSC [58]. Так, показано, что Aβ, α-синуклеин и тау-белок имеют тенденцию к мисфолдингу, когда их структура богата β-слоями. Это ведет к усиленному взаимодействию с нормальными молекулами белка и может служить матрицей для изменения их конформации. Такие измененные белки способны секретироваться во внеклеточное пространство и передаваться от клетки к клетке [59–62].
Добавление фибрилл рекомбинантного α-синуклеина к первичной нейрональной культуре сопровождается агрегацией эндогенного α-синуклеина и гибелью нейронов в течение 14 дней [63]. При этом различные типы α-синуклеина различаются по способности индуцировать агрегацию белка [64]. Аналогичные сведения имеются и для Aβ [65]. Исследования, проведенные на животных моделях, показали, что у мышей-носителей мутаций генов APP/PSEN1 инъекции в головной мозг гомогената мозга пациентов, страдавших от БА, приводили к более быстрому развитию патологии не только в месте инъекции, но и в отдаленных участках. Это свидетельствует о способности Aβ транснейронально распространяться между отделами головного мозга [66–68]. На распространение Aβ также влияет наличие в гомогенте его вариаций, подвергшихся посттрансляционной модификации, таких как AβN3pE и AβpSer8 [69]. Инъекция гомогената с Aβ в мозг приматов тоже приводила к прогрессирующему ухудшению результатов тестов, использующихся для оценки когнитивных и моторных функций [70].
Инъекционное введение α-синуклеина в стриатум, переднее обонятельное ядро, черную субстанцию и другие области также характеризовалось распространением аберрантного белка, формированием двигательного дефицита и нарушением сна [71–73]. В отличие от Aβ, вводимого мышам интраперитонеально и не приводящего к развитию нейродегенерации [74], периферическая инъекция α-синуклеина вызывала агрегацию белка в головном мозге [75].
Тау-белок способен индуцировать агрегацию белка в анатомически связанных областях при его введении в мозг [76, 77]. Aβ, тау-белок и α-синуклеин могут индуцировать агрегацию других белков, участвующих в развитии НДЗ [78–80]. Имеются сведения о возможности формирования ятрогенного β-амилоидоза в результате пересадки твердой мозговой оболочки, при этом отложения Аβ наблюдаются именно в поверхностных отделах коры головного мозга [81, 82]. Аналогичные данные имеются в отношении инъекций гормона роста, полученного из человеческих тканей [83, 84]. Таким образом, Aβ, тау-белок, α-синуклеин могут выступать в качестве «семян», индуцирующих дальнейшую агрегацию и распространение аберрантных белков.
Еще одним механизмом, лежащим в основе накопления аберрантных белков, является их распространение с помощью внеклеточных везикул (ВВ) [85]. Добавление ВВ, полученных из мозговой ткани пациентов с БП с тельцами Леви и содержащих α-синуклеин, в нейрональную культуру клеток приводило к захвату ВВ нейронами [86]. Инъекция ВВ с фибриллами α-синуклеина в мозг крысам вызывала дальнейшую агрегацию белка и гибель нейронов [87]. Показано, что источником ВВ в случае синуклеинопатий могут выступать не только нейроны, но и другие клетки, например микроглия [88]. ВВ, содержащие тау-белок, демонстрировали способность индуцировать агрегацию белка как в клеточных культурах, так и в условиях in vivo [89, 90]. Аналогичным образом в случае с альцгеймеровской нейродегенерацией ВВ могут выступать в качестве движущего механизма патологического процесса распространения Aβ [91–93]. Важно отметить, что ВВ перспективны для использования в качестве биомаркеров НДЗ [94–96]. Так, в недавнем исследовании А. Kluge с соавт. [96] продемонстрирована возможность обнаружения ВВ с аберрантными формами α-синуклеина в сыворотке пациента, взятой за 10 лет до постановки клинического диагноза БП или деменции с тельцами Леви.
Кроме того, «семена» аберрантных белков могут распространяться между клетками при помощи нанотрубочек [97, 98]. При этом в транспорте участвуют как гомотипичные трубочки (например, между нейронами), так и гетеротипичные (между нейронами и микроглией). С одной стороны, данный вид транспорта аберрантных протеинов рассматривается как явление, способствующее дальнейшему распространению патологического белка, а с другой — нейроны таким образом выводят избыток белка. Кроме того, в обмен на белок нейрон может получать от других клеток митохондрии, что также демонстрирует возможную адаптационную роль нанотрубочек [99, 100]. Аберрантные формы белка также способны секретироваться клетками с помощью экзоцитоза и захватываться путем рецептор-опосредованного эндоцитоза [101–104].
Инструментальные методы диагностики нейродегенеративных заболеваний
Нейровизуализационные методики. С помощью методов нейровизуализации можно неинвазивно оценить наличие накоплений аберрантных форм белка, степень атрофии определенных участков головного мозга, а также исключить другие причины неврологического дефицита. Так, структурная магнитно-резонансная томография позволяет точно оценить объем и степень атрофии в конкретных областях головного мозга благодаря разным магнитным характеристикам атомов водорода в составе молекул [105].
Другой современный метод нейровозуализации — ПЭТ с использованием фтордезоксиглюкозы — позволяет оценить интенсивность метаболизма в тканях головного мозга [106]. При помощи этой методики можно наблюдать пациентов с легким когнитивным расстройством, у которых в будущем может развиться БА, и проводить дифференциальную диагностику разных типов деменции. Несмотря на большое количество исследований, показывающих эффективность ПЭТ-нейровизуализации для диагностики НДЗ, применение данного метода ограничено из-за высокой стоимости, сложности и лучевой нагрузки на пациента. Кроме того, для магнитно-резонансной томографии и ПЭТ имеются определенные вопросы относительно их диагностической чувствительности при БА [107, 108].
Биоматериал для ранней диагностики НДЗ. В большинстве работ, посвященных диагностике НДЗ при помощи лабораторных методик, используют в качестве исследуемого материала цереброспинальную жидкость (ЦСЖ) [24, 109, 110], для сбора которой необходима процедура пунктирования спинномозгового канала. Применение других типов биоматериала позволит снизить инвазивность и расширить доступность лабораторной диагностики. Имеются сведения, что в крови можно обнаружить аберрантные формы белков за несколько лет до клинической манифестации БП и БА [96, 111]. Это позволяет проводить ранний скрининг НДЗ с возможностью прогнозирования их манифестации.
Иммунологические лабораторные методы. Иммуноферментный анализ (ИФА), основанный на взаимодействии антиген–антитело для обнаружения биомолекул, является одним из наиболее специфичных и простых методов лабораторной диагностики. Вместе с тем ИФА часто применяется для определения патологических белков в жидкостях организма [109, 112, 113]. Так, отношение Aβ42/Aβ40 используется для подтверждения наличия амилоидной патологии при БА [114]. Этот же метод может быть использован для детекции фосфорилированных форм тау-белка в ЦСЖ [115].
Однако в отличие от рутинного использования ИФА для измерения уровней тау-белка в ликворе и плазме этот метод редко применяется для оценки накопления тау-белка в головном мозге пациентов с БА [116]. В серии работ было проведено несколько исследований с использованием ИФА для оценки уровня накопления тау-белка в зависимости от стадии заболевания, областей мозга, а также изменений, связанных с БА [117]. Показано, что этот метод диагностики может отражать характер распространения тау-белка по областям мозга. Стоит отметить, что в ИФА используются антитела к позднесрединным и С-концевым областям тау-белка, что позволяет лучше отражать его нейропатологическое накопление и оценивать количество белка в головном мозге на биохимическом уровне [118].
Микрофлюидный флуоресцентный анализ ELLA (enzyme-linked luminescent assay) основан на платформе микрофлюидных картриджей, которую широко используют для количественного определения растворимых биомаркеров [119]. Данный метод в некоторых исследованиях применялся для выявления НДЗ у пациентов по уровню легких цепей нейрофиламентов [120].
SiMoA (single molecule array) — еще один метод флуоресцентного обнаружения нейрофиламентов, основанный на двух высокоспецифичных неконкурентоспособных моноклональных антителах и массивах микроэлементов, которые могут выделять и обнаруживать отдельные молекулы, связанные с парамагнитными гранулами [119]. Учитывая технологию этого метода, можно утверждать, что он имеет гораздо более высокую чувствительность по сравнению с традиционными анализами ИФА при диагностике НДЗ. Так, в исследовании M. Truffi и соавт. [120] показаны сравнительная эффективность платформ SiMoA и ELLA для обнаружения легких цепей нейрофиламентов и перспектива использования этого метода для диагностики НДЗ.
Масс-спектрометрический анализ. Масс-спектрометрия распространена в аналитической химии и лабораторной диагностике для качественного и количественного определения химических веществ в анализируемой пробе и биологических образцах на основе измерения массы молекул, которая также используется для обнаружения аберрантных белков и диагностики НДЗ [119]. В настоящее время масс-спектрометрические методы чаще применяются для выявления и валидации биомаркеров НДЗ в контексте научных исследований, чем в клинической практике. Существует два взаимодополняющих метода масс-спектрометрии: крупномасштабная протеомика для скрининга биомаркеров и дорогостоящие таргетированные подходы для определения специфичных биомаркеров [119].
Еще одним протеомным подходом для обнаружения биомаркеров выступает масс-спектрометрия с поверхностной лазерной десорбцией/ионизацией (SELDI/MALDI), которая была создана с целью анализа высокомолекулярных биомолекул (пептидов и протеинов) [121]. Благодаря методам протеомного анализа можно оценивать уровни до 10 000 отдельных белков в одном образце и фиксировать изменения их концентрации, что используется в диагностике и мониторинге течения заболеваний [122]. В ходе исследований методом крупномасштабной масс-спектроскопии были охарактеризованы протеомы биологических жидкостей и тканей головного мозга, взятые у пациентов с разными НДЗ, в т.ч. БА, БП, ЛВД, а также у пациентов с деменцией с тельцами Леви и боковым амиотрофическим склерозом [123–126]. Данный метод позволяет точно охарактеризовать белковый профиль, формируемый нормальными и аберрантными белками при развитии НДЗ, и подбирать эффективные скрининговые и диагностические лабораторные алгоритмы.
Методы диагностики, основанные на детекции мисфолдинга белков
Рамановская спектроскопия. Ранее было показано, что рамановская микроспектроскопия может эффективно использоваться для диагностики НДЗ благодаря возможности определения структурных различий функциональных и патологических амилоидных структур [127, 128]. Однако попытки поиска уникальной рамановской сигнатуры бляшек бета-амилоида в мозговой ткани у пациентов с БА завершились неудачей и уникальный спектр, специфичный для бляшек Aβ, не был определен даже после тщательного удаления возможных спектральных помех [129].
Cennamo и соавт. [130] успешно использовали модифицированный вариант рамановской спектроскопии, SERS (surface-enhanced Raman scattering), основанный на усилении сигнала с помощью наночастиц из золота или серебра, для определения спектральных различий слезной жидкости у пациентов с БА. Аналогичное исследование C. Carlomagno и соавт. [131], где применяли слюнную жидкость для усиления сигнала, также показало хорошие результаты. Есть материалы, демонстрирующие эффективность данной технологии для диагностики БП при использовании совместно с микрофлюидными платформами [132].
ИК-спектроскопия. При ИК-спектроскопии регистрируется поглощение объектом инфракрасного излучения. Этот метод успешно апробирован для исследования выделенных из крови ВВ с аберрантными белками, показаны различия между пациентами с БА и контрольной группой [133, 134]. ИК-спектроскопия также продемонстрировала хорошие результаты в дифференциации БА от других НДЗ (БП, ЛВД и др.) [135].
Микроспектроскопия (μFTIR), разновидность ИК-спектроскопии, в ряде исследований успешно использовалась в комплексе с другими методиками (рамановская спектроскопия и иммунофлуоресценция) для выявления астроглиоза, связанного с бляшками Aβ в головном мозге при БА [136–138].
Электронная микроскопия. Традиционный метод просвечивающей электронной микроскопии позволяет визуализировать амилоидные фибриллы с высоким разрешением в высушенном или гидратированном состоянии, давая представление о морфологии фибрилл и протофибриллярных структурах [139]. Однако данный метод имеет ряд ограничений, связанных со сложной пробоподготовкой, которая не позволяет сохранить исходное состояние белкового матрикса и нативную фибриллярную структуру амилоида [112].
При помощи криоэлектронной микроскопии (cryo-EM), выполняемой в условиях сверхнизких температур, было показано, что Aβ-фибриллы из ткани головного мозга пациента с диагнозом БА не только полиморфны, но и имеют общие структурные особенности пептидной организации и сборки протофиламента [140]. Примечательно, что наблюдаемая авторами структура фибрилл сильно отличалась от известных структур Aβ-фибрилл, которые были сформированы in vitro/exvivo [140, 141]. В другом исследовании R. Guerrero-Ferreira и соавт. [113] благодаря cryo-EM выявили две новые полиморфные структуры полноразмерных фибрилл α-синуклеина человека в образцах с тельцами Леви. Эти данные можно считать наглядным свидетельством того, что фибриллярные структуры аберрантных белков в условиях паренхимы головного мозга invivo имеют структурные и, вероятно, физико-химические отличия, которые важно учитывать при интерпретации результатов из моделей in vitro/in silico.
Следует отметить, что Фурье-инфракрасная спектроскопия, круговой дихроизм и ориентированный круговой дихроизм являются дополнительными информативными методами, широко используемыми для анализа патологических церебральных амилоидов [142, 143]. Их применение помогает определить точный состав вторичной структуры белков, агрегированных в β-слоях амилоидов, а также оценивать тонкие структурные изменения в аберрантных белках и их взаимодействие с липидным бислоем мембраны [144]. Методы кругового дихроизма позволяют идентифицировать параллельное и антипараллельное содержимое β-слоя и, следовательно, являются взаимодополняющими по отношению к другим методам спектроскопии и электронной микроскопии [145].
Методики белковой амплификации. Отдельное внимание следует уделить методикам, основанным на принципе белковой амплификации, которые позволяют обнаружить аберрантный белок в образцах тканей и жидкостей в сверхнизких концентрациях. Это открывает широкие возможности для их диагностического применения [146]. Как было упомянуто выше, аберрантные белки способны индуцировать мисфолдинг мономеров того же белка, находящихся в нативной конформации, что служит основой развития прионных болезней и НДЗ [8, 82]. На этом же принципе основаны методы белковой амплификации, которые имеют очень высокую чувствительность для детекции аберрантного белка (до 10–12 г/мл образца) при высокой специфичности (до 100%) [147, 148]. Принимая во внимание то, что амилоидогенные фрагменты аберрантных белков могут обнаруживаться в биологических жидкостях (кровь, ЦСЖ, слюна) задолго до развития клинической симптоматики [11, 95, 96], методы белковой амплификации перспективны в качестве приоритетных подходов для скрининга и ранней диагностики НДЗ [96].
Одним из наиболее ранних и распространенных протоколов белковой амплификации можно считать PMCA (protein misfolding cyclic amplification), в ходе которого аналит с прионоподобными белковыми олигомерами (PrРSC) инкубируется с материалом, содержащим избыток нормальных белковых мономеров (PrРC), индуцируя их конформационные изменения и полимеризацию (фаза элонгации) [146]. Образующиеся полимерные фибриллы циклически деструктурируются ультразвуком, увеличивая количество доступных для взаимодействия с PrРC мономеров PrРSC, что приводит к накоплению фибрилл PrРSC, а дальнейшее обнаружение аберрантного белка выполняется методом вестерн-блоттинга [149]. Несмотря на методическую сложность, длительность и трудоемкость, чувствительность PMCA значительно превосходит методы иммунодиагностики и дает возможность обнаружить прионоподобный белок при наличии всего лишь одного олигомера в образце [150, 151].
В дальнейшем метод вестерн-блоттинга стали заменять иммунофлюоресцентной детекцией фибрилл с тиофлавином, что позволяло миновать этап использования протеиназы С, а воздействие ультразвуком было заменено на встряхивание. Модифицированный метод получил название RT-QuIC (real-time quaking-induced conversion — индуцированная встряхиванием конверсия в реальном времени) [147, 152, 153]. Методы PMCA и RT-QuIC показали высокую эффективность в диагностике различных прионных заболеваний [8, 151, 154, 155] и на сегодняшний день данные методики имеют высокий потенциал для диагностики других протеинопатий и НДЗ [147, 156]. Существуют модификации RT-QuIC с использованием кремниевых шариков (диаметр 0,8–1,0 мм), которые позволяют сократить срок обнаружения α-синуклеина в образцах ЦСЖ до 1–2 сут и выполнить количественное измерение его концентрации [157].
Ряд авторов для объединения методик PMCA и RT-QuIC используют термин SAA (seed amplification assay — метод «затравочной» амплификации). SAA показал себя эффективным инструментом в диагностике НДЗ, сопровождающихся накоплением синуклеина [147, 158, 159, 160], Aβ и тау-белка [161]. Так, подобный анализ ЦСЖ на α-синуклеин позволяет с высокой чувствительностью и специфичностью (88 и 95% соответственно) выявлять пациентов с синуклеинопатиями [159]. Высокая специфичность SAA также обнаружена для других НДЗ (БА, кортикобазальная дегенерация, прогрессирующий надъядерный паралич), однако одновременное присутствие разных аберрантных белков приводило к ухудшению результатов [162–164]. Стоит отметить, что при выполнении PMCA и RT-QuIC в ходе диагностики синуклеинопатий обычно не применяют ультразвук, вместо него при PMCA используется встряхивание, а при RT-QuIC — встряхивание с шариками [165].
При множественной системной атрофии показатели чувствительности и специфичности SAA составили 57 и 96% соответственно, и были ниже, чем при обнаружении других синуклеинопатий, что может быть связано с некоторыми отличиями в строении α-синуклеина и использованием других буферов и протоколов [166]. Меньшая диагностическая эффективность SAA также отмечалась при выявлении пациентов с определенными типами генетически обусловленной БП (гены PRKN, LRRK2) [167, 168].
В большинстве протоколов белковой амплификации в качестве исследуемого материала используется ЦСЖ, однако могут применяться и другие биологические материалы. Так, при изучении материала из слизистой оболочки носа от больных БП метод RT-QuIC продемонстрировал определенную диагностическую ценность [169]. При этом совместное применение анализа ЦСЖ и соскоба слизистой оболочки носовой полости может быть более эффективным методом выявления деменции с тельцами Леви, в том числе на доклинической стадии [170]. В другом исследовании, проведенном на базе двух разных лабораторий, анализ слизистой оболочки носовой полости использовали для диагностики БП и мультисистемной атрофии [171]. Показано, что мозжечковый подтип мультисистемной атрофии, в отличие от паркинсонического, не сопровождался агрегацией белка при RT-QuIC. Однако слизистая оболочка носа показывает худшие результаты в отношении чувствительности и специфичности (45,2 и 89,8% соответственно) по сравнению с ЦСЖ [171] или образцами из области, богатой обонятельными нейронами [169, 172].
В работе Y. Kuang и соавт. отмечена диагностическая эффективность методов SAA при исследовании фрагмента кожи пациентов с БП (чувствительность и специфичность составили 90 и 92% соответственно) [173]. По данным ряда авторов, в качестве материала для ранней диагностики БП могут выступать кровь и слюнная жидкость. Группа Z. Wang показала [174], что именно совместное изучение этих жидкостей перспективно для диагностики БП. В работе А. Kluge с соавт. установлено, что анализ крови на α-синуклеин с использованием внеклеточных везикул, выделенных с помощью NCAM-1 антител, позволяет выявлять больных БП и деменцией с тельцами Леви. Причем агрегация α-синуклеина, как упоминалось ранее, может быть обнаружена за 10 лет до постановки клинического диагноза [96].
Еще одной группой НДЗ, диагностика которых целесообразна методами обнаружения мисфолдинга белка, выступают таупатии: болезнь Пика, хроническая травматическая энцефалопатия, БА и др. Детекция «зерен» аберрантного тау-белка в образцах ЦСЖ и крови, как в случае с α-синуклеином, могла бы упростить диагностику данных состояний [175]. Вместе с тем сложность для исследования тау-белка представляют тонкие конформационные различия у разных НДЗ, возникающие в результате альтернативного сплайсинга. Поэтому в некоторых работах указана необходимость использования в качестве субстрата для амплификации идентичного варианта белка, который участвует в патогенезе конкретной нозологии [176–178].
Описаны протоколы белковой амплификации для обнаружения тау-белка при 3R-таупатиях (болезнь Пика), в которых использовались мономеры K19CF, в частности 3R-вариант рекомбинантного тау-белка [176]. Эти мономеры позволили осуществить детекцию аберрантных «зерен» тау-белка в образцах мозга от пациентов с болезнью Пика вплоть до 10–7–10–9 разведений. Аналогичным образом детекция аберрантного белка при 4R-таупатиях (кортико-базальная дегенерация, прогрессирующий надъядерный паралич) в посмертных образцах ЦСЖ осуществлялась при наличии всего лишь 0,3 фг белка в 12 мл образца [177]. При этом исследование прижизненно собранной ЦСЖ показывало положительный результат в 69% случаев прогрессирующего надъядерного паралича и в 50% случаев кортико-базальной дегенерации [177].
Методика RT-QuIC в ходе диагностики 4R/3R-таупатий (при БА) на постмортальных образцах головного мозга продемонстрировала бóльшую специфичность и чувствительность при большей степени разведения (10–7–10–10 при БА против 10–2–10–6 для других НДЗ) [178]. В работе J.M. Tennant с соавт. [179] было отмечено, что при использовании мономеров рекомбинантной формы тау-белка 4R/3R в качестве субстрата для амплификации агрегация аберрантного тау-белка наблюдалась при всех вариантах таупатий. Таким образом, возможно использование 4R/3R «затравочных» мономеров для диагностики любых видов таупатий.
В исследовании N. Salvadores с соавт. метод PMCA позволил обнаружить присутствие Aβ в образцах ЦСЖ от пациентов с БА в концентрации до 3 фмоль/мл (чувствительность и специфичность составили 90 и 92% соответственно) [180]. Кроме того, благодаря PMCA авторам удалось дифференцировать БА не только с прочими неврологическими заболеваниями, но и с другими НДЗ [180]. Примечательно, что PMCA позволяет определять содержание Aβ в образцах после медикаментозного вмешательства, что свидетельствует о перспективности этого подхода для мониторинга эффективности терапии. Так, в исследовании L.D. Estrada и соавт. белковая амплификация при определении уровня олигомеров Aβ в плазме крови крыс, получавших лечение имитимибом (ингибитор c-Abl-киназы), показала снижение уровня Aβ по сравнению с группой контроля [181].
Несмотря на то, что PMCA и RT-QuIC являются эффективными исследовательскими методами амплификации белка, существуют более современные модификации SAA, которые по методическим характеристикам могут превосходить устоявшиеся способы детекции мисфолдинга белка. Так, принцип белковой амплификации лег в основу метода MDS (multimer detection system), представляющего собой модифицированный метод ELISA. Метод MDS специфически обнаруживает мультимерные формы белка, что существенно повышает его чувствительность [182, 183]. Другой модификацией является RT-FAST — метод, основанный на использовании нанотрубок для обнаружения агрегатов белка и их амплификации в течение 90 мин после начала тестирования [184, 185]. Это выгодно отличает данный метод от PMCA и RT-QuIC, для которых необходимо как минимум несколько десятков часов детекции. Кроме того, RT-FAST может быть использован для количественной оценки белка в образце. Метод требует меньше рекомбинантного белка для анализа образцов, что снижает стоимость исследования [184, 185].
Модификация методики RT-QuIC с использованием наночастиц металлов, способных взаимодействовать с окружающими биомолекулами путем как образования так называемого белкового венца вокруг частицы, так и влияния на агрегацию белка, получила название Nano-QuIC [186–188]. При этом P.R. Christenson и соавт. [186] показали, что добавление в протокол RT-QuIC наночастиц кремния (50 нм) позволяет сократить время обнаружения белка в 2,5 раза и увеличить специфичность в 10 раз при диагностике болезни Крейтцфельдта–Якоба.
С обобщенной информацией о методиках амплификации белка и с данными об их чувствительности и специфичности при НДЗ можно ознакомиться в таблице [164, 165, 166, 180, 189].
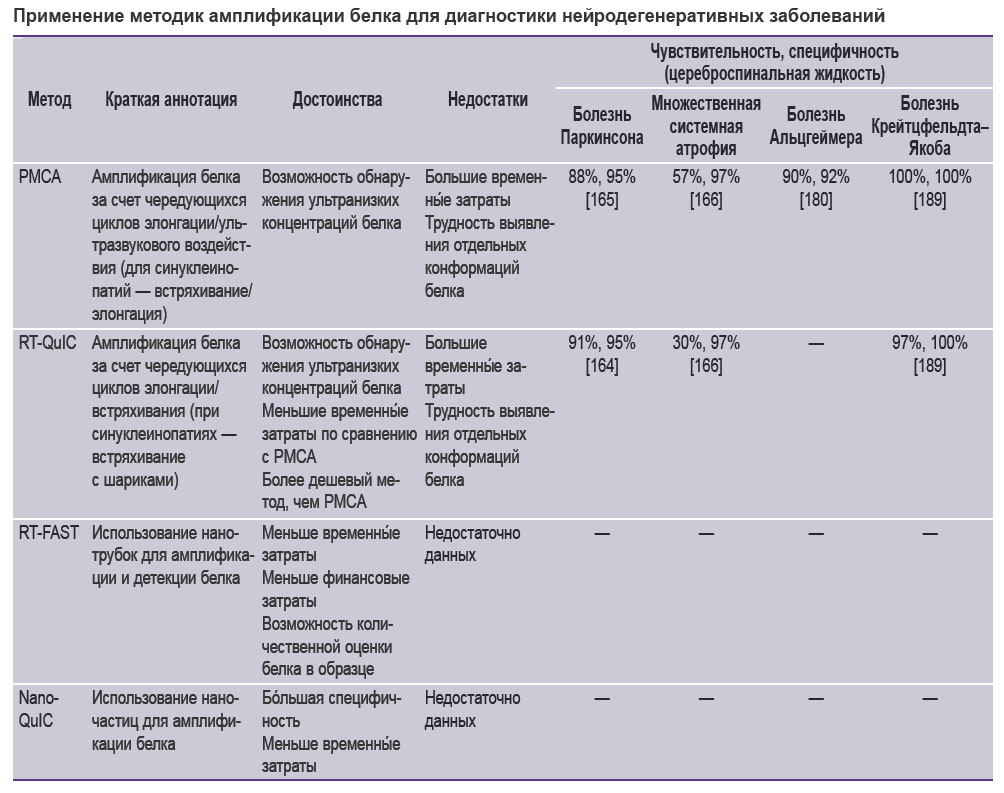
|
Применение методик амплификации белка для диагностики нейродегенеративных заболеваний |
Заключение
Несмотря на разнообразие лабораторных и инструментальных методов, которые могут использоваться в диагностике НДЗ, далеко не все из них нашли применение в клинический практике в силу ряда проблем и ограничений. Во-первых, патогенез протеинопатий при НДЗ изучен недостаточно, вследствие чего затруднено выделение конкретных биомаркеров и их физико-химических конформаций для конкретной нозологии. Заболевания, характеризующиеся развитием паркинсонизма, обладают схожей симптоматикой и характеризуются отложением α-синуклеина разных конформаций [190]. Во-вторых, известные биомаркеры не всегда достаточно специфичны и могут наблюдаться не только при НДЗ, но и в норме. Например, отложение Аβ и тау-белка обнаруживается при нормальном старении головного мозга без признаков нейродегенерации [191]. Нельзя при этом исключить, что в таких случаях имеет место ранняя стадия протеинопатии, происходящая задолго до манифестации заболевания.
Еще одним ограничением для применения лабораторных методов диагностики протеинопатий является необходимость использования ЦСЖ в качестве биологического материала, так как она содержит наибольшие концентрации аберрантных белков, доступные для обнаружения рутинными иммунологическими методами [24]. Сбор ЦСЖ сопровождается сложной, инвазивной процедурой, имеющей ряд противопоказаний, что делает невозможным расширение диагностических показаний и скрининг.
Несмотря на свою технологическую и методическую сложность, перспективным направлением в лабораторной диагностике НДЗ является внедрение и развитие методик, основанных на амплификации аберрантных белков, которые могут позволить детектировать ультранизкие концентрации патологических конформаций белка в биологических жидкостях организма задолго до начала развития клинической картины заболевания. Однако на сегодняшний день у этих методов имеются такие недостатки, как длительность анализа (до 7–14 дней), низкая портативность и трудности с обнаружением отдельных конформаций аберрантного белка. Кроме того, существенным ограничением для широкого внедрения методик детекции мисфолдинга белков выступает сложный и трудоемкий процесс синтеза специфических мономеров, используемых в качестве субстрата для амплификации.
В связи с этим актуален поиск новых подходов для разработки методов детекции мисфолдинга белков, к которым относится, например, объединение микрофлюидных технологий с методом SAA (PMCA + RT-QuIC), что помогает обеспечить портативность, снизить расход компонентов и материалов, а также существенно ускорить время выполнения анализа [192–194]. Еще одним подходом для повышения диагностической эффективности и улучшения технико-экономических характеристик методов SAA может стать применение дополнительных внешних эффектов в процедуре белковой амплификации, таких как физические воздействия (электрическое и магнитное поле) и добавление наночастиц с различными свойствами. Эти модификации гипотетически могут повлиять на процесс деструкции олигомеров, увеличивая количество «зерен» аберрантных белков, доступных для амплификации.
Финансирование. Работа выполнена при поддержке гранта Министерства науки и высшего образования Российской Федерации на реализацию крупных научных проектов по приоритетным направлениям научно-технического развития (проект №075-15-2024-638).
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Литература
- Agnello L., Ciaccio M. Neurodegenerative diseases: from molecular basis to therapy. Int J Mol Sci 2022; 23(21): 12854, https://doi.org/10.3390/ijms232112854.
- Feigin V.L., Vos T., Nichols E., Owolabi M.O., Carroll W.M., Dichgans M., Deuschl G., Parmar P., Brainin M., Murray C. The global burden of neurological disorders: translating evidence into policy. Lancet Neurol 2020; 19(3): 255–265, https://doi.org/10.1016/S1474-4422(19)30411-9.
- Jan A., Gokce O., Luthi-Carter R., Lashuel H.A. The ratio of monomeric to aggregated forms of Abeta40 and Abeta42 is an important determinant of amyloid-beta aggregation, fibrillogenesis, and toxicity. J Biol Chem 2008; 283(42): 28176–28189, https://doi.org/10.1074/jbc.M803159200.
- Zhang Y., Wu K.M., Yang L., Dong Q., Yu J.T. Tauopathies: new perspectives and challenges. Mol Neurodegener 2022; 17(1): 28, https://doi.org/10.1186/s13024-022-00533-z.
- Bordbar S., Alijanzadeh D., Samieefar N., Khazeei Tabari M.A., Pourbakhtyaran E., Rezaei N. The role of alpha-synuclein in neurodevelopmental diseases. Mol Neurobiol 2025; 62(1): 962–972, https://doi.org/10.1007/s12035-024-04305-2.
- Sharma R., Khan Z., Mehan S., Das Gupta G., Narula A.S. Unraveling the multifaceted insights into amyotrophic lateral sclerosis: genetic underpinnings, pathogenesis, and therapeutic horizons. Mutat Res Rev Mutat Res 2024; 794: 108518, https://doi.org/10.1016/j.mrrev.2024.108518.
- Calabrese G., Molzahn C., Mayor T. Protein interaction networks in neurodegenerative diseases: from physiological function to aggregation. J Biol Chem 2022; 298(7): 102062, https://doi.org/10.1016/j.jbc.2022.102062.
- Li B., Chen M., Zhu C. Neuroinflammation in prion disease. Int J Mol Sci 2021; 22(4): 2196, https://doi.org/10.3390/ijms22042196.
- Pérez-Millan A., Thirion B., Falgàs N., Borrego-Écija S., Bosch B., Juncà-Parella J., Tort-Merino A., Sarto J., Augé J.M., Antonell A., Bargalló N., Balasa M., Lladó A., Sánchez-Valle R., Sala-Llonch R. Beyond group classification: probabilistic differential diagnosis of frontotemporal dementia and Alzheimer’s disease with MRI and CSF biomarkers. Neurobiol Aging 2024; 144: 1–11, https://doi.org/10.1016/j.neurobiolaging.2024.08.008.
- Erkkinen M.G., Kim M.O., Geschwind M.D. Clinical neurology and epidemiology of the major neurodegenerative diseases. Cold Spring Harb Perspect Biol 2018; 10(4): a033118, https://doi.org/10.1101/cshperspect.a033118.
- Magalhães P., Lashuel H.A. Opportunities and challenges of alpha-synuclein as a potential biomarker for Parkinson’s disease and other synucleinopathies. NPJ Parkinsons Dis 2022; 8(1): 93, https://doi.org/10.1038/s41531-022-00357-0.
- Jia J., Ning Y., Chen M., Wang S., Yang H., Li F., Ding J., Li Y., Zhao B., Lyu J., Yang S., Yan X., Wang Y., Qin W., Wang Q., Li Y., Zhang J., Liang F., Liao Z., Wang S. Biomarker changes during 20 years preceding Alzheimer’s disease. N Engl J Med 2024; 390(8): 712–722, https://doi.org/10.1056/NEJMoa2310168.
- Tatarnikova O.G., Orlov M.A., Bobkova N.V. Beta-amyloid and tau-protein: structure, interaction, and prion-like properties. Biochemistry (Mosc) 2015; 80(13): 1800–1819, https://doi.org/10.1134/S000629791513012X.
- Arber C., Lovejoy C., Harris L., Willumsen N., Alatza A., Casey J.M., Lines G., Kerins C., Mueller A.K., Zetterberg H., Hardy J., Ryan N.S., Fox N.C., Lashley T., Wray S. Familial Alzheimer’s disease mutations in PSEN1 lead to premature human stem cell neurogenesis. Cell Rep 2021; 34(2): 108615, https://doi.org/10.1016/j.celrep.2020.108615.
- Li Y., Schindler S.E., Bollinger J.G., Ovod V., Mawuenyega K.G., Weiner M.W., Shaw L.M., Masters C.L., Fowler C.J., Trojanowski J.Q., Korecka M., Martins R.N., Janelidze S., Hansson O., Bateman R.J. Validation of plasma amyloid-β 42/40 for detecting Alzheimer disease amyloid plaques. Neurology 2022; 98(7): e688–e699, https://doi.org/10.1212/WNL.0000000000013211.
- Yu H., Wu J. Amyloid-β: a double agent in Alzheimer’s disease? Biomed Pharmacother 2021; 139: 111575, https://doi.org/10.1016/j.biopha.2021.111575.
- Sulatskaya A.I., Rychkov G.N., Sulatsky M.I., Mikhailova E.V., Melnikova N.M., Andozhskaya V.S., Kuznetsova I.M., Turoverov K.K. New evidence on a distinction between Aβ40 and Aβ42 amyloids: thioflavin t binding modes, clustering tendency, degradation resistance, and cross-seeding. Int J Mol Sci 2022; 23(10): 5513, https://doi.org/10.3390/ijms23105513.
- Braun G.A., Dear A.J., Sanagavarapu K., Zetterberg H., Linse S. Amyloid-β peptide 37, 38 and 40 individually and cooperatively inhibit amyloid-β 42 aggregation. Chem Sci 2022; 13(8): 2423–2439, https://doi.org/10.1039/d1sc02990h.
- Goedert M., Eisenberg D.S., Crowther R.A. Propagation of tau aggregates and neurodegeneration. Annu Rev Neurosci 2017; 40: 189–210, https://doi.org/10.1146/annurev-neuro-072116-031153.
- Hu J., Sha W., Yuan S., Wu J., Huang Y. Aggregation, transmission, and toxicity of the microtubule-associated protein tau: a complex comprehension. Int J Mol Sci 2023; 24(19): 15023, https://doi.org/10.3390/ijms241915023.
- Alonso A.D.C., El Idrissi A., Candia R., Morozova V., Kleiman F.E. Tau: more than a microtubule-binding protein in neurons. Cytoskeleton (Hoboken) 2024; 81(1): 71–77, https://doi.org/10.1002/cm.21795.
- Boyarko B., Hook V. Human Tau isoforms and proteolysis for production of toxic tau fragments in neurodegeneration. Front Neurosci 2021; 15: 702788, https://doi.org/10.3389/fnins.2021.702788.
- Rösler T.W., Tayaranian Marvian A., Brendel M., Nykänen N.P., Höllerhage M., Schwarz S.C., Hopfner F., Koeglsperger T., Respondek G., Schweyer K., Levin J., Villemagne V.L., Barthel H., Sabri O., Müller U., Meissner W.G., Kovacs G.G., Höglinger G.U. Four-repeat tauopathies. Prog Neurobiol 2019; 180: 101644, https://doi.org/10.1016/j.pneurobio.2019.101644.
- Chaudhry A., Houlden H., Rizig M. Novel fluid biomarkers to differentiate frontotemporal dementia and dementia with Lewy bodies from Alzheimer’s disease: a systematic review. J Neurol Sci 2020; 415: 116886, https://doi.org/10.1016/j.jns.2020.116886.
- Barthélemy N.R., Liu H., Lu W., Kotzbauer P.T., Bateman R.J., Lucey B.P. Sleep deprivation affects tau phosphorylation in human cerebrospinal fluid. Ann Neurol 2020; 87(5): 700–709, https://doi.org/10.1002/ana.25702.
- Leuzy A., Janelidze S., Mattsson-Carlgren N., Palmqvist S., Jacobs D., Cicognola C., Stomrud E., Vanmechelen E., Dage J.L., Hansson O. Comparing the clinical utility and diagnostic performance of CSF P-Tau181, P-Tau217, and P-Tau231 assays. Neurology 2021; 97(17): e1681–e1694, https://doi.org/10.1212/WNL.0000000000012727.
- Therriault J., Vermeiren M., Servaes S., Tissot C., Ashton N.J., Benedet A.L., Karikari T.K., Lantero-Rodriguez J., Brum W.S., Lussier F.Z., Bezgin G., Stevenson J., Rahmouni N., Kunach P., Wang Y.T., Fernandez-Arias J., Socualaya K.Q., Macedo A.C., Ferrari-Souza J.P., Ferreira P.C.L., Bellaver B., Leffa D.T., Zimmer E.R., Vitali P., Soucy J.P., Triana-Baltzer G., Kolb H.C., Pascoal T.A., Saha-Chaudhuri P., Gauthier S., Zetterberg H., Blennow K., Rosa-Neto P. Association of phosphorylated tau biomarkers with amyloid positron emission tomography vs tau positron emission tomography. JAMA Neurol 2023; 80(2): 188–199, https://doi.org/10.1001/jamaneurol.2022.4485.
- Carnazza K.E., Komer L.E., Xie Y.X., Pineda A., Briano J.A., Gao V., Na Y., Ramlall T., Buchman V.L., Eliezer D., Sharma M., Burré J. Synaptic vesicle binding of α-synuclein is modulated by β- and γ-synucleins. Cell Rep 2022; 39(2): 110675, https://doi.org/10.1016/j.celrep.2022.110675.
- Calabresi P., Mechelli A., Natale G., Volpicelli-Daley L., Di Lazzaro G., Ghiglieri V. Alpha-synuclein in Parkinson’s disease and other synucleinopathies: from overt neurodegeneration back to early synaptic dysfunction. Cell Death Dis 2023; 14(3): 176, https://doi.org/10.1038/s41419-023-05672-9.
- Yang Y., Shi Y., Schweighauser M., Zhang X., Kotecha A., Murzin A.G., Garringer H.J., Cullinane P.W., Saito Y., Foroud T., Warner T.T., Hasegawa K., Vidal R., Murayama S., Revesz T., Ghetti B., Hasegawa M., Lashley T., Scheres S.H.W., Goedert M. Structures of α-synuclein filaments from human brains with Lewy pathology. Nature 2022; 610(7933): 791–795, https://doi.org/10.1038/s41586-022-05319-3.
- Estaun-Panzano J., Arotcarena M.L., Bezard E. Monitoring α-synuclein aggregation. Neurobiol Dis 2023; 176: 105966, https://doi.org/10.1016/j.nbd.2022.105966.
- Dovidchenko N.V., Leonova E.I., Galzitskaya O.V. Mechanisms of amyloid fibril formation. Biochemistry (Mosc) 2014; 79(13): 1515–1527, https://doi.org/10.1134/S0006297914130057.
- Kachkin D.V., Volkov K.V., Sopova J.V., Bobylev A.G., Fedotov S.A., Inge-Vechtomov S.G., Galzitskaya O.V., Chernoff Y.O., Rubel A.A., Aksenova A.Y. Human RAD51 protein forms amyloid-like aggregates in vitro. Int J Mol Sci 2022; 23(19): 11657, https://doi.org/10.3390/ijms231911657.
- Fitzpatrick A.W., Debelouchina G.T., Bayro M.J., Clare D.K., Caporini M.A., Bajaj V.S., Jaroniec C.P., Wang L., Ladizhansky V., Müller S.A., MacPhee C.E., Waudby C.A., Mott H.R., De Simone A., Knowles T.P., Saibil H.R., Vendruscolo M., Orlova E.V., Griffin R.G., Dobson C.M. Atomic structure and hierarchical assembly of a cross-β amyloid fibril. Proc Natl Acad Sci U S A 2013; 110(14): 5468–5473, https://doi.org/10.1073/pnas.1219476110.
- Min J.H., Sarlus H., Oasa S., Harris R.A. Thioflavin-T: application as a neuronal body and nucleolar stain and the blue light photo enhancement effect. Sci Rep 2024; 14(1): 24846, https://doi.org/10.1038/s41598-024-74359-8.
- Goldy J.N., Youker R.T. Characterization of spatial differences in two misfolded proteins during aggresome formation. MicroPubl Biol 2024, https://doi.org/10.17912/micropub.biology.001312.
- Kaur G., Poljak A., Braidy N., Crawford J.D., Lo J., Sachdev P.S. Fluid biomarkers and APOE status of early onset Alzheimer’s disease variants: a systematic review and meta-analysis. J Alzheimers Dis 2020; 75(3): 827–843, https://doi.org/10.3233/JAD-200052.
- Belloy M.E., Andrews S.J., Le Guen Y., Cuccaro M., Farrer L.A., Napolioni V., Greicius M.D. APOE genotype and Alzheimer disease risk across age, sex, and population ancestry. JAMA Neurol 2023; 80(12): 1284–1294, https://doi.org/10.1001/jamaneurol.2023.3599.
- Madore C., Yin Z., Leibowitz J., Butovsky O. Microglia, lifestyle stress, and neurodegeneration. Immunity 2020; 52(2): 222–240, https://doi.org/10.1016/j.immuni.2019.12.003.
- Bantle C.M., Phillips A.T., Smeyne R.J., Rocha S.M., Olson K.E., Tjalkens R.B. Infection with mosquito-borne alphavirus induces selective loss of dopaminergic neurons, neuroinflammation and widespread protein aggregation. NPJ Parkinsons Dis 2019; 5: 20, https://doi.org/10.1038/s41531-019-0090-8.
- Han X., Sun S., Sun Y., Song Q., Zhu J., Song N., Chen M., Sun T., Xia M., Ding J., Lu M., Yao H., Hu G. Small molecule-driven NLRP3 inflammation inhibition via interplay between ubiquitination and autophagy: implications for Parkinson disease. Autophagy 2019; 15(11): 1860–1881, https://doi.org/10.1080/15548627.2019.1596481.
- Won S.J., Fong R., Butler N., Sanchez J., Zhang Y., Wong C., Tambou Nzoutchoum O., Huynh A., Pan J., Swanson R.A. Neuronal oxidative stress promotes α-synuclein aggregation in vivo. Antioxidants (Basel) 2022; 11(12): 2466, https://doi.org/10.3390/antiox11122466.
- Wegmann S., Biernat J., Mandelkow E. A current view on tau protein phosphorylation in Alzheimer’s disease. Curr Opin Neurobiol 2021; 69: 131–138, https://doi.org/10.1016/j.conb.2021.03.003.
- Conway K.A., Lee S.J., Rochet J.C., Ding T.T., Williamson R.E., Lansbury P.T. Jr. Acceleration of oligomerization, not fibrillization, is a shared property of both alpha-synuclein mutations linked to early-onset Parkinson’s disease: implications for pathogenesis and therapy. Proc Natl Acad Sci U S A 2000; 97(2): 571–576, https://doi.org/10.1073/pnas.97.2.571.
- Sgarbossa A. Natural biomolecules and protein aggregation: emerging strategies against amyloidogenesis. Int J Mol Sci 2012; 13(12): 17121–17137, https://doi.org/10.3390/ijms131217121.
- Harsolia R.S., Kanwar A., Gour S., Kumar V., Kumar V., Bansal R., Kumar S., Singh M., Yadav J.K. Predicted aggregation-prone region (APR) in βB1-crystallin forms the amyloid-like structure and induces aggregation of soluble proteins isolated from human cataractous eye lens. Int J Biol Macromol 2020; 163: 702–710, https://doi.org/10.1016/j.ijbiomac.2020.07.028.
- Housmans J.A.J., Wu G., Schymkowitz J., Rousseau F. A guide to studying protein aggregation. FEBS J 2023; 290(3): 554–583, https://doi.org/10.1111/febs.16312.
- Braak H., Del Tredici K., Rüb U., de Vos R.A., Jansen Steur E.N., Braak E. Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiol Aging 2003; 24(2): 197–211, https://doi.org/10.1016/s0197-4580(02)00065-9.
- Horsager J., Knudsen K., Sommerauer M. Clinical and imaging evidence of brain-first and body-first Parkinson’s disease. Neurobiol Dis 2022; 164: 105626, https://doi.org/10.1016/j.nbd.2022.105626.
- Braak H., Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol 1991; 82(4): 239–259, https://doi.org/10.1007/BF00308809.
- Trejo-Lopez J.A., Yachnis A.T., Prokop S. Neuropathology of Alzheimer’s disease. Neurotherapeutics 2022; 19(1): 173–185, https://doi.org/10.1007/s13311-021-01146-y.
- Macedo A.C., Tissot C., Therriault J., Servaes S., Wang Y.T., Fernandez-Arias J., Rahmouni N., Lussier F.Z., Vermeiren M., Bezgin G., Vitali P., Ng K.P., Zimmer E.R., Guiot M.C., Pascoal T.A., Gauthier S., Rosa-Neto P. The use of tau PET to stage Alzheimer disease according to the braak staging framework. J Nucl Med 2023; 64(8): 1171–1178, https://doi.org/10.2967/jnumed.122.265200.
- Leng K., Li E., Eser R., Piergies A., Sit R., Tan M., Neff N., Li S.H., Rodriguez R.D., Suemoto C.K., Leite R.E.P., Ehrenberg A.J., Pasqualucci C.A., Seeley W.W., Spina S., Heinsen H., Grinberg L.T., Kampmann M. Molecular characterization of selectively vulnerable neurons in Alzheimer’s disease. Nat Neurosci 2021; 24(2): 276–287, https://doi.org/10.1038/s41593-020-00764-7.
- Yang S., Park J.H., Lu H.C. Axonal energy metabolism, and the effects in aging and neurodegenerative diseases. Mol Neurodegener 2023; 18(1): 49, https://doi.org/10.1186/s13024-023-00634-3.
- Zimmer T.S., Orr A.L., Orr A.G. Astrocytes in selective vulnerability to neurodegenerative disease. Trends Neurosci 2024; 47(4): 289–302, https://doi.org/10.1016/j.tins.2024.02.008.
- Ma J., Gao J., Wang J., Xie A. Prion-like mechanisms in Parkinson’s disease. Front Neurosci 2019; 13: 552, https://doi.org/10.3389/fnins.2019.00552.
- da Silva Correia A., Schmitz M., Fischer A.L., da Silva Correia S., Simonetti F.L., Saher G., Goya-Maldonado R., Arora A.S., Fischer A., Outeiro T.F., Zerr I. Cellular prion protein acts as mediator of amyloid beta uptake by caveolin-1 causing cellular dysfunctions in vitro and in vivo. Alzheimers Dement 2024; 20(10): 6776–6792, https://doi.org/10.1002/alz.14120.
- Renner M., Melki R. Protein aggregation and prionopathies. Pathol Biol (Paris) 2014; 62(3): 162–168, https://doi.org/10.1016/j.patbio.2014.01.003.
- Condello C., Westaway D., Prusiner S.B. Expanding the prion paradigm to include Alzheimer and Parkinson diseases. JAMA Neurol 2024; 81(10): 1023–1024, https://doi.org/10.1001/jamaneurol.2024.2464.
- Aulić S., Masperone L., Narkiewicz J., Isopi E., Bistaffa E., Ambrosetti E., Pastore B., De Cecco E., Scaini D., Zago P., Moda F., Tagliavini F., Legname G. α-Synuclein amyloids hijack prion protein to gain cell entry, facilitate cell-to-cell spreading and block prion replication. Sci Rep 2017; 7(1): 10050, https://doi.org/10.1038/s41598-017-10236-x.
- Brás I.C., Lopes L.V., Outeiro T.F. Sensing α-synuclein from the outside via the prion protein: implications for neurodegeneration. Mov Disord 2018; 33(11): 1675–1684, https://doi.org/10.1002/mds.27478.
- Clavaguera F., Hench J., Goedert M., Tolnay M. Invited review: prion-like transmission and spreading of tau pathology. Neuropathol Appl Neurobiol 2015; 41(1): 47–58, https://doi.org/10.1111/nan.12197.
- Volpicelli-Daley L.A., Luk K.C., Lee V.M. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat Protoc 2014; 9(9): 2135–2146, https://doi.org/10.1038/nprot.2014.143.
- Tarutani A., Suzuki G., Shimozawa A., Nonaka T., Akiyama H., Hisanaga S., Hasegawa M. The effect of fragmented pathogenic α-synuclein seeds on prion-like propagation. J Biol Chem 2016; 291(36): 18675–18688, https://doi.org/10.1074/jbc.M116.734707.
- Novotny R., Langer F., Mahler J., Skodras A., Vlachos A., Wegenast-Braun B.M., Kaeser S.A., Neher J.J., Eisele Y.S., Pietrowski M.J., Nilsson K.P., Deller T., Staufenbiel M., Heimrich B., Jucker M. Conversion of synthetic Aβ to in vivo active seeds and amyloid plaque formation in a hippocampal slice culture model. J Neurosci 2016; 36(18): 5084–5093, https://doi.org/10.1523/JNEUROSCI.0258-16.2016.
- Kane M.D., Lipinski W.J., Callahan M.J., Bian F., Durham R.A., Schwarz R.D., Roher A.E., Walker L.C. Evidence for seeding of beta-amyloid by intracerebral infusion of Alzheimer brain extracts in beta-amyloid precursor protein-transgenic mice. J Neurosci 2000; 20(10): 3606–3611, https://doi.org/10.1523/JNEUROSCI.20-10-03606.2000.
- Eisele Y.S., Bolmont T., Heikenwalder M., Langer F., Jacobson L.H., Yan Z.X., Roth K., Aguzzi A., Staufenbiel M., Walker L.C., Jucker M. Induction of cerebral beta-amyloidosis: intracerebral versus systemic Abeta inoculation. Proc Natl Acad Sci U S A 2009; 106(31): 12926–12931, https://doi.org/10.1073/pnas.0903200106.
- He Z., Guo J.L., McBride J.D., Narasimhan S., Kim H., Changolkar L., Zhang B., Gathagan R.J., Yue C., Dengler C., Stieber A., Nitla M., Coulter D.A., Abel T., Brunden K.R., Trojanowski J.Q., Lee V.M. Amyloid-β plaques enhance Alzheimer’s brain tau-seeded pathologies by facilitating neuritic plaque tau aggregation. Nat Med 2018; 24(1): 29–38, https://doi.org/10.1038/nm.4443.
- Li X., Ospitalieri S., Robberechts T., Hofmann L., Schmid C., Rijal Upadhaya A., Koper M.J., von Arnim C.A.F., Kumar S., Willem M., Gnoth K., Ramakers M., Schymkowitz J., Rousseau F., Walter J., Ronisz A., Balakrishnan K., Thal D.R. Seeding, maturation and propagation of amyloid β-peptide aggregates in Alzheimer’s disease. Brain 2022; 145(10): 3558–3570, https://doi.org/10.1093/brain/awac202.
- Gary C., Lam S., Hérard A.S., Koch J.E., Petit F., Gipchtein P., Sawiak S.J., Caillierez R., Eddarkaoui S., Colin M., Aujard F., Deslys J.P.; French Neuropathology Network; Brouillet E., Buée L., Comoy E.E., Pifferi F., Picq J.L., Dhenain M. Encephalopathy induced by Alzheimer brain inoculation in a non-human primate. Acta Neuropathol Commun 2019; 7(1): 126, https://doi.org/10.1186/s40478-019-0771-x.
- Boi L., Pisanu A., Palmas M.F., Fusco G., Carboni E., Casu M.A., Satta V., Scherma M., Janda E., Mocci I., Mulas G., Ena A., Spiga S., Fadda P., De Simone A., Carta A.R. Modeling Parkinson’s disease neuropathology and symptoms by intranigral inoculation of preformed human α-synuclein oligomers. Int J Mol Sci 2020; 21(22): 8535, https://doi.org/10.3390/ijms21228535.
- Okuda S., Nakayama T., Uemura N., Hikawa R., Ikuno M., Yamakado H., Inoue H., Tachibana N., Hayashi Y., Takahashi R., Egawa N. Striatal-inoculation of α-synuclein preformed fibrils aggravated the phenotypes of REM sleep without atonia in A53T BAC-SNCA transgenic mice. Int J Mol Sci 2022; 23(21): 13390, https://doi.org/10.3390/ijms232113390.
- Flores-Cuadrado A., Saiz-Sanchez D., Mohedano-Moriano A., Martinez-Marcos A., Ubeda-Bañon I. Neurodegeneration and contralateral α-synuclein induction after intracerebral α-synuclein injections in the anterior olfactory nucleus of a Parkinson’s disease A53T mouse model. Acta Neuropathol Commun 2019; 7(1): 56, https://doi.org/10.1186/s40478-019-0713-7.
- Brackhan M., Calza G., Lundgren K., Bascuñana P., Brüning T., Soliymani R., Kumar R., Abelein A., Baumann M., Lalowski M., Pahnke J. Isotope-labeled amyloid-β does not transmit to the brain in a prion-like manner after peripheral administration. EMBO Rep 2022; 23(7): e54405, https://doi.org/10.15252/embr.202154405.
- Challis C., Hori A., Sampson T.R., Yoo B.B., Challis R.C., Hamilton A.M., Mazmanian S.K., Volpicelli-Daley L.A., Gradinaru V. Gut-seeded α-synuclein fibrils promote gut dysfunction and brain pathology specifically in aged mice. Nat Neurosci 2020; 23(3): 327–336, https://doi.org/10.1038/s41593-020-0589-7.
- Ferrer I., Zelaya M.V., Aguiló García M., Carmona M., López-González I., Andrés-Benito P., Lidón L., Gavín R., Garcia-Esparcia P., Del Rio J.A. Relevance of host tau in tau seeding and spreading in tauopathies. Brain Pathol 2020; 30(2): 298–318, https://doi.org/10.1111/bpa.12778.
- Ferrer I., Andrés-Benito P., Garcia-Esparcia P., López-Gonzalez I., Valiente D., Jordán-Pirla M., Carmona M., Sala-Jarque J., Gil V., Del Rio J.A. Differences in tau seeding in newborn and adult wild-type mice. Int J Mol Sci 2022; 23(9): 4789, https://doi.org/10.3390/ijms23094789.
- Williams T., Sorrentino Z., Weinrich M., Giasson B.I., Chakrabarty P. Differential cross-seeding properties of tau and α-synuclein in mouse models of tauopathy and synucleinopathy. Brain Commun 2020; 2(2): fcaa090, https://doi.org/10.1093/braincomms/fcaa090.
- Pan L., Li C., Meng L., Tian Y., He M., Yuan X., Zhang G., Zhang Z., Xiong J., Chen G., Zhang Z. Tau accelerates α-synuclein aggregation and spreading in Parkinson’s disease. Brain 2022; 145(10): 3454–3471, https://doi.org/10.1093/brain/awac171.
- Bassil F., Brown H.J., Pattabhiraman S., Iwasyk J.E., Maghames C.M., Meymand E.S., Cox T.O., Riddle D.M., Zhang B., Trojanowski J.Q., Lee V.M. Amyloid-beta (Aβ) plaques promote seeding and spreading of alpha-synuclein and tau in a mouse model of Lewy body disorders with Aβ pathology. Neuron 2020; 105(2): 260–275.e6, https://doi.org/10.1016/j.neuron.2019.10.010.
- Hamaguchi T., Taniguchi Y., Sakai K., Kitamoto T., Takao M., Murayama S., Iwasaki Y., Yoshida M., Shimizu H., Kakita A., Takahashi H., Suzuki H., Naiki H., Sanjo N., Mizusawa H., Yamada M. Significant association of cadaveric dura mater grafting with subpial Aβ deposition and meningeal amyloid angiopathy. Acta Neuropathol 2016; 132(2): 313–315, https://doi.org/10.1007/s00401-016-1588-3.
- Peng C., Trojanowski J.Q., Lee V.M. Protein transmission in neurodegenerative disease. Nat Rev Neurol 2020; 16(4): 199–212, https://doi.org/10.1038/s41582-020-0333-7.
- Purro S.A., Farrow M.A., Linehan J., Nazari T., Thomas D.X., Chen Z., Mengel D., Saito T., Saido T., Rudge P., Brandner S., Walsh D.M., Collinge J. Transmission of amyloid-β protein pathology from cadaveric pituitary growth hormone. Nature 2018; 564(7736): 415–419, https://doi.org/10.1038/s41586-018-0790-y.
- Banerjee G., Farmer S.F., Hyare H., Jaunmuktane Z., Mead S., Ryan N.S., Schott J.M., Werring D.J., Rudge P., Collinge J. Iatrogenic Alzheimer’s disease in recipients of cadaveric pituitary-derived growth hormone. Nat Med 2024; 30(2): 394–402, https://doi.org/10.1038/s41591-023-02729-2.
- Tong M.K., Thakur A., Yang T., Wong S.K., Li W.K., Lee Y. Amyloid-β oligomer-induced neurotoxicity by exosomal interactions between neuron and microglia. Biochem Biophys Res Commun 2024; 727: 150312, https://doi.org/10.1016/j.bbrc.2024.150312.
- Ngolab J., Trinh I., Rockenstein E., Mante M., Florio J., Trejo M., Masliah D., Adame A., Masliah E., Rissman R.A. Brain-derived exosomes from dementia with Lewy bodies propagate α-synuclein pathology. Acta Neuropathol Commun 2017; 5(1): 46, https://doi.org/10.1186/s40478-017-0445-5.
- Melachroinou K., Divolis G., Tsafaras G., Karampetsou M., Fortis S., Stratoulias Y., Papadopoulou G., Kriebardis A.G., Samiotaki M., Vekrellis K. Endogenous alpha-synuclein is essential for the transfer of pathology by exosome-enriched extracellular vesicles, following inoculation with preformed fibrils in vivo. Aging Dis 2024; 15(2): 869–892, https://doi.org/10.14336/AD.2023.0614.
- Guo M., Wang J., Zhao Y., Feng Y., Han S., Dong Q., Cui M., Tieu K. Microglial exosomes facilitate α-synuclein transmission in Parkinson’s disease. Brain 2020; 143(5): 1476–1497, https://doi.org/10.1093/brain/awaa090.
- Polanco J.C., Hand G.R., Briner A., Li C., Götz J. Exosomes induce endolysosomal permeabilization as a gateway by which exosomal tau seeds escape into the cytosol. Acta Neuropathol 2021; 141(2): 235–256, https://doi.org/10.1007/s00401-020-02254-3.
- Jain N., Ulrich J.D. TREM2 and microglia exosomes: a potential highway for pathological tau. Mol Neurodegener 2022; 17(1): 73, https://doi.org/10.1186/s13024-022-00581-5.
- Sardar Sinha M., Ansell-Schultz A., Civitelli L., Hildesjö C., Larsson M., Lannfelt L., Ingelsson M., Hallbeck M. Alzheimer’s disease pathology propagation by exosomes containing toxic amyloid-beta oligomers. Acta Neuropathol 2018; 136(1): 41–56, https://doi.org/10.1007/s00401-018-1868-1.
- Ruan Z., Pathak D., Venkatesan Kalavai S., Yoshii-Kitahara A., Muraoka S., Bhatt N., Takamatsu-Yukawa K., Hu J., Wang Y., Hersh S., Ericsson M., Gorantla S., Gendelman H.E., Kayed R., Ikezu S., Luebke J.I., Ikezu T. Alzheimer’s disease brain-derived extracellular vesicles spread tau pathology in interneurons. Brain 2021; 144(1): 288–309, https://doi.org/10.1093/brain/awaa376.
- Wei S., Ma X., Chen Y., Wang J., Hu L., Liu Z., Mo L., Zhou N., Chen W., Zhu H., Yan S. Alzheimer’s disease-derived outer membrane vesicles exacerbate cognitive dysfunction, modulate the gut microbiome, and increase neuroinflammation and amyloid-β production. Mol Neurobiol 2025; 62(4): 5109–5132, https://doi.org/10.1007/s12035-024-04579-6.
- Liu W.L., Lin H.W., Lin M.R., Yu Y., Liu H.H., Dai Y.L., Chen L.W., Jia W.W., He X.J., Li X.L., Zhu J.F., Xue X.H., Tao J., Chen L.D. Emerging blood exosome-based biomarkers for preclinical and clinical Alzheimer’s disease: a meta-analysis and systematic review. Neural Regen Res 2022; 17(11): 2381–2390, https://doi.org/10.4103/1673-5374.335832.
- Kluge A., Bunk J., Schaeffer E., Drobny A., Xiang W., Knacke H., Bub S., Lückstädt W., Arnold P., Lucius R., Berg D., Zunke F. Detection of neuron-derived pathological α-synuclein in blood. Brain 2022; 145(9): 3058–3071, https://doi.org/10.1093/brain/awac115.
- Kluge A., Schaeffer E., Bunk J., Sommerauer M., Röttgen S., Schulte C., Roeben B., von Thaler A.-K., Welzel J., Lucius R., Heinzel S., Xiang W., Eschweiler G.W., Maetzler W., Suenkel U., Berg D. Detecting misfolded α-synuclein in blood years before the diagnosis of Parkinson’s disease. Mov Disord 2024; 39: 1289–1299, https://doi.org/10.1002/mds.29766.
- Mothes T., Portal B., Konstantinidis E., Eltom K., Libard S., Streubel-Gallasch L., Ingelsson M., Rostami J., Lindskog M., Erlandsson A. Astrocytic uptake of neuronal corpses promotes cell-to-cell spreading of tau pathology. Acta Neuropathol Commun 2023; 11(1): 97, https://doi.org/10.1186/s40478-023-01589-8.
- Rajasekaran S., Witt S.N. Trojan horses and tunneling nanotubes enable α-synuclein pathology to spread in Parkinson disease. PLoS Biol 2021; 19(7): e3001331, https://doi.org/10.1371/journal.pbio.3001331.
- Scheiblich H., Eikens F., Wischhof L., Opitz S., Jüngling K., Cserép C., Schmidt S.V., Lambertz J., Bellande T., Pósfai B., Geck C., Spitzer J., Odainic A., Castro-Gomez S., Schwartz S., Boussaad I., Krüger R., Glaab E., Di Monte D.A., Bano D., Dénes Á., Latz E., Melki R., Pape H.C., Heneka M.T. Microglia rescue neurons from aggregate-induced neuronal dysfunction and death through tunneling nanotubes. Neuron 2024; 112(18): 3106–3125.e8, https://doi.org/10.1016/j.neuron.2024.06.029.
- Chakraborty R., Nonaka T., Hasegawa M., Zurzolo C. Tunnelling nanotubes between neuronal and microglial cells allow bi-directional transfer of α-synuclein and mitochondria. Cell Death Dis 2023; 14(5): 329, https://doi.org/10.1038/s41419-023-05835-8.
- Xu Y., Du S., Marsh J.A., Horie K., Sato C., Ballabio A., Karch C.M., Holtzman D.M., Zheng H. TFEB regulates lysosomal exocytosis of tau and its loss of function exacerbates tau pathology and spreading. Mol Psychiatry 2021; 26(10): 5925–5939, https://doi.org/10.1038/s41380-020-0738-0.
- Shearer L.J., Petersen N.O., Woodside M.T. Internalization of α-synuclein oligomers into SH-SY5Y cells. Biophys J 2021; 120(5): 877–885, https://doi.org/10.1016/j.bpj.2020.12.031.
- Zhang S., Liu Y.Q., Jia C., Lim Y.J., Feng G., Xu E., Long H., Kimura Y., Tao Y., Zhao C., Wang C., Liu Z., Hu J.J., Ma M.R., Liu Z., Jiang L., Li D., Wang R., Dawson V.L., Dawson T.M., Li Y.M., Mao X., Liu C. Mechanistic basis for receptor-mediated pathological α-synuclein fibril cell-to-cell transmission in Parkinson’s disease. Proc Natl Acad Sci U S A 2021; 118(26): e2011196118, https://doi.org/10.1073/pnas.2011196118.
- Shi J.M., Zhu L., Lan X., Zhao D.W., He Y.J., Sun Z.Q., Wu D., Li H.Y. Endocytosis is a key mode of interaction between extracellular β-amyloid and the cell membrane. Biophys J 2020; 119(6): 1078–1090, https://doi.org/10.1016/j.bpj.2020.07.035.
- Lungu O., Bares M. Editorial: neuropsychology through the MRI looking glass. Front Neurol 2020; 11: 609897, https://doi.org/10.3389/fneur.2020.609897.
- Bousiges O., Blanc F. Biomarkers of dementia with Lewy bodies: differential diagnostic with Alzheimer’s disease. Int J Mol Sci 2022; 23(12): 6371, https://doi.org/10.3390/ijms23126371.
- Smailagic N., Vacante M., Hyde C., Martin S., Ukoumunne O., Sachpekidis C. 18F-FDG PET for the early diagnosis of Alzheimer’s disease dementia and other dementias in people with mild cognitive impairment (MCI). Cochrane Database Syst Rev 2015; 1(1): CD010632, https://doi.org/10.1002/14651858.CD010632.pub2.
- Lombardi G., Crescioli G., Cavedo E., Lucenteforte E., Casazza G., Bellatorre A.G., Lista C., Costantino G., Frisoni G., Virgili G., Filippini G. Structural magnetic resonance imaging for the early diagnosis of dementia due to Alzheimer’s disease in people with mild cognitive impairment. Cochrane Database Syst Rev 2020; 3(3): CD009628, https://doi.org/10.1002/14651858.CD009628.pub2.
- Solje E., Benussi A., Buratti E., Remes A.M., Haapasalo A., Borroni B. State-of-the-art methods and emerging fluid biomarkers in the diagnostics of dementia — a short review and diagnostic algorithm. Diagnostics (Basel) 2021; 11(5): 788, https://doi.org/10.3390/diagnostics11050788.
- Skillbäck T., Farahmand B.Y., Rosén C., Mattsson N., Nägga K., Kilander L., Religa D., Wimo A., Winblad B., Schott J.M., Blennow K., Eriksdotter M., Zetterberg H. Cerebrospinal fluid tau and amyloid-β1-42 in patients with dementia. Brain 2015; 138(Pt 9): 2716–2731, https://doi.org/10.1093/brain/awv181.
- Arranz J., Zhu N., Rubio-Guerra S., Rodríguez-Baz Í., Ferrer R., Carmona-Iragui M., Barroeta I., Illán-Gala I., Santos-Santos M., Fortea J., Lleó A., Tondo M., Alcolea D. Diagnostic performance of plasma pTau217, pTau181, Aβ1-42 and Aβ1-40 in the LUMIPULSE automated platform for the detection of Alzheimer disease. Alzheimers Res Ther 2024; 16(1): 139, https://doi.org/10.1186/s13195-024-01513-9.
- Gąsior-Głogowska M.E., Szulc N., Szefczyk M. Challenges in experimental methods. Methods Mol Biol 2022; 2340: 281–307, https://doi.org/10.1007/978-1-0716-1546-1_13.
- Guerrero-Ferreira R., Taylor N.M., Arteni A.A., Kumari P., Mona D., Ringler P., Britschgi M., Lauer M.E., Makky A., Verasdonck J., Riek R., Melki R., Meier B.H., Böckmann A., Bousset L., Stahlberg H. Two new polymorphic structures of human full-length alpha-synuclein fibrils solved by cryo-electron microscopy. Elife 2019; 8: e48907, https://doi.org/10.7554/eLife.48907.
- Motta C., Di Donna M.G., Bonomi C.G., Assogna M., Chiaravalloti A., Mercuri N.B., Koch G., Martorana A. Different associations between amyloid-βeta 42, amyloid-βeta 40, and amyloid-βeta 42/40 with soluble phosphorylated-tau and disease burden in Alzheimer’s disease: a cerebrospinal fluid and fluorodeoxyglucose-positron emission tomography study. Alzheimers Res Ther 2023; 15(1): 144, https://doi.org/10.1186/s13195-023-01291-w.
- Santos J.R.F., Bauer C., Schuchhardt J., Wedekind D., Waniek K., Lachmann I., Wiltfang J., Vogelgsang J. Validation of a prototype tau Thr231 phosphorylation CSF ELISA as a potential biomarker for Alzheimer’s disease. J Neural Transm (Vienna) 2019; 126(3): 339–348, https://doi.org/10.1007/s00702-019-01982-5.
- Коваленко Е.А., Махнович Е.В., Первунина А.В., Акимов К.А., Мараховская Е.А., Боголепова А.Н. Биомаркеры крови в ранней диагностике болезни Альцгеймера. Эффективная фармакотерапия 2023; 19(45): 30–36.
- Shinohara M., Hirokawa J., Shimodaira A., Tashiro Y., Suzuki K., Gheni G., Fukumori A., Matsubara T., Morishima M., Saito Y., Murayama S., Sato N. ELISA evaluation of tau accumulation in the brains of patients with Alzheimer disease. J Neuropathol Exp Neurol 2021; 80(7): 652–662, https://doi.org/10.1093/jnen/nlab047.
- Herrmann M., Golombowski S., Kräuchi K., Frey P., Mourton-Gilles C., Hulette C., Rosenberg C., Müller-Spahn F., Hock C. ELISA-quantitation of phosphorylated tau protein in the Alzheimer’s disease brain. Eur Neurol 1999; 42(4): 205–210, https://doi.org/10.1159/000008108.
- Teunissen C.E., Kimble L., Bayoumy S., Bolsewig K., Burtscher F., Coppens S., Das S., Gogishvili D., Fernandes Gomes B., Gómez de San José N., Mavrina E., Meda F.J., Mohaupt P., Mravinacová S., Waury K., Wojdała A.L., Abeln S., Chiasserini D., Hirtz C., Gaetani L., Vermunt L., Bellomo G., Halbgebauer S., Lehmann S., Månberg A., Nilsson P., Otto M., Vanmechelen E., Verberk I.M.W., Willemse E., Zetterberg H.; MIRIADE consortium. Methods to discover and validate biofluid-based biomarkers in neurodegenerative dementias. Mol Cell Proteomics 2023; 22(10): 100629, https://doi.org/10.1016/j.mcpro.2023.100629.
- Truffi M., Garofalo M., Ricciardi A., Cotta Ramusino M., Perini G., Scaranzin S., Gastaldi M., Albasini S., Costa A., Chiavetta V., Corsi F., Morasso C., Gagliardi S. Neurofilament-light chain quantification by Simoa and Ella in plasma from patients with dementia: a comparative study. Sci Rep 2023; 13(1): 4041, https://doi.org/10.1038/s41598-023-29704-8.
- Carrette O., Demalte I., Scherl A., Yalkinoglu O., Corthals G., Burkhard P., Hochstrasser D.F., Sanchez J.C. A panel of cerebrospinal fluid potential biomarkers for the diagnosis of Alzheimer’s disease. Proteomics 2003; 3(8): 1486–1494, https://doi.org/10.1002/pmic.200300470.
- Conrotto P., Souchelnytskyi S. Proteomic approaches in biological and medical sciences: principles and applications. Exp Oncol 2008; 30(3): 171–180.
- Bader J.M., Geyer P.E., Müller J.B., Strauss M.T., Koch M., Leypoldt F., Koertvelyessy P., Bittner D., Schipke C.G., Incesoy E.I., Peters O., Deigendesch N., Simons M., Jensen M.K., Zetterberg H., Mann M. Proteome profiling in cerebrospinal fluid reveals novel biomarkers of Alzheimer’s disease. Mol Syst Biol 2020; 16(6): e9356, https://doi.org/10.15252/msb.20199356.
- Karayel O., Virreira Winter S., Padmanabhan S., Kuras Y.I., Vu D.T., Tuncali I., Merchant K., Wills A.M., Scherzer C.R., Mann M. Proteome profiling of cerebrospinal fluid reveals biomarker candidates for Parkinson’s disease. Cell Rep Med 2022; 3(6): 100661, https://doi.org/10.1016/j.xcrm.2022.100661.
- Teunissen C.E., Elias N., Koel-Simmelink M.J., Durieux-Lu S., Malekzadeh A., Pham T.V., Piersma S.R., Beccari T., Meeter L.H., Dopper E.G., van Swieten J.C., Jimenez C.R., Pijnenburg Y.A. Novel diagnostic cerebrospinal fluid biomarkers for pathologic subtypes of frontotemporal dementia identified by proteomics. Alzheimers Dement (Amst) 2016; 2: 86–94, https://doi.org/10.1016/j.dadm.2015.12.004.
- Laszlo Z.I., Hindley N., Sanchez Avila A., Kline R.A., Eaton S.L., Lamont D.J., Smith C., Spires-Jones T.L., Wishart T.M., Henstridge C.M. Synaptic proteomics reveal distinct molecular signatures of cognitive change and C9ORF72 repeat expansion in the human ALS cortex. Acta Neuropathol Commun 2022; 10(1): 156, https://doi.org/10.1186/s40478-022-01455-z.
- Flynn J.D., Lee J.C. Raman fingerprints of amyloid structures. Chem Commun (Camb) 2018; 54(51): 6983–6986, https://doi.org/10.1039/c8cc03217c.
- Chen C., Qi J., Li Y., Li D., Wu L., Li R., Chen Q., Sun N. Applications of Raman spectroscopy in the diagnosis and monitoring of neurodegenerative diseases. Front Neurosci 2024; 18: 1301107, https://doi.org/10.3389/fnins.2024.1301107.
- Lochocki B., Morrema T.H.J., Ariese F., Hoozemans J.J.M., de Boer J.F. The search for a unique Raman signature of amyloid-beta plaques in human brain tissue from Alzheimer’s disease patients. Analyst 2020; 145(5): 1724–1736, https://doi.org/10.1039/c9an02087j.
- Cennamo G., Montorio D., Morra V.B., Criscuolo C., Lanzillo R., Salvatore E., Camerlingo C., Lisitskiy M., Delfino I., Portaccio M., Lepore M. Surface-enhanced Raman spectroscopy of tears: toward a diagnostic tool for neurodegenerative disease identification. J Biomed Opt 2020; 25(8): 1–12, https://doi.org/10.1117/1.JBO.25.8.087002.
- Carlomagno C., Bertazioli D., Gualerzi A., Picciolini S., Andrico M., Rodà F., Meloni M., Banfi P.I., Verde F., Ticozzi N., Silani V., Messina E., Bedoni M. Identification of the raman salivary fingerprint of Parkinson’s disease through the spectroscopic-computational combinatory approach. Front Neurosci 2021; 15: 704963, https://doi.org/10.3389/fnins.2021.704963.
- Sun J., Shi Z., Wang L., Zhang X., Luo C., Hua J., Feng M., Chen Z., Wang M., Xu C. Construction of a microcavity-based microfluidic chip with simultaneous SERS quantification of dual biomarkers for early diagnosis of Alzheimer’s disease. Talanta 2023; 261: 124677, https://doi.org/10.1016/j.talanta.2023.124677.
- Soares Martins T., Magalhães S., Rosa I.M., Vogelgsang J., Wiltfang J., Delgadillo I., Catita J., da Cruz E Silva O.A.B., Nunes A., Henriques A.G. Potential of FTIR spectroscopy applied to exosomes for Alzheimer’s disease discrimination: a pilot study. J Alzheimers Dis 2020; 74(1): 391–405, https://doi.org/10.3233/JAD-191034.
- Soares Martins T., Ferreira M., Magalhães S., Leandro K., Almeida L.P., Vogelgsang J., Breitling B., Hansen N., Esselmann H., Wiltfang J., da Cruz E Silva O.A.B., Nunes A., Henriques A.G. FTIR spectroscopy and blood-derived extracellular vesicles duo in Alzheimer’s disease. J Alzheimers Dis 2024; 98(3): 1157–1167, https://doi.org/10.3233/JAD-231239.
- Paraskevaidi M., Morais C.L.M., Lima K.M.G., Snowden J.S., Saxon J.A., Richardson A.M.T., Jones M., Mann D.M.A., Allsop D., Martin-Hirsch P.L., Martin F.L. Differential diagnosis of Alzheimer’s disease using spectrochemical analysis of blood. Proc Natl Acad Sci U S A 2017; 114(38): E7929–E7938, https://doi.org/10.1073/pnas.1701517114.
- Benseny-Cases N., Klementieva O., Cotte M., Ferrer I., Cladera J. Microspectroscopy (μFTIR) reveals co-localization of lipid oxidation and amyloid plaques in human Alzheimer disease brains. Anal Chem 2014; 86(24): 12047–12054, https://doi.org/10.1021/ac502667b.
- Palombo F., Tamagnini F., Jeynes J.C.G., Mattana S., Swift I., Nallala J., Hancock J., Brown J.T., Randall A.D., Stone N. Detection of Aβ plaque-associated astrogliosis in Alzheimer’s disease brain by spectroscopic imaging and immunohistochemistry. Analyst 2018; 143(4): 850–857, https://doi.org/10.1039/c7an01747b.
- Röhr D., Boon B.D.C., Schuler M., Kremer K., Hoozemans J.J.M., Bouwman F.H., El-Mashtoly S.F., Nabers A., Großerueschkamp F., Rozemuller A.J.M., Gerwert K. Label-free vibrational imaging of different Aβ plaque types in Alzheimer’s disease reveals sequential events in plaque development. Acta Neuropathol Commun 2020; 8(1): 222, https://doi.org/10.1186/s40478-020-01091-5.
- Gras S.L., Waddington L.J., Goldie K.N. Transmission electron microscopy of amyloid fibrils. Methods Mol Biol 2011; 752: 197–214, https://doi.org/10.1007/978-1-60327-223-0_13.
- Kollmer M., Close W., Funk L., Rasmussen J., Bsoul A., Schierhorn A., Schmidt M., Sigurdson C.J., Jucker M., Fändrich M. Cryo-EM structure and polymorphism of Aβ amyloid fibrils purified from Alzheimer’s brain tissue. Nat Commun 2019; 10(1): 4760, https://doi.org/10.1038/s41467-019-12683-8.
- Yang Y., Arseni D., Zhang W., Huang M., Lövestam S., Schweighauser M., Kotecha A., Murzin A.G., Peak-Chew S.Y., Macdonald J., Lavenir I., Garringer H.J., Gelpi E., Newell K.L., Kovacs G.G., Vidal R., Ghetti B., Ryskeldi-Falcon B., Scheres S.H.W., Goedert M. Cryo-EM structures of amyloid-β 42 filaments from human brains. Science 2022; 375(6577): 167–172, https://doi.org/10.1126/science.abm7285.
- Zhang H., Zheng X., Kwok R.T.K., Wang J., Leung N.L.C., Shi L., Sun J.Z., Tang Z., Lam J.W.Y., Qin A., Tang B.Z. In situ monitoring of molecular aggregation using circular dichroism. Nat Commun 2018; 9(1): 4961, https://doi.org/10.1038/s41467-018-07299-3.
- Waeytens J., Turbant F., Arluison V., Raussens V., Wien F. Analysis of bacterial amyloid interaction with lipidic membrane by orientated circular dichroism and infrared spectroscopies. Methods Mol Biol 2022; 2538: 217–234, https://doi.org/10.1007/978-1-0716-2529-3_15.
- Hu H.Y., Jiang L.L., Hong J.Y. Study of protein amyloid-like aggregates by solid-state circular dichroism spectroscopy. Curr Protein Pept Sci 2017; 18(1): 100–103, https://doi.org/10.2174/1389203717666160709185323.
- Rybicka A., Longhi G., Castiglioni E., Abbate S., Dzwolak W., Babenko V., Pecul M. Thioflavin T: electronic circular dichroism and circularly polarized luminescence induced by amyloid fibrils. Chemphyschem 2016; 17(18): 2931–2937, https://doi.org/10.1002/cphc.201600235.
- Protein folding, misfolding, and disease: methods and protocols. Hill A.F., Barnham K.J., Bottomley S.P., Cappai R. (editors). Humana Press; 2011, https://doi.org/10.1007/978-1-60327-223-0.
- Concha-Marambio L., Pritzkow S., Shahnawaz M., Farris C.M., Soto C. Seed amplification assay for the detection of pathologic alpha-synuclein aggregates in cerebrospinal fluid. Nat Protoc 2023; 18(4): 1179–1196, https://doi.org/10.1038/s41596-022-00787-3.
- Standke H.G., Kraus A. Seed amplification and RT-QuIC assays to investigate protein seed structures and strains. Cell Tissue Res 2023; 392(1): 323–335, https://doi.org/10.1007/s00441-022-03595-z.
- Saborio G.P., Permanne B., Soto C. Sensitive detection of pathological prion protein by cyclic amplification of protein misfolding. Nature 2001; 411(6839): 810–813, https://doi.org/10.1038/35081095.
- Saá P., Castilla J., Soto C. Ultra-efficient replication of infectious prions by automated protein misfolding cyclic amplification. J Biol Chem 2006; 281(46): 35245–35252, https://doi.org/10.1074/jbc.M603964200.
- Wang F., Pritzkow S., Soto C. PMCA for ultrasensitive detection of prions and to study disease biology. Cell Tissue Res 2023; 392(1): 307–321, https://doi.org/10.1007/s00441-022-03727-5.
- Atarashi R., Wilham J.M., Christensen L., Hughson A.G., Moore R.A., Johnson L.M., Onwubiko H.A., Priola S.A., Caughey B. Simplified ultrasensitive prion detection by recombinant PrP conversion with shaking. Nat Methods 2008; 5(3): 211–212, https://doi.org/10.1038/nmeth0308-211.
- Atarashi R., Satoh K., Sano K., Fuse T., Yamaguchi N., Ishibashi D., Matsubara T., Nakagaki T., Yamanaka H., Shirabe S., Yamada M., Mizusawa H., Kitamoto T., Klug G., McGlade A., Collins S.J., Nishida N. Ultrasensitive human prion detection in cerebrospinal fluid by real-time quaking-induced conversion. Nat Med 2011; 17(2): 175–178, https://doi.org/10.1038/nm.2294.
- Giaccone G., Moda F. PMCA applications for prion detection in peripheral tissues of patients with variant Creutzfeldt–Jakob disease. Biomolecules 2020; 10(3): 405, https://doi.org/10.3390/biom10030405.
- Rhoads D.D., Wrona A., Foutz A., Blevins J., Glisic K., Person M., Maddox R.A., Belay E.D., Schonberger L.B., Tatsuoka C., Cohen M.L., Appleby B.S. Diagnosis of prion diseases by RT-QuIC results in improved surveillance. Neurology 2020; 95(8): e1017–e1026, https://doi.org/10.1212/WNL.0000000000010086.
- Brandel J.P., Culeux A., Grznarova K., Levavasseur E., Lamy P., Privat N., Welaratne A., Denouel A., Laplanche J.L., Haik S. Amplification techniques and diagnosis of prion diseases. Rev Neurol (Paris) 2019; 175(7–8): 458–463, https://doi.org/10.1016/j.neurol.2019.06.002.
- Groveman B.R., Orrù C.D., Hughson A.G., Raymond L.D., Zanusso G., Ghetti B., Campbell K.J., Safar J., Galasko D., Caughey B. Rapid and ultra-sensitive quantitation of disease-associated α-synuclein seeds in brain and cerebrospinal fluid by αSyn RT-QuIC. Acta Neuropathol Commun 2018; 6(1): 7, https://doi.org/10.1186/s40478-018-0508-2.
- Shahnawaz M., Mukherjee A., Pritzkow S., Mendez N., Rabadia P., Liu X., Hu B., Schmeichel A., Singer W., Wu G., Tsai A.L., Shirani H., Nilsson K.P.R., Low P.A., Soto C. Discriminating α-synuclein strains in Parkinson’s disease and multiple system atrophy. Nature 2020; 578(7794): 273–277, https://doi.org/10.1038/s41586-020-1984-7.
- Bellomo G., De Luca C.M.G., Paoletti F.P., Gaetani L., Moda F., Parnetti L. α-Synuclein seed amplification assays for diagnosing synucleinopathies: the way forward. Neurology 2022; 99(5): 195–205, https://doi.org/10.1212/WNL.0000000000200878.
- Okuzumi A., Hatano T., Matsumoto G., Nojiri S., Ueno S.I., Imamichi-Tatano Y., Kimura H., Kakuta S., Kondo A., Fukuhara T., Li Y., Funayama M., Saiki S., Taniguchi D., Tsunemi T., McIntyre D., Gérardy J.J., Mittelbronn M., Kruger R., Uchiyama Y., Nukina N., Hattori N. Propagative α-synuclein seeds as serum biomarkers for synucleinopathies. Nat Med 2023; 29(6): 1448–1455, https://doi.org/10.1038/s41591-023-02358-9.
- Manca M., Kraus A. Defining the protein seeds of neurodegeneration using real-time quaking-induced conversion assays. Biomolecules 2020; 10(9): 1233, https://doi.org/10.3390/biom10091233.
- Fairfoul G., McGuire L.I., Pal S., Ironside J.W., Neumann J., Christie S., Joachim C., Esiri M., Evetts S.G., Rolinski M., Baig F., Ruffmann C., Wade-Martins R., Hu M.T., Parkkinen L., Green A.J. Alpha-synuclein RT-QuIC in the CSF of patients with alpha-synucleinopathies. Ann Clin Transl Neurol 2016; 3(10): 812–818, https://doi.org/10.1002/acn3.338.
- Rossi M., Candelise N., Baiardi S., Capellari S., Giannini G., Orrù C.D., Antelmi E., Mammana A., Hughson A.G., Calandra-Buonaura G., Ladogana A., Plazzi G., Cortelli P., Caughey B., Parchi P. Ultrasensitive RT-QuIC assay with high sensitivity and specificity for Lewy body-associated synucleinopathies. Acta Neuropathol 2020; 140(1): 49–62, https://doi.org/10.1007/s00401-020-02160-8.
- Wang Y., Hu J., Chen X., Wang S., Zhang C., Hu J., Guo D., Liu X. Real-time quaking-induced conversion assay is accurate for Lewy body diseases: a meta-analysis. Neurol Sci 2022; 43(7): 4125–4132, https://doi.org/10.1007/s10072-022-06014-x.
- Srivastava A., Alam P., Caughey B. RT-QuIC and related assays for detecting and quantifying prion-like pathological seeds of α-synuclein. Biomolecules 2022; 12(4): 576, https://doi.org/10.3390/biom12040576.
- Grossauer A., Hemicker G., Krismer F., Peball M., Djamshidian A., Poewe W., Seppi K., Heim B. α-Synuclein seed amplification assays in the diagnosis of synucleinopathies using cerebrospinal fluid-a systematic review and meta-analysis. Mov Disord Clin Pract 2023; 10(5): 737–747, https://doi.org/10.1002/mdc3.13710.
- Brockmann K., Quadalti C., Lerche S., Rossi M., Wurster I., Baiardi S., Roeben B., Mammana A., Zimmermann M., Hauser A.K., Deuschle C., Schulte C., Waniek K., Lachmann I., Sjödin S., Brinkmalm A., Blennow K., Zetterberg H., Gasser T., Parchi P. Association between CSF alpha-synuclein seeding activity and genetic status in Parkinson’s disease and dementia with Lewy bodies. Acta Neuropathol Commun 2021; 9(1): 175, https://doi.org/10.1186/s40478-021-01276-6.
- Siderowf A., Concha-Marambio L., Lafontant D.E., Farris C.M., Ma Y., Urenia P.A., Nguyen H., Alcalay R.N., Chahine L.M., Foroud T., Galasko D., Kieburtz K., Merchant K., Mollenhauer B., Poston K.L., Seibyl J., Simuni T., Tanner C.M., Weintraub D., Videnovic A., Choi S.H., Kurth R., Caspell-Garcia C., Coffey C.S., Frasier M., Oliveira L.M.A., Hutten S.J., Sherer T., Marek K., Soto C. Parkinson’s Progression Markers Initiative. Assessment of heterogeneity among participants in the Parkinson’s progression markers initiative cohort using α-synuclein seed amplification: a cross-sectional study. Lancet Neurol 2023; 22(5): 407–417, https://doi.org/10.1016/S1474-4422(23)00109-6.
- Bongianni M., Catalan M., Perra D., Fontana E., Janes F., Bertolotti C., Sacchetto L., Capaldi S., Tagliapietra M., Polverino P., Tommasini V., Bellavita G., Kachoie E.A., Baruca R., Bernardini A., Valente M., Fiorini M., Bronzato E., Tamburin S., Bertolasi L., Brozzetti L., Cecchini M.P., Gigli G., Monaco S., Manganotti P., Zanusso G. Olfactory swab sampling optimization for α-synuclein aggregate detection in patients with Parkinson’s disease. Transl Neurodegener 2022; 11(1): 37, https://doi.org/10.1186/s40035-022-00311-3.
- Perra D., Bongianni M., Novi G., Janes F., Bessi V., Capaldi S., Sacchetto L., Tagliapietra M., Schenone G., Morbelli S., Fiorini M., Cattaruzza T., Mazzon G., Orrù C.D., Catalan M., Polverino P., Bernardini A., Pellitteri G., Valente M., Bertolotti C., Nacmias B., Maggiore G., Cavallaro T., Manganotti P., Gigli G., Monaco S., Nobili F., Zanusso G. Alpha-synuclein seeds in olfactory mucosa and cerebrospinal fluid of patients with dementia with Lewy bodies. Brain Commun 2021; 3(2): fcab045, https://doi.org/10.1093/braincomms/fcab045.
- Bargar C., Wang W., Gunzler S.A., LeFevre A., Wang Z., Lerner A.J., Singh N., Tatsuoka C., Appleby B., Zhu X., Xu R., Haroutunian V., Zou W.Q., Ma J., Chen S.G. Streamlined alpha-synuclein RT-QuIC assay for various biospecimens in Parkinson’s disease and dementia with Lewy bodies. Acta Neuropathol Commun 2021; 9(1): 62, https://doi.org/10.1186/s40478-021-01175-w.
- Stefani A., Iranzo A., Holzknecht E., Perra D., Bongianni M., Gaig C., Heim B., Serradell M., Sacchetto L., Garrido A., Capaldi S., Sánchez-Gómez A., Cecchini M.P., Mariotto S., Ferrari S., Fiorini M., Schmutzhard J., Cocchiara P., Vilaseca I., Brozzetti L., Monaco S., Jose Marti M., Seppi K., Tolosa E., Santamaria J., Högl B., Poewe W., Zanusso G; SINBAR (Sleep Innsbruck Barcelona) group. Alpha-synuclein seeds in olfactory mucosa of patients with isolated REM sleep behaviour disorder. Brain 2021; 144(4): 1118–1126, https://doi.org/10.1093/brain/awab005.
- Kuang Y., Mao H., Gan T., Guo W., Dai W., Huang W., Wu Z., Li H., Huang X., Yang X., Xu P.Y. A skin-specific α-synuclein seeding amplification assay for diagnosing Parkinson’s disease. NPJ Parkinsons Dis 2024; 10(1): 129, https://doi.org/10.1038/s41531-024-00738-7.
- Wang Z., Gilliland T., Kim H.J., Gerasimenko M., Sajewski K., Camacho M.V., Bebek G., Chen S.G., Gunzler S.A., Kong Q. A minimally invasive biomarker for sensitive and accurate diagnosis of Parkinson’s disease. Acta Neuropathol Commun 2024; 12(1): 167, https://doi.org/10.1186/s40478-024-01873-1.
- Manca M., Standke H.G., Browne D.F., Huntley M.L., Thomas O.R., Orrú C.D., Hughson A.G., Kim Y., Zhang J., Tatsuoka C., Zhu X., Hiniker A., Coughlin D.G., Galasko D., Kraus A. Tau seeds occur before earliest Alzheimer’s changes and are prevalent across neurodegenerative diseases. Acta Neuropathol 2023; 146(1): 31–50, https://doi.org/10.1007/s00401-023-02574-0.
- Saijo E., Ghetti B., Zanusso G., Oblak A., Furman J.L., Diamond M.I., Kraus A., Caughey B. Ultrasensitive and selective detection of 3-repeat tau seeding activity in Pick disease brain and cerebrospinal fluid. Acta Neuropathol 2017; 133(5): 751–765, https://doi.org/10.1007/s00401-017-1692-z.
- Saijo E., Metrick M.A. 2nd, Koga S., Parchi P., Litvan I., Spina S., Boxer A., Rojas J.C., Galasko D., Kraus A., Rossi M., Newell K., Zanusso G., Grinberg L.T., Seeley W.W., Ghetti B., Dickson D.W., Caughey B. 4-repeat tau seeds and templating subtypes as brain and CSF biomarkers of frontotemporal lobar degeneration. Acta Neuropathol 2020; 139(1): 63–77, https://doi.org/10.1007/s00401-019-02080-2.
- Kraus A., Saijo E., Metrick M.A. 2nd, Newell K., Sigurdson C.J., Zanusso G., Ghetti B., Caughey B. Seeding selectivity and ultrasensitive detection of tau aggregate conformers of Alzheimer disease. Acta Neuropathol 2019; 137(4): 585–598, https://doi.org/10.1007/s00401-018-1947-3.
- Tennant J.M., Henderson D.M., Wisniewski T.M., Hoover E.A. RT-QuIC detection of tauopathies using full-length tau substrates. Prion 2020; 14(1): 249–256, https://doi.org/10.1080/19336896.2020.1832946.
- Salvadores N., Shahnawaz M., Scarpini E., Tagliavini F., Soto C. Detection of misfolded Aβ oligomers for sensitive biochemical diagnosis of Alzheimer’s disease. Cell Rep 2014; 7(1): 261–268, https://doi.org/10.1016/j.celrep.2014.02.031.
- Estrada L.D., Chamorro D., Yañez M.J., Gonzalez M., Leal N., von Bernhardi R., Dulcey A.E., Marugan J., Ferrer M., Soto C., Zanlungo S., Inestrosa N.C., Alvarez A.R. Reduction of blood amyloid-β oligomers in Alzheimer’s disease transgenic mice by c-Abl kinase inhibition. J Alzheimers Dis 2016; 54(3): 1193–1205, https://doi.org/10.3233/JAD-151087.
- An S.S., Lim K.T., Oh H.J., Lee B.S., Zukic E., Ju Y.R., Yokoyama T., Kim S.Y., Welker E. Differentiating blood samples from scrapie infected and non-infected hamsters by detecting disease-associated prion proteins using Multimer Detection System. Biochem Biophys Res Commun 2010; 392(4): 505–509, https://doi.org/10.1016/j.bbrc.2010.01.053.
- An S.S.A., Lee B.S., Yu J.S., Lim K., Kim G.J., Lee R., Kim S., Kang S., Park Y.H., Wang M.J., Yang Y.S., Youn Y.C., Kim S. Dynamic changes of oligomeric amyloid β levels in plasma induced by spiked synthetic Aβ42. Alzheimers Res Ther 2017; 9(1): 86, https://doi.org/10.1186/s13195-017-0310-6.
- Meyer N., Janot J.M., Torrent J., Balme S. Real-time fast amyloid seeding and translocation of α-synuclein with a nanopipette. ACS Cent Sci 2022; 8(4): 441–448, https://doi.org/10.1021/acscentsci.1c01404.
- Meyer N., Bentin J., Janot J.M., Abrao-Nemeir I., Charles-Achille S., Pratlong M., Aquilina A., Trinquet E., Perrier V., Picaud F., Torrent J., Balme S. Ultrasensitive detection of Aβ42 seeds in cerebrospinal fluid with a nanopipette-based real-time fast amyloid seeding and translocation assay. Anal Chem 2023; 95(34): 12623–12630, https://doi.org/10.1021/acs.analchem.3c00017.
- Christenson P.R., Li M., Rowden G., Larsen P.A., Oh S.H. Nanoparticle-enhanced RT-QuIC (Nano-QuIC) diagnostic assay for misfolded proteins. Nano Lett 2023; 23(9): 4074–4081, https://doi.org/10.1021/acs.nanolett.3c01001.
- Kim Y., Ko S.M., Nam J.M. Protein-nanoparticle interaction-induced changes in protein structure and aggregation. Chem Asian J 2016; 11(13): 1869–1877, https://doi.org/10.1002/asia.201600236.
- Hajipour M.J., Safavi-Sohi R., Sharifi S., Mahmoud N., Ashkarran A.A., Voke E., Serpooshan V., Ramezankhani M., Milani A.S., Landry M.P., Mahmoudi M. An overview of nanoparticle protein corona literature. Small 2023; 19(36): e2301838, https://doi.org/10.1002/smll.202301838.
- Chatzikonstantinou S., Kazis D., Karantali E., Knights M., McKenna J., Petridis F., Mavroudis I. A meta-analysis on RT-QuIC for the diagnosis of sporadic CJD. Acta Neurol Belg 2021; 121(2): 341–349, https://doi.org/10.1007/s13760-021-01596-3.
- Krawczuk D., Groblewska M., Mroczko J., Winkel I., Mroczko B. The role of α-synuclein in etiology of neurodegenerative diseases. Int J Mol Sci 2024; 25(17): 9197, https://doi.org/10.3390/ijms25179197.
- Zhang K., Mizuma H., Zhang X., Takahashi K., Jin C., Song F., Gao Y., Kanayama Y., Wu Y., Li Y., Ma L., Tian M., Zhang H., Watanabe Y. PET imaging of neural activity, β-amyloid, and tau in normal brain aging. Eur J Nucl Med Mol Imaging 2021; 48(12): 3859–3871, https://doi.org/10.1007/s00259-021-05230-5.
- Park M.C., Kim M., Lim G.T., Kang S.M., An S.S., Kim T.S., Kang J.Y. Droplet-based magnetic bead immunoassay using microchannel-connected multiwell plates (μCHAMPs) for the detection of amyloid beta oligomers. Lab Chip 2016; 16(12): 2245–2253, https://doi.org/10.1039/c6lc00013d.
- Cheong D.Y., Lee W., Park I., Park J., Lee G. Amyloid formation in nanoliter droplets. Int J Mol Sci 2022; 23(10): 5480, https://doi.org/10.3390/ijms23105480.
- Pfammatter M., Andreasen M., Meisl G., Taylor C.G., Adamcik J., Bolisetty S., Sánchez-Ferrer A., Klenerman D., Dobson C.M., Mezzenga R., Knowles T.P.J., Aguzzi A., Hornemann S. Absolute quantification of amyloid propagons by digital microfluidics. Anal Chem 2017; 89(22): 12306–12313, https://doi.org/10.1021/acs.analchem.7b03279.










