Оригинальные мышиные модели глиобластомы: анализ патофизиологических характеристик трансплантированной опухолевой ткани
Цель исследования — изучение морфологических, молекулярных и иммунологических характеристик полученных нами двух оригинальных тканевых перевиваемых штаммов глиобластомы (ГБ) — ГБ M2 и ГБ M6.
Материалы и методы. В ходе работы получены и охарактеризованы два новых химически индуцированных тканевых штамма злокачественной диффузной глиомы мыши. Ткани ГБ M2 и ГБ M6 были трансплантированы ортотопически иммунокомпетентным мышам линии C57BL/6. Оценивали клиническую и морфологическую картину роста опухолей, а также внутриопухолевый иммунный ответ и экспрессию целевых генов.
Результаты. Клинические проявления роста ГБ M2 и ГБ M6 у мышей включают нарушения моторики, кахексию и приапизм. Морфологически ГБ M2 и ГБ M6 характеризуются диффузной пролиферацией, клеточным и ядерным полиморфизмом, высокой митотической активностью с патологическими формами митоза, соответствующими агрессивной природе этих опухолей. CD3+ Т-лимфоциты (~32%) и F4/80+ макрофаги (~28–50%) выраженно инфильтрировали обе опухоли. В ГБ M2 отмечено более высокое содержание макрофагов F4/80+, чем в ГБ M6. Гены Cdkn2a, S100b, Mki67, Pten, Vegfa, Hif1a, Sox2, Abcb1 и Gfap сверхэкспрессированы в обеих опухолях. Экспрессия генов Cd133, Tp53 и Pdgfra повышена в ГБ M2. Высокую экспрессию Pi3k и Gdnf наблюдали в ГБ M6. Экспрессия Cd44, Pi3k, Hif1a, Gdnf и Egfr была выше в тканях ГБ M6 по сравнению с ГБ M2, в то время как экспрессия Cdkn2a, Tp53, Cd133 и Pdgfrα была выше в тканях ГБ M2, чем в ГБ M6.
Заключение. Трансплантируемые тканевые модели ГБ M2 и ГБ M6 имеют сходные с человеческими внутриопухолевые иммунные реакции, клинические и морфологические признаки, а также паттерны экспрессии генов, которые важны для дальнейших исследований в нейроонкологии. Эти модели могут быть использованы для разработки диагностических и терапевтических методов и изучения канцерогенеза.
Введение
Глиобластома (ГБ) — наиболее агрессивный тип опухоли ЦНС взрослых. В настоящее время, несмотря на улучшение краткосрочной выживаемости, долгосрочные эффекты терапии остаются низкими, опухоль рецидивирует почти в 100% случаев [1]. Понимание механизмов возникновения, прогрессирования и эволюции опухоли имеет решающее значение для разработки терапевтических подходов. Для этого необходимы релевантные доклинические модели ГБ. Мышиная модель наиболее часто используется в доклинических исследованиях [2]. Известны аллогенные, ксенотрансплантатные и генно-инженерные модифицированные мышиные модели опухолей, каждая из которых имеет свои преимущества и ограничения. Генно-инженерные модели — дорогостоящие и трудоемкие, а экспрессия измененных генов может подавляться в последующих поколениях животных [3]. Ксенотрансплантаты не отражают ранний стохастический канцерогенез, а молекулярно-биологические характеристики организма-хозяина и опухоли различаются. Такие модели не позволяет оценить изменения в иммунной системе при канцерогенезе и терапии, в том числе иммунотерапии [4]. Аллогенные модели не воспроизводят опухоли человека со всеми характерными молекулярными аномалиями [5], однако их легко моделировать и применять в больших сериях экспериментов. При проведении трансляционных исследований глиомы головного мозга человека необходимо учитывать ряд ключевых факторов: молекулярно-биологические и патофизиологические характеристики самой модели глиомы и модельного организма, а также местный и системный иммунный ответ и клиническую картину роста опухоли. Реакция модели ГБ на лечение должна быть подобна реакции опухоли у человека, а опухоль — обладать химио- и радиорезистентностью [6]. Существующие модели ГБ имеют уникальные характеристики, которые следует учитывать при планировании экспериментов, при этом в настоящее время нет ни одной модели, которая бы точно воспроизводила ГБ человека [2, 7–9]. Низкая воспроизводимость успешных результатов доклинических исследований, сложность их корректной интерпретации и трансляции в клиническую практику подчеркивают важность правильного выбора экспериментальных моделей.
Цель исследования — изучить морфологические, молекулярные и иммунологические характеристики полученных нами двух оригинальных штаммов глиобластомы M2 и M6.
Согласно нашему исследованию, трансплантируемые модели опухолевой ткани обладают преимуществами перед широко используемыми клеточными моделями: они имеют гетерогенный клеточный состав и экспрессию генов, более сходную с опухолями человека [10, 11].
Материалы и методы
Исследование проведено на 54 половозрелых самцах домовой мыши (Mus musculus) линии C57BL/6 (20–22 г). Животные были распределены следующим образом: получение первичных тканей опухолей ГБ М2 и ГБ М6 — 22 мыши; ревитализация тканей опухолей — 14; основной эксперимент — 12, из них ГБ М2 — 6 и ГБ М6 — 6; интактные животные — 6 особей. Животных содержали в клетках с 12-часовым циклом свет/темнота с неограниченным доступом к пище и воде. Хирургические и культуральные процедуры проводили в асептических условиях. Эксперименты с животными осуществляли согласно Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986). Исследование одобрено Комиссией по биоэтике НИИ морфологии человека им. академика А.П. Авцына Российского научного центра хирургии им. академика Б.В. Петровского (протокол №29(5) от 8 ноября 2021 г.). Животных с первыми клиническими признаками роста опухоли (снижение активности, паралич, потеря веса и слабость) подвергали эвтаназии [12].
Индукция первичных опухолей канцерогеном. Первичные ткани опухолей были получены после имплантации трокаром 1 мг твердого канцерогена 7,12-диметилбенз[а]антрацена (ДМБА) (Thermo Fisher Scientific, США) в правое полушарие головного мозга домовым мышам (Mus musculus; n=22) под внутрибрюшинным наркозом: использовали Золетил 100 в дозе 0,25 мг/животное (Virbac, Франция) с Ксиланитом в дозе 0,5 мг/животное (Interchemie Werken, Нидерланды). В течение 60–90 сут после имплантации ДМБА у мышей возникал спектр опухолей ЦНС. Опухоли с морфологическими признаками ГБ (ГБ M2 и ГБ М6) были отобраны для первичных последовательных трансплантаций (8–10 трансплантаций).
После 8–10 последовательных трансплантаций первичной опухолевой ткани мышам были получены стабильные модели ГБ M2 и ГБ М6, обладающие сходной морфологией и латентными периодами роста. Трансплантируемые опухолевые штаммы ГБ M2 и ГБ М6 зарегистрированы, хранятся в криохранилище НИИ морфологии человека им. академика А.П. Авцына Российского научного центра хирургии им. академика Б.В. Петровского при –196°C. Они каталогизированы в Коллекции экспериментальных опухолей нервной системы (http://ckp-rf.ru/usu/498710/). Их применяют в экспериментальной нейроонкологии.
Ревитализация и трансплантация образцов тканей ГБ M2 и ГБ М6 после криоконсервации. Перед основным исследованием опухолевые ткани ревитализировали. Для этого ампулу с тканью опухоли размораживали в теплой воде (39°C), центрифугировали в течение 7 мин при 250 g. Затем надосадочную жидкость удаляли, а осадок ресуспендировали в среде для культивирования без глютамина («ПанЭко», Россия). Шприцем и иглой (20G) с ограничителем интрацеребрально вводили ~10 мкл ткани ГБ (~4·105 клеток). Каждому животному (n=14) вводили клетки под внутрибрюшинным наркозом (Золетил 100 в дозе 0,25 мг/животное и Ксиланит в дозе 5 мг/животное).
Трансплантация образцов тканей ГБ M2 и ГБ М6 после ревитализации для изучения выживаемости и «наработки» образцов тканей ГБ M2 и ГБ М6. Выросшие ткани ГБ на последних стадиях их роста трансплантировали в течение часа животным основной экспериментальной группы, как описано ниже.
После механической диссоциации (пипетирование) тканей опухоли количественно определяли жизнеспособность клеток в образцах этой ткани (n=12) объемом ~10 мкл. Для оценки жизнеспособности клеток использовали анализ с 0,4% водным раствором трипанового синего (Servicebio, Китай). С помощью камеры Горяева («МиниМед», Россия) под световым микроскопом (Carl Zeiss, Германия) подсчитывали количество клеток сразу после добавления красителя. Жизнеспособность клеток составила не менее 98%.
Механически измельченные ткани ГБ M2 (n=6) и ГБ M6 (n=6) объемом ~10 мкл (~4·105 клеток) имплантировали в головной мозг мышей под внутрибрюшинным наркозом Золетила 100 в дозе 0,25 мг/животное с Ксиланитом в дозе 0,5 мг/животное. Подробная процедура трансплантации опухоли описана в нашей предыдущей работе [13]. Однако в данном случае опухоль трансплантировали в головной мозг на 2 мм правее сагиттального шва (sutura sagittalis) и на 2 мм каудальнее венечного шва (sutura coronalis) на глубину 2 мм в область полосатого тела с помощью стереотаксической установки (RWD, Китай); AP: +1 мм; ML: +2,0 мм латеральнее брегмы; DV: –2,0 мм относительно поверхности черепа. Скорость введения составила ~ 10 мкл/10 с для обеих моделей.
МР-изображения головного мозга мышей фиксировали интравитально для ГБ М2 на 16-е сутки и для ГБ М6 — на 23-и сутки роста опухоли с помощью томографа 7Т (BioSpec 70/30 USR; Bruker BioSpin, Германия) с амплитудой градиента 105 мТл/м. Анестезию выполняли изофлураном (Laboratorios Karizoo, Испания). Аксиальные T1-взвешенные изображения получали через 15 мин после внутрибрюшинной инъекции контрастного вещества гадобутола (Schering, Германия) в дозе 15 мг гадолиния на животное. Толщина среза составила 0,8 мм, количество срезов — до 32.
Морфологическое исследование головного мозга животных с ГБ проводили на терминальных стадиях роста опухоли, в частности для ГБ M2 — на 17–19-е сутки и для ГБ M6 — на 24–26-е сутки после трансплантации. Эти временны́е рамки соответствуют появлению первых клинических симптомов у мышей; смерть наступает в течение 1–2 сут с момента появления первых клинических признаков (снижение активности, паралич, потеря веса и приапизм). Эвтаназию животных проводили Золетилом 100 в дозе 10 мг/кг. Головной мозг с ГБ (n=12) фиксировали в 10% забуференном формалине («БиоВитрум», Россия). Срезы ткани толщиной 7 мкм готовили на микротоме Microm HM 340 (Thermo Fisher Scientific, Германия) и окрашивали гематоксилином и эозином («БиоВитрум», Россия). Образцы тканей каждого штамма ГБ взяты не менее чем у 6 мышей. Морфологические изменения оценивали под световым микроскопом (Carl Zeiss, Германия).
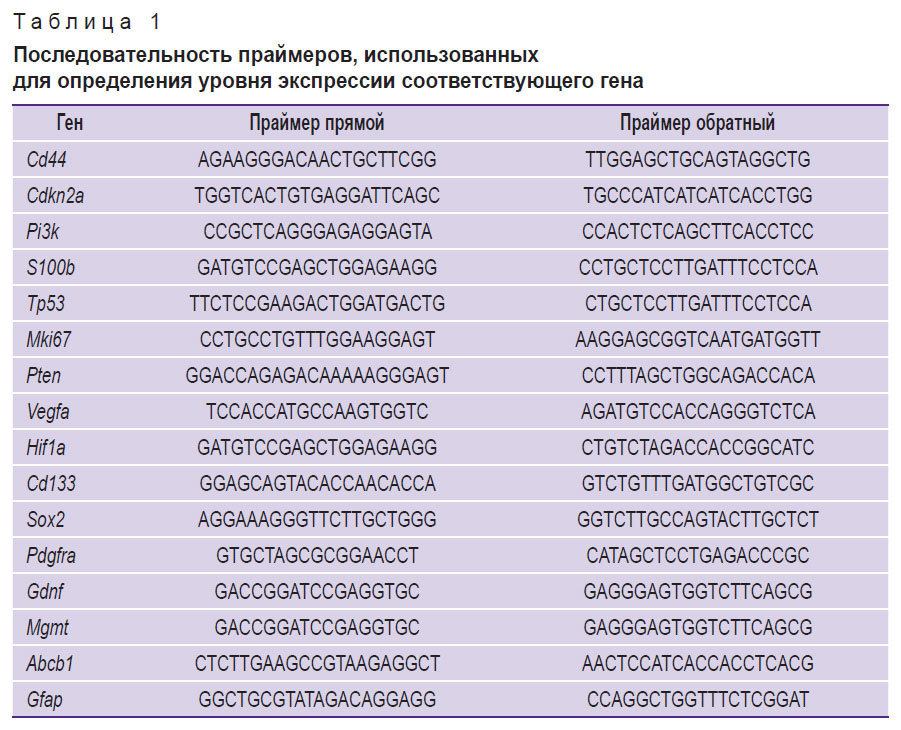
Экспрессию генов анализировали с помощью ПЦР в режиме реального времени. Общую РНК выделяли набором RNeasy Plus Mini (Qiagen, США) из 6 образцов ГБ M2, 6 образцов ГБ M6 и 6 образцов интактного головного мозга (каждый весом по 30 мг). Образцы хранили в растворе РНК Later (Invitrogen, США). Содержание мРНК составило более 300 нг/мкл (NanoPhotometer N50; Implen, Германия). С помощью набора реагентов MMLV RT kit («Евроген», Россия) синтезировали кДНК из общей РНК. Выполняли ПЦР с использованием реагентов qPCRmix-HS SYBR и флуоресцентного интеркалирующего красителя SYBR Green I («Евроген», Россия). Праймеры подбирали с помощью онлайн-ресурса Primer-BLAST (США) согласно общепринятым требованиям. Выбранные праймеры (табл. 1) синтезированы компанией «Евроген». Мы применяли метод порогового цикла (Ct) и рассчитывали относительную экспрессию генов по методике [14] с учетом рекомендаций [15]. В качестве контроля использовали ген Gapdh. Сравнивали экспрессии мРНК между образцами опухолей ГБ M2, ГБ M6 и тканями интактного головного мозга мыши.
|
Таблица 1. Последовательность праймеров, использованных для определения уровня экспрессии соответствующего гена |
Относительное количество лимфоцитов и макрофагов в опухолевой ткани (106 клеток; не менее 5 образцов для каждого штамма ГБ) оценивали с использованием проточного цитометра Cytomics FC 500 (Beckman Coulter, США). Эритроциты лизировали с помощью раствора OptiLyse C (eBioscience, США). Образцы ГБ инкубировали с антителами к CD3-FITC (eBioscience, США) и F4/80-PE (Miltenyi Biotec, Германия) не менее 30 мин при комнатной температуре. Для контроля аутофлуоресценции использовали образцы, не содержащие антител.
Статистическую обработку данных проводили с помощью пакета Statistica 10.0 (StatSoft Inc, США). Экспериментальные данные характеризовали, используя медиану (Me) и межквартильный размах [Q1; Q3]. Статистические различия определяли с помощью теста множественных сравнений Краскела–Уоллиса. Для попарного сравнения применяли тест Данна. Значения считали статистически значимыми при р≤0,05.
Результаты
Частота образования ГБ М2 и ГБ М6 составила 95–100%. Средний латентный период роста ГБ M2 — от 17 до 35 сут, ГБ M6 — от 23 до 34 сут.
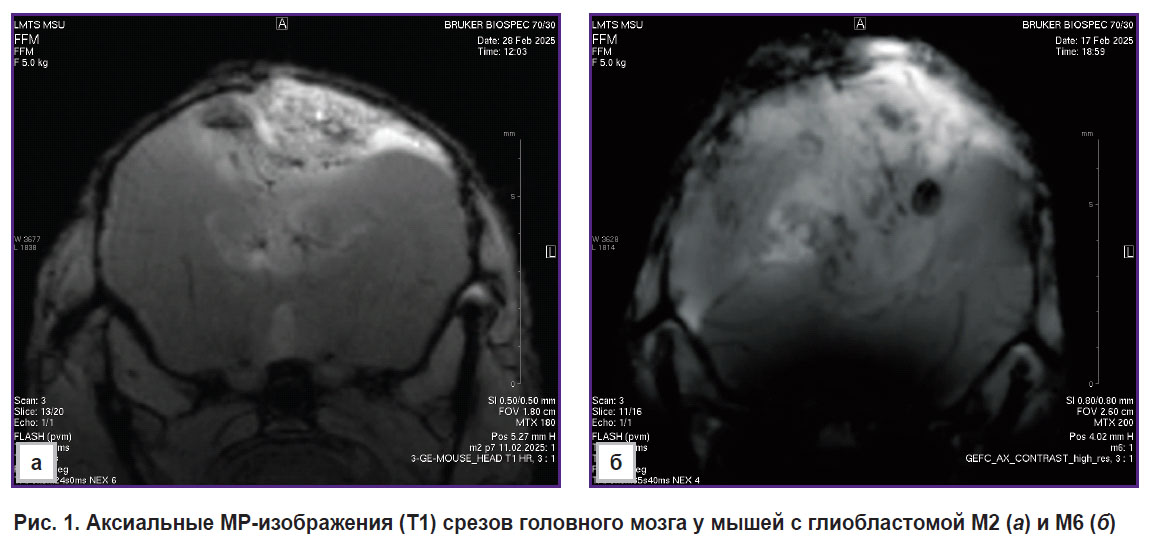
По данным МР-исследования головного мозга мышей с ГБ М2 и ГБ М6, опухоли были расположены в правом полушарии, на поздних сроках наблюдали рост в левое полушарие и масс-эффект: асимметрию полушарий, компрессию с деформацией тканей и латеральное смещение срединных структур головного мозга (рис. 1).
|
Рис. 1. Аксиальные МР-изображения (Т1) срезов головного мозга у мышей с глиобластомой М2 (а) и М6 (б) |
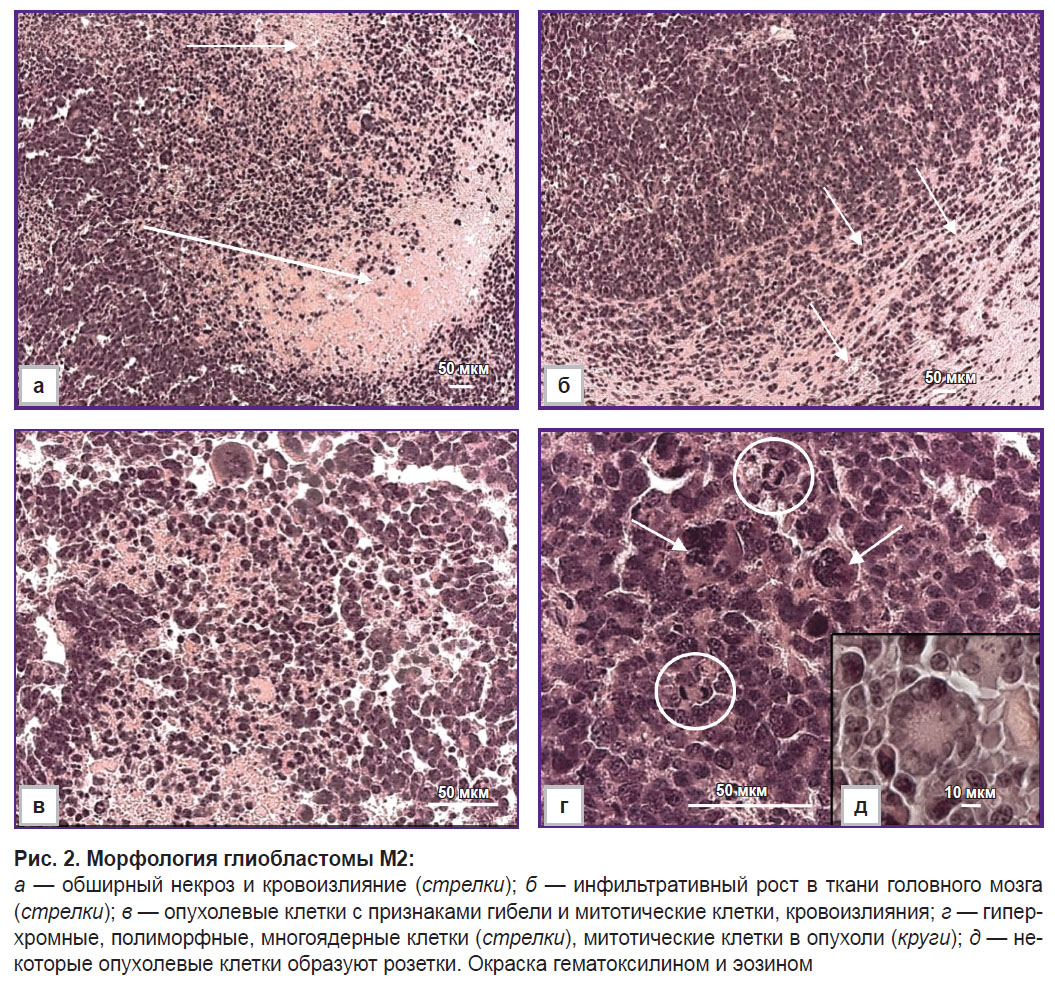
Морфологически клетки ГБ M2 (n=6) — крупные, с высокой митотической активностью (рис. 2, г), они распространяются в кору и подкорковые структуры головного мозга. Клетки полиморфные, атипичные и имеют крупные ядра, наблюдается высокая клеточность и значительное число многоядерных гигантских клеток (рис. 2, в; см. рис. 2, г). В опухоли обнаружено около 2% митозов, в том числе патологических, что соответствовало двум или более митозам на 100 опухолевых клеток. Около 2% гибнущих клеток имели фрагментированные ядра в виде апоптотических телец. На границе опухоли и головного мозга наблюдали инфильтративный рост (рис. 2, б), скопление астроглии и перитуморальный отек. В опухоли обнаружены некроз и кровоизлияния (рис. 2, а). Розеткоподобные скопления опухолевых клеток (рис. 2, д) являются диагностическим признаком некоторых опухолей, включая медуллобластому и нейробластому.
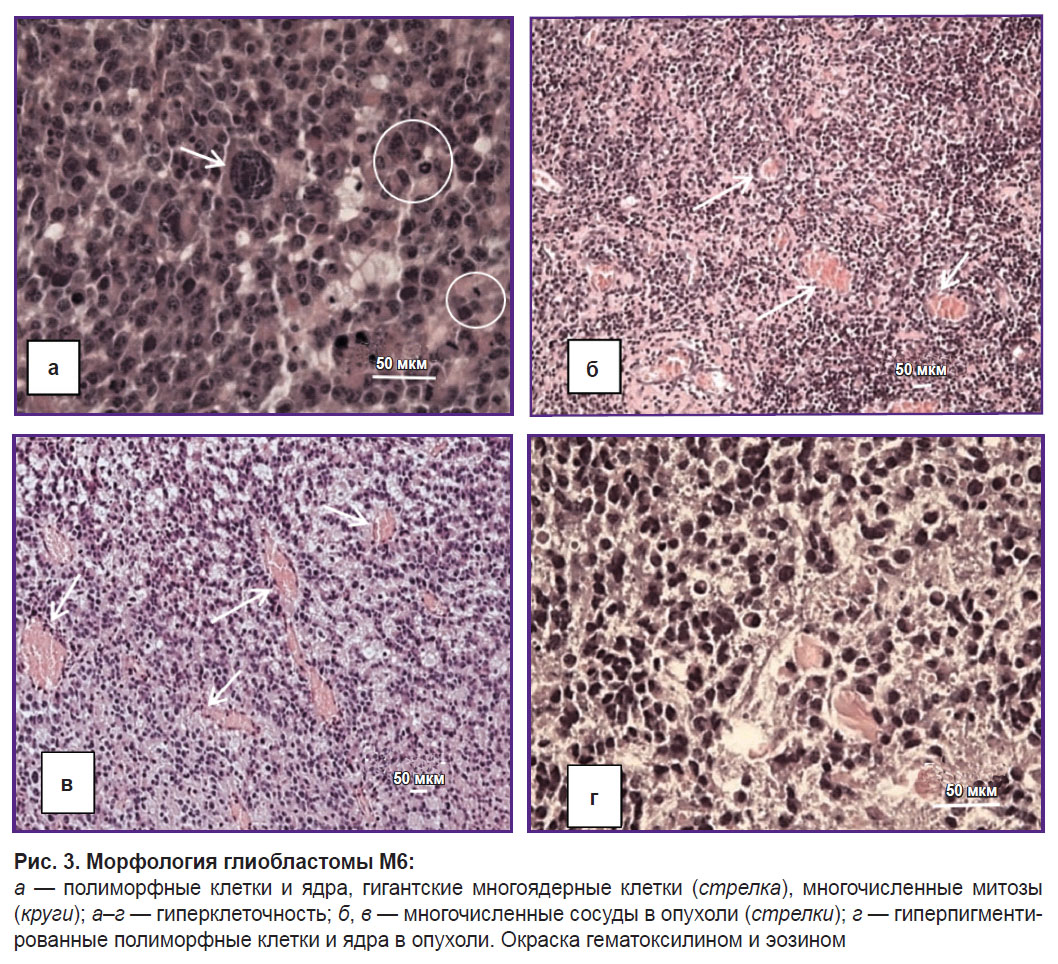
Опухолевые клетки ГБ М6 (n=6) — полиморфные, с узкими краями цитоплазмы, преимущественно гигантские, с множественными ядрами (рис. 3, а, г). Митозы в опухолевых клетках, включая патологические формы митозов, составляют около 3% (см. рис. 3, а). Это соответствует трем или более митозам на 100 опухолевых клеток. Опухолевые клетки в виде апоптотических телец составляют около 3%. Внутри опухоли наблюдали многочисленные сосуды с деформированными просветами, разрастание микрососудов и кровоизлияния (рис. 3, б–г). Обнаружено несколько участков некроза. Рост опухоли — инфильтративный, периваскулярный.
Ткани ГБ M2 и ГБ M6 были инфильтрированы CD3+ Т-лимфоцитами и F4/80+ макрофагами. Относительное количество Т-лимфоцитов и макрофагов в группе ГБ M6 (n=5) составило 32,01 [8,90; 33,60]% и 28,4 [14,8; 28,4]% соответственно. В образцах ГБ M2 (n=5) количество макрофагов было статистически значимо (p=0,04) выше — 50,3 [49,4; 51,2]%, чем в образцах ГБ M6 — 28,4 [14,8; 28,4]%.
Сравнительная оценка экспрессии генов в тканевых моделях ГБ М2, ГБ М6 и интактных тканях головного мозга, а также данные по ГБ человека [16–32] представлены в табл. 2.
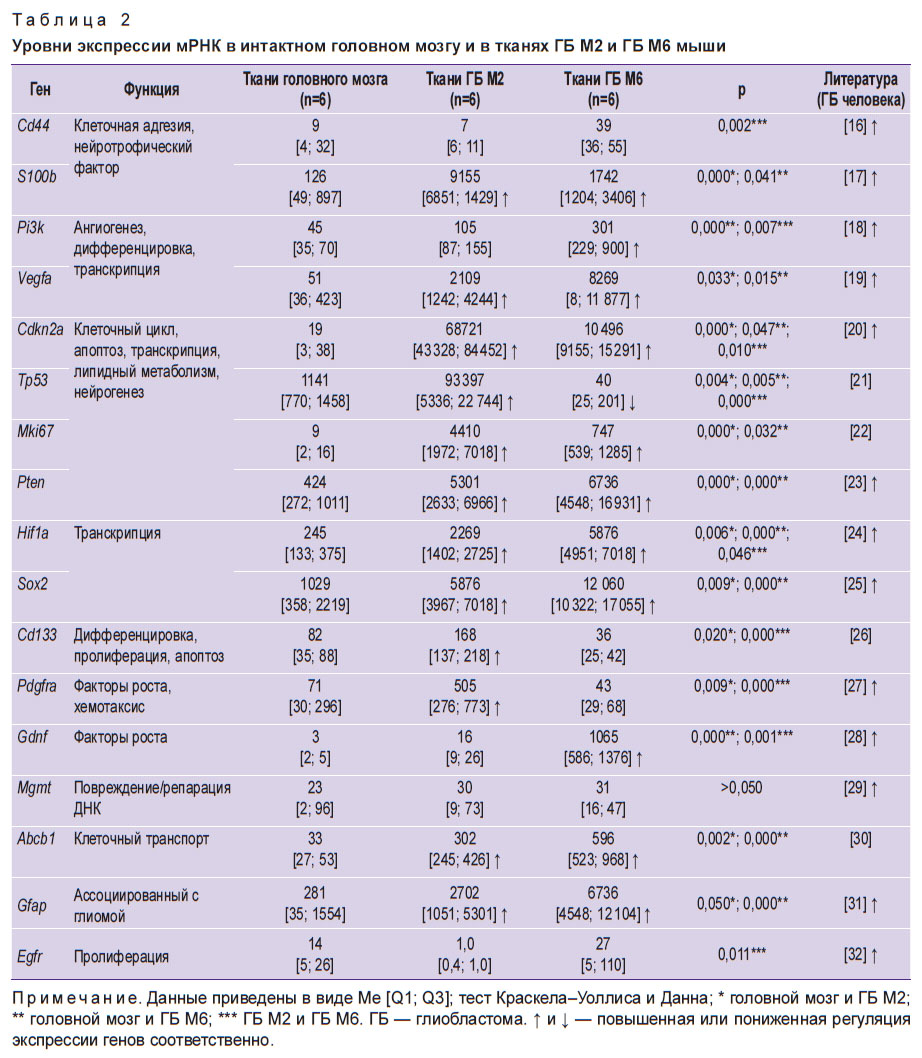
|
Таблица 2. Уровни экспрессии мРНК в интактном головном мозгу и в тканях ГБ M2 и ГБ M6 мыши |
Обсуждение
В ряде исследований отмечено, что у пациентов [33–36] и у экспериментальных животных [37–39] с опухолями головного мозга наблюдают клиническую картину, связанную со снижением активности, параличом, потерей веса и приапизмом. Подобные симптомы мы отмечали и у мышей с ГБ М2 и ГБ М6, что указывает на терминальное состояние животных. Клинические проявления связаны с метаболическими изменениями: кахексией, коагулопатиями, а также ишемическим повреждением головного мозга. Это выражается в ассоциированных симптомах, таких как приапизм и двигательный дефицит.
Для присвоения опухоли высокой степени злокачественности невропатологи используют как порог отсечения 2-а или более митоза во всем образце или 1-н митоз при небольшой биопсии [40], это согласуется с нашими данными о высокой степени злокачественности ГБ М2 и ГБ М6.
Глиобластома — иммуносупрессивная опухоль. Локальные и системные нарушения иммунного ответа ограничивают возможности иммунотерапии. Незрелые клетки костного мозга и макрофаги могут снижать инфильтрацию и активацию Т-клеток в глиомах [41]. Клетки глиомы и инфильтрирующие иммунные клетки избегают иммунного надзора, секретируя супрессивные цитокины — IL-6, IL-10, TGF-β, простагландин E-2 и др., и их экспрессия зависит от факторов роста, секретируемых опухолевыми клетками [42]. Возможно, разница в количестве Т-лимфоцитов и макрофагов в ГБ M2 и ГБ M6 определяется более высокой секрецией противовоспалительных цитокинов клетками ГБ M2.
Инфильтрирующие опухоль клетки стромы, включая макрофаги/микроглию, оказывают большее иммуносупрессивное воздействие, чем сами опухолевые клетки. Иммуносупрессия формирует клональный состав опухолевых клеток и регулирует экспрессию генов [43]. Повышенное содержание Т-лимфоцитов в опухоли указывает на ее воспалительный статус, а высокое количество F4/80+ — на иммуносупрессивный фон в опухоли [44]. Иммуносупрессия, опосредованная ВИЧ, связана с увеличением частоты возникновения глиом и прогрессированием глиомы низкой степени злокачественности до ГБ, что свидетельствует о значительном вкладе иммуносупрессивного микроокружения в прогрессирование глиом. У пациентов с ГБ и мышей с ГБ количество Т-лимфоцитов CD4 в крови (системная лимфопения) в отдельных случаях может соответствовать количеству CD4 Т-лимфоцитов при СПИДе. В лимфоидных органах наблюдают дефицит Т-клеток, а в костном мозге в большом количестве обнаруживают наивные Т-клетки. Такое явление характерно не только для опухолей головного мозга, но и для других видов опухолей, однако это актуально только тогда, когда они растут интракраниально [45, 46]. По сравнению с тканевыми моделями ГБ M2 и ГБ M6, популяции макрофагов в клеточной модели опухоли — мышиной глиоме GL261 — низкие (в среднем 5,6%) [47]. Согласно другим данным [48], эта модель сильно инфильтрирована иммунными клетками. У человека ГБ имеет вариабельность по содержанию иммунных клеток. Экспрессия генов, связанных с иммунным ответом, а также инфильтрация макрофагами, CD3+ и CD8+ Т-клетками увеличивались во время начальной фазы роста ГБ у мышей, а затем уменьшились по мере прогрессирования роста опухоли. Это показывает «коррекцию» и «выключение» иммунного ответа опухолью [49].
Наличие CD3+ Т-клеток в образцах ГБ свидетельствует об иммунном ответе на опухоль. При терапии высвобождаются неоантигены опухоли, количество CD3+ клеток значительно увеличивается. Было высказано предположение, что во время рецидива ГБ CD3+ клетки ограничивают реакцию Т-клеток из-за недостатка антигенов. Согласно некоторым данным, наличие внутриопухолевых CD3+ клеток до начала лечения положительно коррелирует с выживаемостью пациента [50], однако в других источниках такая связь не подтверждается [51]. Большинство случаев ГБ у людей демонстрируют низкую инфильтрацию CD3+, что соответствует характерному «холодному» иммунному профилю опухоли. Около 25% ГБ у человека имеют среднюю или высокую инфильтрацию CD3+ [52], аналогичную модели ГБ M6. Следовательно, данная модель может быть использована для разработки иммунотерапии таких пациентов.
По сравнению с клеточными линиями и химически индуцированными первичными опухолями трансплантируемая ткань опухоли обладает большей онкогенностью и демонстрирует более агрессивный рост и быструю поляризацию макрофагов до М2-фенотипа. Большинство иммуносупрессивных цитокинов, ферментов, лигандов контрольных точек, молекул клеточной поверхности и сигнальных путей сверхэкспрессируются в клетках стромы глиомы и макрофагах/микроглии, но не в опухолевых клетках [49]. ГБ M6 и ГБ M2 сильно инфильтрированы ассоциированными с опухолью лимфоцитами и макрофагами. Этот факт требует дальнейшего изучения. Необходимо установить, какова экспрессия генов непосредственно в опухолевых клетках ГБ M2 и ГБ M6, а также в окружающих иммунных клетках.
Мутации в генах Hras, Pten, Pi3k, Mdm2, Tp63, Esr, Pgr и Her2, потеря Cdkn2a,абберации в генах семействаIgf, Akt и активацияMYC обнаружены в моделях опухолей молочной железы, крови и кожи, индуцированных ДМБА [53–55]. Кроме того, эти опухоли характеризуются активацией Egfr и Мki-67, p53-дикого типа, низкими уровнями мРНК и белков CDKN1A и PTEN, а также снижением экспрессии и активности фермента IDH1/2, одного из основных маркеров глиом [56].
Глиобластома человека практически всегда относится к IDH-дикому типу. Почти в 57% случаев она характеризуется активирующими изменениями в гене EGFR и более чем в 70–80% случаев — в промоторе TERT. Активацию EGFR редко наблюдают при гигантоклеточной ГБ и глиосаркоме. Мы показали, что ГБ M2 состоит из значительного количества гигантских клеток и характеризуется неизменной экспрессией Egfr. По сравнению с ГБ, IDH-мутантные астроцитомы часто характеризуются диким типом генов EGFR и PTEN, а также метилированием промотора MGMT. В клетках этих астроцитом наблюдают мутации в генах TP53, ATRX, а также в промоторе гена TERT [57, 58]. Расхождения между статусом метилирования промотора MGMT и реакцией на лечение у некоторых пациентов могут быть вызваны несоответствием между метилированием MGMT и уровнями экспрессии MGMT в ГБ [59].
Клетки агрессивных опухолей, особенно низкодифференцированных [60, 61], активируют экзоцитоз с помощью P-гликопротеина (P-gp) [62], который экспрессируется на плазматической мембране эндотелиальных клеток гематоэнцефалического барьера. Согласно ряду исследований [63, 64], избыточная экспрессия ABCB1 коррелирует с низкой выживаемостью у пациентов с ГБ. Другие данные указывают на корреляцию с более длительной выживаемостью у пациентов с высокой экспрессией гена ABCB1, однако его прогностическая значимость не определена [65]. При опухолях поджелудочной железы и почек высокая экспрессия ABCB1 является благоприятным прогностическим фактором. В клетках ГБ M2 и ГБ M6 отмечена повышенная экспрессия Abcb1. Возможно, повышенная экспрессия P-gp вызвана длительным воздействием канцерогена ДМБА на клетки с целью его активного транспорта из нее [66]. Экспрессия P-gp регулируется рядом сигнальных путей, включая PI3K/Akt. По нашим данным, Pi3k сверхэкспрессируется в ГБ М2. Изменения в этом гене обнаружены у 17% людей с ГБ [67]. Нарушение регуляции PI3K превращает опухоли в более агрессивные и рецидивирующие заболевания, и это подтверждено клинически и морфологически: злокачественная морфология и быстрый рост в ГБ M2 относительно выше, чем в ГБ M6, которая относится к дикому типу Pi3k.
Уровни экспрессии гена Tp53, кодирующего белок p53 (опухолевый супрессор и фактор транскрипции, который регулирует экспрессию P-gp и клеточный цикл), повышены в ГБ M2 по сравнению с интактным головным мозгом и, наоборот, снижены в ГБ M6. Низкая экспрессия гена-супрессора опухоли Tp53 и повышенная экспрессия онкогена Pi3k в ГБ M6 могут быть связаны с выраженным повышением экспрессии Hif1a, Vegfa, Gdnf и Egfr. Потеря функции р53 способствует онкогенезу при нескольких опухолях ЦНС, включая ГБ (25–37%). При гигантоклеточном типе ГБ чаще встречаются инактивирующие мутации в TP53, в то время как Tp53 сверхэкспрессирован при ГБ M2 с морфологией гигантских клеток. Инактивирующие мутации в TP53 также обнаруживаются более чем в 50% случаев IDH1/2-мутантной астроцитомы и крупноклеточной медуллобластомы. H3K27M-мутантные диффузные срединные глиомы человека, по сравнению с ГБ, характеризуются высокой частотой мутаций IDH1/2, TP53,амплификацией PDGFRA. Ген ATRX при этом дикого типа, а мутации в промоторе TERT и амплификация EGFR встречаются редко [51].
Мутации в гене TP53 приводят к изменению его структуры и функции, а также развитию различных типов опухолей [68]. Таким образом, миссенс-мутации в TP53 характерны для глиом с аберрациями IDH1/2. Ген опухолевого супрессора, регулятора клеточного цикла, активатора p53 и фактора транскрипции — Cdkn2a — сверхэкспрессирован в M2 ГБ и M6 ГБ. Однако, в отличие от наших результатов, ГБ и астроцитома человека 4-й степени злокачественности (по классификации ВОЗ) характеризуются наличием гомозиготных делеций CDKN2A, что коррелирует с высокой пролиферативной активностью опухолевых клеток и плохим прогнозом [69]. Сообщалось, что, когда неопухолевые клетки мыши подвергаются воздействию канцерогенов, уровень опухолевого супрессора р53 повышается [70]. Прионоподобная агрегация р53 снижает его экспрессию и может быть связана с онкогенезом. Предполагают, что мутантный белок p53 также обладает прионоподобными свойствами, сворачиваясь в крупные агрегаты, олигомеры и амилоидоподобные волокна, которые объединяются с белком дикого типа и теряют свою функцию подавления опухоли [71, 72]. Низкие уровни р53 способствуют образованию и пролиферации стволовых клеток, тогда как более высокие уровни и активность р53 — дифференцировке стволовых клеток [73]. Несмотря на это, экспрессия гена Sox2 была высокой в ГБ М2 и ГБ М6. Опухоль ГБ M6 может быть более дифференцированной, чем опухоль ГБ M2. Кроме того, показано, что взаимодействие p53 с митохондриальным PPIF (пептидилпролил изомеразой F) вызывает гибель клеток в результате некроза [74]. Это подтверждают наши морфологические исследования: в ГБ M2 некроз более выражен и обширен, чем в ГБ M6.
В тканях ГБ M2 и ГБ M6 повышена экспрессия гена Sox2, фактора транскрипции стволовых клеток и маркера недифференцированных клеток. Сверхэкспрессия его ортолога у человека характерна для различных типов низкодифференцированных опухолей, включая ГБ [75]. Показано, что SOX2 активирует миграцию клеток и устойчивость к химиотерапии [76]. Подавление SOX2 также приводит к инвазии опухоли и резистентности к лечению. SOX2 высоко экспрессируется в нейроэпителии развивающейся ЦНС и, как было показано, функционирует в нервных стволовых клетках [77]. Роль SOX2 в прогрессии опухоли зависит от контекста. ГБ и глиомы низкой степени злокачественности, подобно нервным стволовым клеткам, имеют доступ к кластеру энхансеров SOX2, а также уникальный паттерн хроматина, что объясняет высокий уровень пролиферации опухолевых клеток [78].
Онкосупрессор опухоли Pten сверхэкспрессирован в моделях M2 ГБ и M6 ГБ. Более половины случаев ГБ у взрослых и 100% случаев синдрома Каудена при опухолях головного мозга у детей характеризуются дефицитом PTEN. Отмечено, что избыточная экспрессия PTEN снижает выживаемость клеток глиомы человека, активирует апоптоз, нарушает функцию митохондрий и усиливает эффект химиотерапии. По другим данным [79–85], избыточная экспрессия PTEN повышает подвижность и дедифференцировку клеток опухоли. Это подтверждается повышенной экспрессией Cd44 и Sox2 в модели ГБ M6 мыши.
Считается, что избыточная экспрессия опухолевых супрессоров в клетках опухоли направлена на подавление их роста, в результате чего клетки возвращаются в более дифференцированное состояние и имеют тенденцию к самоуничтожению [66]. Несмотря на то, что основные механизмы, определяющие канцерогенез, связаны с подавлением экспрессии онкосупрессоров опухолей и активацией онкогенов, показано, что избыточная экспрессия опухолевых супрессоров может вызывать прогрессирование различных типов опухолей, включая колоректальные, молочных желез, яичников, головы и шеи, а также лимфом. При этом снижается выживаемость [82, 83], и эти гены можно считать онкогенами.
PTEN подавляет сигнальный каскад PI3K/AKT/mTOR, который способствует росту опухолевых клеток, однако в ГБ M2 и ГБ M6 мы наблюдали активацию Pi3k при сверхэкспрессии Pten. При меланоме PTEN часто мутирует с потерей белка, это коррелирует со снижением инфильтрации опухолевых Т-клеток, резистентностью к таргетной терапии и иммунотерапии, поэтому ингибирование PI3K может быть эффективным [84]. Однако в нашем исследовании ген Pten вГБ M2 и ГБ M6 был сверхэкспрессирован, и инфильтрация опухоли Т-клетками оказалась выраженной.
Уровни экспрессии гена Mki67, который кодирует ядерный белок Ki-67, связанный с клеточной пролиферацией, были повышены в клетках ГБ M2 и ГБ M6, что коррелирует с выраженной митотической активностью опухолевых клеток. Метилирование промотора MGMT ингибирует экспрессию генов, кодирующих фермент репарации ДНК. Это прогностически важно при лечении ГБ алкилирующими препаратами [57]. В моделях ГБ M2 и ГБ M6 экспрессия Mgmt не изменялась, это указывает на возможный низкий терапевтический эффект алкилирующих цитостатиков. Таким образом, модели ГБ мышей могут быть использованы для изучения проблемы устойчивости к алкилирующим агентам и разработки эффективных противоопухолевых методов лечения.
VEGFА и HIF1α сверхэкспрессируются во многих типах опухолей, как и их ортологи в моделях ГБ M2 и ГБ M6 мыши. VEGFА — фактор роста, который может как стимулировать, так и подавлять ангиогенез. Он является ключевым регулятором пролиферации эндотелиальных клеток, проницаемости сосудов и воспаления в зависимости от контекста [85]. Hif1α используют для прогнозирования реакции опухоли на терапию. Рецепторы многих факторов роста обычно конститутивно активны в опухолях и остаются активными, даже если уровни самого фактора являются базовыми или находятся на низком уровне. Повышенная экспрессия или активация мембранных рецепторов факторов роста или их тирозинкиназных каскадов в опухолях рассматриваются как основные регуляторы роста опухоли. Предполагается, что клетки опухоли таким образом восстанавливают нарушенную регуляцию, чтобы дифференцироваться или погибнуть [66].
Белок GDNF является нейротрофическим фактором дофаминергических нейронов, его ген ортолог сверхэкспрессирован в ГБ M6. GDNF кодирует лиганд TGF-β, участвующий в активации фактора транскрипции SMAD, регулятора клеточного цикла [86]. Белок CD133 является маркером пролиферирующих опухолевых стволовых клеток в различных солидных опухолях. Его экспрессия значительно повышена в модели ГБ M2. В работе [87] указывается, что большое количество CD133+ клеток в опухоли коррелируют с резистентностью к химиотерапии и лучевой терапии и низкой выживаемостью. Однако дифференцированные клетки также могут экспрессировать CD133+, а CD133-негативные клетки — инициировать развитие опухоли [88].
Уровень Pdgfra повышен в ГБ М2. Активация PDGFRA способствует фосфорилированию PIK3R1, что приводит к мобилизации Ca2+ в цитозоле, активации протеинкиназы C, AKT1, HRAS/MAPK/ERK и сигнальных путей STAT [89].
Белок S100B является нейротрофическим фактором и одним из наиболее распространенных растворимых белков в головном мозге [90], его ген-ортолог сверхэкспрессирован в ГБ M2 и ГБ M6. S100B способствует астроцитозу и росту аксонов, слабо связывается с Ca2+, но сильно — с Zn2+. Высокий уровень S100B в сыворотке крови у пациентов с глиомой является прогностическим маркером. Семейство белков S100 регулирует стволовые клетки глиомы и опосредует эпителиально-мезенхимальный переход при ГБ [91].
Все изученные нами гены кодируют различные изоформы белков. Альтернативный сплайсинг генов и использование альтернативных промоторов приводят к увеличению числа вариантов транскриптов и изоформ [92, 93]. На активность генов влияют эпигенетические изменения и посттрансляционные модификации. Даже при относительно высокой экспрессии мРНК в опухолевых клетках из-за посттранскрипционной репрессии уровни белка могут не изменяться [94, 95]. В связи с этим будущие исследования должны выявить состав белков, кодируемых изученными нами генами.
Таким образом, канцероген ДМБА индуцирует изменения в тканях головного мозга; инициирует онкогенез посредством образования аддуктов ДНК и регулирования генов, которые связанны с ангиогенезом, пролиферацией, инвазией, развитием и дифференцировкой тканей, факторами транскрипции и онкогенеза, апоптозом, репликацией и репарацией ДНК, цитоскелетом, метаболизмом и межклеточными взаимодействиями [96]. Это способствует нестабильности генома и прогрессированию опухоли. Последовательная трансплантация ассоциированных с опухолью макрофагов, других факторов микросреды и клеток опухолевой ткани, индуцированной ДМБА, может менять генетический ландшафт опухоли и способствовать злокачественному прогрессированию. Согласно профилям экспрессии генов, исследованным в ГБ M2 и ГБ M6, онкосупрессоры опухолей Pten, Cdkn2a и Tp53 в ГБ M2 чрезмерно активированы. Изменения в экспрессии генов и, как следствие, развитие опухоли, свидетельствуют о том, что компенсаторная реакция клеток, подвергшихся воздействию канцерогена ДМБА, была безуспешной. Эта компенсаторная реакция направлена на восстановление целостности ДНК, подавление неблагоприятного воздействия канцерогена и пролиферации клеток, удаление канцерогена и гибель аномальных опухолевых клеток. Начальные стадии химически индуцированного онкогенеза, вызванного ДМБА, характеризуются непролиферативными изменениями, воспалением и феноменом образования капсулы [97], который связан с защитной реакцией организма на изоляцию канцерогена. Опухолевые клетки — это клетки организма с нарушенной саморегуляцией; они обладают теми же остатками геномной регуляции, что и здоровые клетки. Большинство генов, измененных в опухолях, могут быть адаптивным ответом на канцерогенез и попыткой устранить дефекты в репликации ДНК [66].
Применение моделей интрацеребральных тканей, таких как ГБ M2 и ГБ M6, у иммунокомпетентных мышей позволит нам получить новые данные о канцерогенезе, диагностике и терапии опухолей. Эти модели из нашей коллекции наряду с тканевой трансплантируемой ГБ 101.8 крысы играют ключевую роль в разработке диагностических инструментов [98–100], терапевтических стратегий [101] и понимании канцерогенеза [102, 103].
Ограничения данной работы связаны с небольшими выборками.
Заключение
Экспериментальные модели тканей ГБ M2 и ГБ M6 имитируют онкогенез у человека согласно клиническим данным об этом заболевании (кахексия, метаболические нарушения, ассоциированная с опухолью коагулопатия) и морфологии (инвазивный агрессивный рост, ядерный и клеточный полиморфизм, высокая митотическая активность, выраженная васкуляризация и некроз). Выраженная инфильтрация опухолей иммунными клетками, на долю которых приходится 50% всех опухолевых тканей, и измененная экспрессия генов, участвующих в онкогенезе, делают ГБ M2 и ГБ M6 подходящими моделями для дальнейших исследований канцерогенеза и противоопухолевой терапии.
Мы выявили повышенную экспрессию следующих генов в тканях ГБ М2 и ГБ М6: онкосупрессоров — Cdkn2a и Pten; клеточного транспортера — Abcb1; маркера пролиферации — Mki67; факторов транскрипции — Hif1a, Sox2; нейротрофического фактора — S100b и фактора ангиогенеза — Vegfa. В тканях ГБ M6 мы обнаружили повышенную экспрессию гена рецептора фактора роста — Pdgfra, фактора дифференцировки — Cd133 и онкосупрессора — Tp53. В то же время у ГБ M2 отмечали повышенную экспрессию фактора ангиогенеза и дифференцировки — Pi3k; гена белка, ассоциированного с астроглией и глиомами — Gfap; фактора роста — Gdnf. Кроме того, уровень экспрессии мРНК генов: белка клеточной адгезии (Cd44), пролиферации (Pi3k, Hif1a, Gdnf) и Egfr — различался для ГБ M2 и ГБ M6 и был выше в ГБ M6, чем в ГБ M2. При этом в ГБ М6 по сравнению с ГБ M2 наблюдали более низкую экспрессию генов дифференцировки, пролиферации и апоптоза — Cdkn2a, Tp53 и Cd133, а также рецептора фактора роста — Pdgfra.
Полученные нами тканевые модели ГБ M2 и ГБ M6 имеют сходные с человеческими внутриопухолевые иммунные реакции, клинические и морфологические признаки, а также некоторые паттерны экспрессии генов, которые важны для дальнейших исследований онкогенеза. Эти модели могут быть использованы для разработки диагностических и терапевтических методов и изучения канцерогенеза.
Финансирование. Работа выполнена при поддержке Министерства образования и науки Российской Федерации в рамках государственного задания №123030700107-4.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
- Wu W., Klockow J.L., Zhang M., Lafortune F., Chang E., Jin L., Wu Y., Daldrup-Link H.E. Glioblastoma multiforme (GBM): an overview of current therapies and mechanisms of resistance. Pharmacol Res 2021; 171: 105780, https://doi.org/10.1016/j.phrs.2021.105780.
- Background lesions in laboratory animals. A color atlas. McInnes E.F., Mann P. (editors). Elsevier Ltd.; 2011, https://doi.org/10.1016/C2009-0-41283-2.
- Lampreht Tratar U., Horvat S., Cemazar M. Transgenic mouse models in cancer research. Front Oncol 2018; 8: 268, https://doi.org/10.3389/fonc.2018.00268.
- Ireson C.R., Alavijeh M.S., Palmer A.M., Fowler E.R., Jones H.J. The role of mouse tumour models in the discovery and development of anticancer drugs. Br J Cancer 2019; 121(2): 101–108, https://doi.org/10.1038/s41416-019-0495-5.
- Sahu U., Barth R.F., Otani Y., McCormack R., Kaur B. Rat and mouse brain tumor models for experimental neuro-oncology research. J Neuropathol Exp Neurol 2022; 81(5): 312–329, https://doi.org/10.1093/jnen/nlac021.
- Haddad A.F., Young J.S., Amara D., Berger M.S., Raleigh D.R., Aghi M.K., Butowski N.A. Mouse models of glioblastoma for the evaluation of novel therapeutic strategies. Neurooncol Adv 2021; 3(1): vdab100, https://doi.org/10.1093/noajnl/vdab100.
- Lowenstein P.R., Castro M.G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther 2009; 9(5): 368–374, https://doi.org/10.2174/156652309789753392.
- Fogel D.B. Factors associated with clinical trials that fail and opportunities for improving the likelihood of success: a review. Contemp Clin Trials Commun 2018; 11: 156–164, https://doi.org/10.1016/j.conctc.2018.08.001.
- Mirzayans R., Murray D. What are the reasons for continuing failures in cancer therapy? Are misleading/inappropriate preclinical assays to be blamed? Might some modern therapies cause more harm than benefit? Int J Mol Sci 2022; 23(21): 13217, https://doi.org/10.3390/ijms232113217.
- Arutyunyan I.V., Soboleva A.G., Kovtunov E.A., Kosyreva A.M., Kudelkina V.V., Alekseeva A.I., Elchaninov A.V., Jumaniyazova E.D., Goldshtein D.V., Bolshakova G.B., Fatkhudinov T.K. Gene expression profile of 3D spheroids in comparison with 2D cell cultures and tissue strains of diffuse high-grade gliomas. Bull Exp Biol Med 2023; 175(4): 576–584, https://doi.org/10.1007/s10517-023-05906-y.
- Alekseeva A., Drozd S., Nikitin P., Postnov A., Lipengolts A., Skribitsky V., Finogenova Y., Shpakova K., Khalansky A., Pronin I., Pavlova G. Comparative morphological and molecular genetic characteristics of experimental glioblastoma 101/8 and C6. In: Neuroscience for medicine and psychology. Sudak; 2023; p. 34–35, https://doi.org/10.29003/m3154.sudak.ns2023-19/34-35.
- Paster E.V., Villines K.A., Hickman D.L. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comp Med 2009; 59(3): 234–241.
- Федосеева В.В., Халанский А.С., Мхитаров В.А., Цветков И.С., Малиновская Ю.А., Максименко О.О., Гельперина С.Э., Балабаньян В.Ю., Разживина В.А., Гореликов П.Л., Михайлова Л.П., Макарова О.В. Противоопухолевая активность доксорубицина в составе поли(лактид-ко-гликолидных) наночастиц при экспериментальной глиобластоме. Клиническая и экспериментальная морфология 2017; 2(22): 65–71.
- Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 2001; 29(9): e45, https://doi.org/10.1093/nar/29.9.e45.
- Vandesompele J., De Preter K., Pattyn F., Poppe B., Van Roy N., De Paepe A., Speleman F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 2002; 3(7): RESEARCH0034, https://doi.org/10.1186/gb-2002-3-7-research0034.
- Inoue A., Ohnishi T., Nishikawa M., Watanabe H., Kusakabe K., Taniwaki M., Yano H., Ohtsuka Y., Matsumoto S., Suehiro S., Yamashita D., Shigekawa S., Takahashi H., Kitazawa R., Tanaka J., Kunieda T. Identification of CD44 as a reliable biomarker for glioblastoma invasion: based on magnetic resonance imaging and spectroscopic analysis of 5-aminolevulinic acid fluorescence. Biomedicines 2023; 11(9): 2369, https://doi.org/10.3390/biomedicines11092369.
- Wang L.J., Lv P., Lou Y. Alarm signal S100-related signature is correlated with tumor microenvironment and predicts prognosis in glioma. Dis Markers 2022; 2022: 4968555, https://doi.org/10.1155/2022/4968555.
- Yuan Q., Zuo F.X., Cai H.Q., Qian H.P., Wan J.H. Identifying differential expression genes and prognostic signature based on subventricular zone involved glioblastoma. Front Genet 2022; 13: 912227, https://doi.org/10.3389/fgene.2022.912227.
- Luo X., Xu S., Zhong Y., Tu T., Xu Y., Li X., Wang B., Yang F. High gene expression levels of VEGFA and CXCL8 in the peritumoral brain zone are associated with the recurrence of glioblastoma: a bioinformatics analysis. Oncol Lett 2019; 18(6): 6171–6179, https://doi.org/10.3892/ol.2019.10988.
- Liu W., Lv G., Li Y., Li L., Wang B. Downregulation of CDKN2A and suppression of cyclin D1 gene expressions in malignant gliomas. J Exp Clin Cancer Res 2011; 30(1): 76, https://doi.org/10.1186/1756-9966-30-76.
- Shiraishi S., Tada K., Nakamura H., Makino K., Kochi M., Saya H., Kuratsu J., Ushio Y. Influence of p53 mutations on prognosis of patients with glioblastoma. Cancer 2002; 95(2): 249–257, https://doi.org/10.1002/cncr.10677.
- Dahlrot R.H., Bangsø J.A., Petersen J.K., Rosager A.M., Sørensen M.D., Reifenberger G., Hansen S., Kristensen B.W. Prognostic role of Ki-67 in glioblastomas excluding contribution from non-neoplastic cells. Sci Rep 2021; 11(1): 17918, https://doi.org/10.1038/s41598-021-95958-9.
- Hashemi M., Etemad S., Rezaei S., Ziaolhagh S., Rajabi R., Rahmanian P., Abdi S., Koohpar Z.K., Rafiei R., Raei B., Ahmadi F., Salimimoghadam S., Aref A.R., Zandieh M.A., Entezari M., Taheriazam A., Hushmandi K. Progress in targeting PTEN/PI3K/Akt axis in glioblastoma therapy: revisiting molecular interactions. Biomed Pharmacother 2023; 158: 114204, https://doi.org/10.1016/j.biopha.2022.114204.
- Sfifou F., Hakkou E.M., Bouaiti E.A., Slaoui M., Errihani H., Al Bouzidi A., Abouqal R., El Ouahabi A., Cherradi N. Correlation of immunohistochemical expression of HIF-1alpha and IDH1 with clinicopathological and therapeutic data of moroccan glioblastoma and survival analysis. Ann Med Surg (Lond) 2021; 69: 102731, https://doi.org/10.1016/j.amsu.2021.102731.
- Yu W., Ren X., Hu C., Tan Y., Shui Y., Chen Z., Zhang L., Peng J., Wei Q. Glioma SOX2 expression decreased after adjuvant therapy. BMC Cancer 2019; 19(1): 1087, https://doi.org/10.1186/s12885-019-6292-y.
- Abdoli Shadbad M., Nejadi Orang F., Baradaran B. CD133 significance in glioblastoma development: in silico and in vitro study. Eur J Med Res 2024; 29(1): 154, https://doi.org/10.1186/s40001-024-01754-2.
- Farsi Z., Allahyari Fard N. The identification of key genes and pathways in glioblastoma by bioinformatics analysis. Mol Cell Oncol 2023; 10(1): 2246657, https://doi.org/10.1080/23723556.2023.2246657.
- Yu Z., Li H., Wang M., Luo W., Xue Y. GDNF regulates lipid metabolism and glioma growth through RET/ERK/HIF-1/SREBP-1. Int J Oncol 2022; 61(3): 109, https://doi.org/10.3892/ijo.2022.5399.
- Szylberg M., Sokal P., Śledzińska P., Bebyn M., Krajewski S., Szylberg Ł., Szylberg A., Szylberg T., Krystkiewicz K., Birski M., Harat M., Włodarski R., Furtak J. MGMT promoter methylation as a prognostic factor in primary glioblastoma: a single-institution observational study. Biomedicines 2022, https://doi.org/10.3390/biomedicines10082030.
- Roy L.O., Lemelin M., Blanchette M., Poirier M.B., Aldakhil S., Fortin D. Expression of ABCB1, ABCC1 and 3 and ABCG2 in glioblastoma and their relevance in relation to clinical survival surrogates. J Neurooncol 2022; 160(3): 601–609, https://doi.org/10.1007/s11060-022-04179-1.
- Ahmadipour Y., Gembruch O., Pierscianek D., Sure U., Jabbarli R. Does the expression of glial fibrillary acid protein (GFAP) stain in glioblastoma tissue have a prognostic impact on survival? Neurochirurgie 2020; 66(3): 150–154, https://doi.org/10.1016/j.neuchi.2019.12.012.
- Dhawan A., Manem V.S.K., Yeaney G., Lathia J.D., Ahluwalia M.S. EGFR pathway expression persists in recurrent glioblastoma independent of amplification status. Cancers (Basel) 2023; 15(3): 670, https://doi.org/10.3390/cancers15030670.
- Goldman O., Adler L.N., Hajaj E., Croese T., Darzi N., Galai S., Tishler H., Ariav Y., Lavie D., Fellus-Alyagor L., Oren R., Kuznetsov Y., David E., Jaschek R., Stossel C., Singer O., Malitsky S., Barak R., Seger R., Erez N., Amit I., Tanay A., Saada A., Golan T., Rubinek T., Sang Lee J., Ben-Shachar S., Wolf I., Erez A. Early Infiltration of innate immune cells to the liver depletes HNF4α and promotes extrahepatic carcinogenesis. Cancer Discov 2023; 13(7): 1616–1635, https://doi.org/10.1158/2159-8290.CD-22-1062.
- Law M.L. Cancer cachexia: pathophysiology and association with cancer-related pain. Front Pain Res (Lausanne) 2022; 3: 971295, https://doi.org/10.3389/fpain.2022.971295.
- Olson B., Diba P., Korzun T., Marks D.L. Neural mechanisms of cancer cachexia. Cancers (Basel) 2021; 13(16): 3990, https://doi.org/10.3390/cancers13163990.
- Zhong W., Jina H., Rathore P., Wong E.L., Mancuso P., Lalak N., Hayden L., Haghighi K. A case report of priapism with unusual presentation and clinical course. Urol Case Rep 2017; 12: 70–72, https://doi.org/10.1016/j.eucr.2017.03.009.
- Shelton L.M., Mukherjee P., Huysentruyt L.C., Urits I., Rosenberg J.A., Seyfried T.N. A novel pre-clinical in vivo mouse model for malignant brain tumor growth and invasion. J Neurooncol 2010; 99(2): 165–176, https://doi.org/10.1007/s11060-010-0115-y.
- Cui P., Shao W., Huang C., Wu C.J., Jiang B., Lin D. Metabolic derangements of skeletal muscle from a murine model of glioma cachexia. Skelet Muscle 2019; 9(1): 3, https://doi.org/10.1186/s13395-018-0188-4.
- Monteiro R.Q., Lima L.G., Gonçalves N.P., De Souza M.R., Leal A.C., Demasi M.A., Sogayar M.C., Carneiro-Lobo T.C. Hypoxia regulates the expression of tissue factor pathway signaling elements in a rat glioma model. Oncol Lett 2016; 12(1): 315–322, https://doi.org/10.3892/ol.2016.4593.
- Onizuka H., Masui K., Komori T. Diffuse gliomas to date and beyond 2016 WHO Classification of Tumours of the central nervous system. Int J Clin Oncol 2020; 25(6): 997–1003, https://doi.org/10.1007/s10147-020-01695-w.
- Himes B.T., Geiger P.A., Ayasoufi K., Bhargav A.G., Brown D.A., Parney I.F. Immunosuppression in glioblastoma: current understanding and therapeutic implications. Front Oncol 2021; 11: 770561, https://doi.org/10.3389/fonc.2021.770561.
- Alghamri M.S., McClellan B.L., Hartlage C.S., Haase S., Faisal S.M., Thalla R., Dabaja A., Banerjee K., Carney S.V., Mujeeb A.A., Olin M.R., Moon J.J., Schwendeman A., Lowenstein P.R., Castro M.G. Targeting neuroinflammation in brain cancer: uncovering mechanisms, pharmacological targets, and neuropharmaceutical developments. Front Pharmacol 2021; 12: 680021, https://doi.org/10.3389/fphar.2021.680021.
- Andersen J.K., Miletic H., Hossain J.A. Tumor-associated macrophages in gliomas-basic insights and treatment opportunities. Cancers (Basel) 2022; 14(5): 1319, https://doi.org/10.3390/cancers14051319.
- Georgieva P.B., Mathivet T., Alt S., Giese W., Riva M., Balcer M., Gerhardt H. Long-lived tumor-associated macrophages in glioma. Neurooncol Adv 2020; 2(1): vdaa127, https://doi.org/10.1093/noajnl/vdaa127.
- Rodrigues L.F., Camacho A.H.D.S., Spohr T.C.L.S.E. Secondary glioblastoma metastasis outside the central nervous system in a young HIV-infected patient. Ther Adv Med Oncol 2020; 12: 1758835920923432, https://doi.org/10.1177/1758835920923432.
- Chongsathidkiet P., Jackson C., Koyama S., Loebel F., Cui X., Farber S.H., Woroniecka K., Elsamadicy A.A., Dechant C.A., Kemeny H.R., Sanchez-Perez L., Cheema T.A., Souders N.C., Herndon J.E., Coumans J.V., Everitt J.I., Nahed B.V., Sampson J.H., Gunn M.D., Martuza R.L., Dranoff G., Curry W.T., Fecci P.E. Sequestration of T cells in bone marrow in the setting of glioblastoma and other intracranial tumors. Nat Med 2018; 24(9): 1459–1468, https://doi.org/10.1038/s41591-018-0135-2.
- Sanchez V.E., Lynes J.P., Walbridge S., Wang X., Edwards N.A., Nwankwo A.K., Sur H.P., Dominah G.A., Obungu A., Adamstein N., Dagur P.K., Maric D., Munasinghe J., Heiss J.D., Nduom E.K. GL261 luciferase-expressing cells elicit an anti-tumor immune response: an evaluation of murine glioma models. Sci Rep 2020; 10(1): 11003, https://doi.org/10.1038/s41598-020-67411-w.
- Brodin P., Davis M.M. Human immune system variation. Nat Rev Immunol 2017; 17(1): 21–29, https://doi.org/10.1038/nri.2016.125.
- Maire C.L., Mohme M., Bockmayr M., Fita K.D., Riecken K., Börnigen D., Alawi M., Failla A., Kolbe K., Zapf S., Holz M., Neumann K., Dührsen L., Lange T., Fehse B., Westphal M., Lamszus K. Glioma escape signature and clonal development under immune pressure. J Clin Invest 2020; 130(10): 5257–5271, https://doi.org/10.1172/JCI138760.
- Brown C.E., Hibbard J.C., Alizadeh D., Blanchard M.S., Natri H.M., Wang D., Ostberg J.R., Aguilar B., Wagner J.R., Paul J.A., Starr R., Wong R.A., Chen W., Shulkin N., Aftabizadeh M., Filippov A., Chaudhry A., Ressler J.A., Kilpatrick J., Myers-McNamara P., Chen M., Wang L.D., Rockne R.C., Georges J., Portnow J., Barish M.E., D’Apuzzo M., Banovich N.E., Forman S.J., Badie B. Locoregional delivery of IL-13Rα2-targeting CAR-T cells in recurrent high-grade glioma: a phase 1 trial. Nat Med 2024; 30(4): 1001–1012, https://doi.org/10.1038/s41591-024-02875-1.
- Sobhani N., Bouchè V., Aldegheri G., Rocca A., D’Angelo A., Giudici F., Bottin C., Donofrio C.A., Pinamonti M., Ferrari B., Panni S., Cominetti M., Aliaga J., Ungari M., Fioravanti A., Zanconati F., Generali D. Analysis of PD-L1 and CD3 expression in glioblastoma patients and correlation with outcome: a single center report. Biomedicines 2023; 11(2): 311, https://doi.org/10.3390/biomedicines11020311.
- Musca B., Russo M.G., Tushe A., Magri S., Battaggia G., Pinton L., Bonaudo C., Della Puppa A., Mandruzzato S. The immune cell landscape of glioblastoma patients highlights a myeloid-enriched and immune suppressed microenvironment compared to metastatic brain tumors. Front Immunol 2023; 14: 1236824, https://doi.org/10.3389/fimmu.2023.1236824.
- Nasti T.H., Cochran J.B., Tsuruta Y., Yusuf N., McKay K.M., Athar M., Timares L., Elmets C.A. A murine model for the development of melanocytic nevi and their progression to melanoma. Mol Carcinog 2016; 55(5): 646–658, https://doi.org/10.1002/mc.22310.
- Todorova V.K., Kaufmann Y., Luo S., Klimberg V.S. Modulation of p53 and c-myc in DMBA-induced mammary tumors by oral glutamine. Nutr Cancer 2006; 54(2): 263–273, https://doi.org/10.1207/s15327914nc5402_13.
- Fidianingsih I., Aryandono T., Widyarini S., Herwiyanti S. Profile of histopathological type and molecular subtypes of mammary cancer of DMBA-induced rat and its relevancy to human breast cancer. J Med Sci 2022; 10(A): 71–78, https://doi.org/10.3889/oamjms.2022.7975.
- Robbins D., Wittwer J.A., Codarin S., Circu M.L., Aw T.Y., Huang T.T., Van Remmen H., Richardson A., Wang D.B., Witt S.N., Klein R.L., Zhao Y. Isocitrate dehydrogenase 1 is downregulated during early skin tumorigenesis which can be inhibited by overexpression of manganese superoxide dismutase. Cancer Sci 2012; 103(8): 1429–1433, https://doi.org/10.1111/j.1349-7006.2012.02317.x.
- Evidence based practice in neuro-oncology. Mallick S., Giridhar P., Rath G.K. (editors). Springer Singapore; 2021, https://doi.org/10.1007/978-981-16-2659-3.
- Marker D.F., Agnihotri S., Amankulor N., Murdoch G.H., Pearce T.M. The dominant TP53 hotspot mutation in IDH -mutant astrocytoma, R273C, has distinctive pathologic features and sex-specific prognostic implications. Neurooncol Adv 2021; 4(1): vdab182, https://doi.org/10.1093/noajnl/vdab182.
- Butler M., Pongor L., Su Y.T., Xi L., Raffeld M., Quezado M., Trepel J., Aldape K., Pommier Y., Wu J. MGMT status as a clinical biomarker in glioblastoma. Trends Cancer 2020; 6(5): 380–391, https://doi.org/10.1016/j.trecan.2020.02.010.
- Ohtsuki S., Kamoi M., Watanabe Y., Suzuki H., Hori S., Terasaki T. Correlation of induction of ATP binding cassette transporter A5 (ABCA5) and ABCB1 mRNAs with differentiation state of human colon tumor. Biol Pharm Bull 2007; 30(6): 1144–1146, https://doi.org/10.1248/bpb.30.1144.
- Oda Y., Saito T., Tateishi N., Ohishi Y., Tamiya S., Yamamoto H., Yokoyama R., Uchiumi T., Iwamoto Y., Kuwano M., Tsuneyoshi M. ATP-binding cassette superfamily transporter gene expression in human soft tissue sarcomas. Int J Cancer 2005; 114(6): 854–862, https://doi.org/10.1002/ijc.20589.
- Ahmed S., Khan H., Aschner M., Mirzae H., Küpeli Akkol E., Capasso R. Anticancer potential of furanocoumarins: mechanistic and therapeutic aspects. Int J Mol Sci 2020; 21(16): 5622, https://doi.org/10.3390/ijms21165622.
- Robey R.W., Massey P.R., Amiri-Kordestani L., Bates S.E. ABC transporters: unvalidated therapeutic targets in cancer and the CNS. Anticancer Agents Med Chem 2010; 10(8): 625–633, https://doi.org/10.2174/187152010794473957.
- Amiri-Kordestani L., Basseville A., Kurdziel K., Fojo A.T., Bates S.E. Targeting MDR in breast and lung cancer: discriminating its potential importance from the failure of drug resistance reversal studies. Drug Resist Updat 2012; 15(1-2): 50–61, https://doi.org/10.1016/j.drup.2012.02.002.
- Uhlén M., Fagerberg L., Hallström B.M., Lindskog C., Oksvold P., Mardinoglu A., Sivertsson Å., Kampf C., Sjöstedt E., Asplund A., Olsson I., Edlund K., Lundberg E., Navani S., Szigyarto C.A., Odeberg J., Djureinovic D., Takanen J.O., Hober S., Alm T., Edqvist P.H., Berling H., Tegel H., Mulder J., Rockberg J., Nilsson P., Schwenk J.M., Hamsten M., von Feilitzen K., Forsberg M., Persson L., Johansson F., Zwahlen M., von Heijne G., Nielsen J., Pontén F. Tissue-based map of the human proteome. Science 2015; 347(6220): 1260419, https://doi.org/10.1126/science.1260419.
- Suba Z. Rosetta stone for cancer cure: comparison of the anticancer capacity of endogenous estrogens, synthetic estrogens and antiestrogens. Oncol Rev 2023; 17: 10708, https://doi.org/10.3389/or.2023.10708.
- Padovan M., Maccari M., Bosio A., De Toni C., Vizzaccaro S., Cestonaro I., Corrà M., Caccese M., Cerretti G., Zagonel V., Lombardi G. Actionable molecular alterations in newly diagnosed and recurrent IDH1/2 wild-type glioblastoma patients and therapeutic implications: a large mono-institutional experience using extensive next-generation sequencing analysis. Eur J Cancer 2023; 191: 112959, https://doi.org/10.1016/j.ejca.2023.112959.
- Huszno J., Grzybowska E. TP53 mutations and SNPs as prognostic and predictive factors in patients with breast cancer. Oncol Lett 2018; 16(1): 34–40, https://doi.org/10.3892/ol.2018.8627.
- Robertson L.B., Armstrong G.N., Olver B.D., Lloyd A.L., Shete S., Lau C., Claus E.B., Barnholtz-Sloan J., Lai R., Il’yasova D., Schildkraut J., Bernstein J.L., Olson S.H., Jenkins R.B., Yang P., Rynearson A.L., Wrensch M., McCoy L., Wienkce J.K., McCarthy B., Davis F., Vick N.A., Johansen C., Bødtcher H., Sadetzki S., Bruchim R.B., Yechezkel G.H., Andersson U., Melin B.S., Bondy M.L., Houlston R.S. Survey of familial glioma and role of germline p16INK4A/p14ARF and p53 mutation. Fam Cancer 2010; 9(3): 413–421, https://doi.org/10.1007/s10689-010-9346-5.
- Maltzman W., Czyzyk L. UV irradiation stimulates levels of p53 cellular tumor antigen in nontransformed mouse cells. Mol Cell Biol 1984; 4(9): 1689–1694, https://doi.org/10.1128/mcb.4.9.1689-1694.1984.
- Park S.K., Park S., Pentek C., Liebman S.W. Tumor suppressor protein p53 expressed in yeast can remain diffuse, form a prion, or form unstable liquid-like droplets. iScience 2020; 24(1): 102000, https://doi.org/10.1016/j.isci.2020.102000.
- Navalkar A., Ghosh S., Pandey S., Paul A., Datta D., Maji S.K. Prion-like p53 amyloids in cancer. Biochemistry 2020; 59(2): 146–155, https://doi.org/10.1021/acs.biochem.9b00796.
- Levine A.J., Puzio-Kuter A.M., Chan C.S., Hainaut P. The role of the p53 protein in stem-cell biology and epigenetic regulation. Cold Spring Harb Perspect Med 2016; 6(9): a026153, https://doi.org/10.1101/cshperspect.a026153.
- Hill K.A., Sommer S.S. p53 as a mutagen test in breast cancer. Environ Mol Mutagen 2002; 39(2–3): 216–227, https://doi.org/10.1002/em.10065.
- Mirzaei S., Paskeh M.D.A., Entezari M., Mirmazloomi S.R., Hassanpoor A., Aboutalebi M., Rezaei S., Hejazi E.S., Kakavand A., Heidari H., Salimimoghadam S., Taheriazam A., Hashemi M., Samarghandian S. SOX2 function in cancers: association with growth, invasion, stemness and therapy response. Biomed Pharmacother 2022; 156: 113860, https://doi.org/10.1016/j.biopha.2022.113860.
- Zhu Y., Huang S., Chen S., Chen J., Wang Z., Wang Y., Zheng H. SOX2 promotes chemoresistance, cancer stem cells properties, and epithelial-mesenchymal transition by β-catenin and Beclin1/autophagy signaling in colorectal cancer. Cell Death Dis 2021; 12(5): 449, https://doi.org/10.1038/s41419-021-03733-5.
- Zhang S., Xiong X., Sun Y. Functional characterization of SOX2 as an anticancer target. Signal Transduct Target Ther 2020; 5(1): 135, https://doi.org/10.1038/s41392-020-00242-3.
- Abatti L.E., Lado-Fernández P., Huynh L., Collado M., Hoffman M.M., Mitchell J.A. Epigenetic reprogramming of a distal developmental enhancer cluster drives SOX2 overexpression in breast and lung adenocarcinoma. Nucleic Acids Res 2023; 51(19): 10109–10131, https://doi.org/10.1093/nar/gkad734.
- Bao L., Li X., Lin Z. PTEN overexpression promotes glioblastoma death through triggering mitochondrial division and inactivating the Akt pathway. J Recept Signal Transduct Res 2019; 39(3): 215–225, https://doi.org/10.1080/10799893.2019.1655051.
- Yokoi A., Minami M., Hashimura M., Oguri Y., Matsumoto T., Hasegawa Y., Nakagawa M., Ishibashi Y., Ito T., Ohhigata K., Harada Y., Fukagawa N., Saegusa M. PTEN overexpression and nuclear β-catenin stabilization promote morular differentiation through induction of epithelial-mesenchymal transition and cancer stem cell-like properties in endometrial carcinoma. Cell Commun Signal 2022; 20(1): 181, https://doi.org/10.1186/s12964-022-00999-w.
- Li B., Zhang J., Su Y., Hou Y., Wang Z., Zhao L., Sun S., Fu H. Overexpression of PTEN may increase the effect of pemetrexed on A549 cells via inhibition of the PI3K/AKT/mTOR pathway and carbohydrate metabolism. Mol Med Rep 2019; 20(4): 3793–3801, https://doi.org/10.3892/mmr.2019.10617.
- Romagosa C., Simonetti S., López-Vicente L., Mazo A., Lleonart M.E., Castellvi J., Ramon y Cajal S. p16(Ink4a) overexpression in cancer: a tumor suppressor gene associated with senescence and high-grade tumors. Oncogene 2011; 30(18): 2087–2097, https://doi.org/10.1038/onc.2010.614.
- Yehia L., Keel E., Eng C. The clinical spectrum of PTEN mutations. Annu Rev Med 2020; 71: 103–116, https://doi.org/10.1146/annurev-med-052218-125823.
- Cabrita R., Mitra S., Sanna A., Ekedahl H., Lövgren K., Olsson H., Ingvar C., Isaksson K., Lauss M., Carneiro A., Jönsson G. The role of PTEN loss in immune escape, melanoma prognosis and therapy response. Cancers (Basel) 2020; 12(3): 742, https://doi.org/10.3390/cancers12030742.
- Pentheroudakis G., Mavroeidis L., Papadopoulou K., Koliou G.A., Bamia C., Chatzopoulos K., Samantas E., Mauri D., Efstratiou I., Pectasides D., Makatsoris T., Bafaloukos D., Papakostas P., Papatsibas G., Bombolaki I., Chrisafi S., Kourea H.P., Petraki K., Kafiri G., Fountzilas G., Kotoula V. Angiogenic and antiangiogenic VEGFA splice variants in colorectal cancer: prospective retrospective cohort study in patients treated with irinotecan-based chemotherapy and bevacizumab. Clin Colorectal Cancer 2019; 18(4): e370–e384, https://doi.org/10.1016/j.clcc.2019.07.007.
- 86GDNF glial cell derived neurotrophic factor. URL: https://www.ncbi.nlm.nih.gov/gene/2668.
- Vora P., Venugopal C., Salim S.K., Tatari N., Bakhshinyan D., Singh M., Seyfrid M., Upreti D., Rentas S., Wong N., Williams R., Qazi M.A., Chokshi C., Ding A., Subapanditha M., Savage N., Mahendram S., Ford E., Adile A.A., McKenna D., McFarlane N., Huynh V., Wylie R.G., Pan J., Bramson J., Hope K., Moffat J., Singh S. The rational development of CD133-targeting immunotherapies for glioblastoma. Cell Stem Cell 2020; 26(6): 832–844.e6, https://doi.org/10.1016/j.stem.2020.04.008.
- Irollo E., Pirozzi G. CD133: to be or not to be, is this the real question? Am J Transl Res 2013; 5(6): 563–581.
- Razmara M., Heldin C.H., Lennartsson J. Platelet-derived growth factor-induced Akt phosphorylation requires mTOR/Rictor and phospholipase C-γ1, whereas S6 phosphorylation depends on mTOR/Raptor and phospholipase D. Cell Commun Signal 2013; 11(1): 3, https://doi.org/10.1186/1478-811X-11-3.
- Ostendorp T., Diez J., Heizmann C.W., Fritz G. The crystal structures of human S100B in the zinc- and calcium-loaded state at three pH values reveal zinc ligand swapping. Biochim Biophys Acta 2011; 1813(5): 1083–1091, https://doi.org/10.1016/j.bbamcr.2010.10.006.
- Wang H., Mao X., Ye L., Cheng H., Dai X. The role of the S100 protein family in glioma. J Cancer 2022; 13(10): 3022–3030, https://doi.org/10.7150/jca.73365.
- Yin Y., Stephen C.W., Luciani M.G., Fåhraeus R. p53 Stability and activity is regulated by Mdm2-mediated induction of alternative p53 translation products. Nat Cell Biol 2002; 4(6): 462–467, https://doi.org/10.1038/ncb801.
- Marcel V., Perrier S., Aoubala M., Ageorges S., Groves M.J., Diot A., Fernandes K., Tauro S., Bourdon J.C. Δ160p53 is a novel N-terminal p53 isoform encoded by Δ133p53 transcript. FEBS Lett 2010; 584(21): 4463–4468, https://doi.org/10.1016/j.febslet.2010.10.005.
- Pienkowski T., Kowalczyk T., Cysewski D., Kretowski A., Ciborowski M. Glioma and post-translational modifications: a complex relationship. Biochim Biophys Acta Rev Cancer 2023; 1878(6): 189009, https://doi.org/10.1016/j.bbcan.2023.189009.
- Perl K., Ushakov K., Pozniak Y., Yizhar-Barnea O., Bhonker Y., Shivatzki S., Geiger T., Avraham K.B., Shamir R. Reduced changes in protein compared to mRNA levels across non-proliferating tissues. BMC Genomics 2017; 18(1): 305, https://doi.org/10.1186/s12864-017-3683-9.
- Plante I. Dimethylbenz(a)anthracene-induced mammary tumorigenesis in mice. Methods Cell Biol 2021; 163: 21–44, https://doi.org/10.1016/bs.mcb.2020.09.003.
- Avtsyn A.P. Old and new concepts in the teaching on preglioma. Arkh Patol 1972, 34(11): 3–11.
- Kucheryavenko A.S., Chernomyrdin N.V., Gavdush A.A., Alekseeva A.I., Nikitin P.V., Dolganova I.N., Karalkin P.A., Khalansky A.S., Spektor I.E., Skorobogatiy M., Tuchin V.V., Zaytsev K.I. Terahertz dielectric spectroscopy and solid immersion microscopy of ex vivo glioma model 101.8: brain tissue heterogeneity. Biomed Opt Express 2021; 12(8): 5272–5289, https://doi.org/10.1364/BOE.432758.
- Dolganova I.N., Aleksandrova P.V., Nikitin P.V., Alekseeva A.I., Chernomyrdin N.V., Musina G.R., Beshplav S.T., Reshetov I.V., Potapov A.A., Kurlov V.N., Tuchin V.V., Zaytsev K.I. Capability of physically reasonable OCT-based differentiation between intact brain tissues, human brain gliomas of different WHO grades, and glioma model 101.8 from rats. Biomed Opt Express 2020; 11(11): 6780–6798, https://doi.org/10.1364/BOE.409692.
- Kiseleva E.B., Yashin K.S., Moiseev A.A., Timofeeva L.B., Kudelkina V.V., Alekseeva A.I., Meshkova S.V., Polozova A.V., Gelikonov G.V., Zagaynova E.V., Gladkova N.D. Optical coefficients as tools for increasing the optical coherence tomography contrast for normal brain visualization and glioblastoma detection. Neurophotonics 2019; 6(3): 035003, https://doi.org/10.1117/1.NPh.6.3.035003.
- Maksimenko O., Malinovskaya J., Shipulo E., Osipova N., Razzhivina V., Arantseva D., Yarovaya O., Mostovaya U., Khalansky A., Fedoseeva V., Alekseeva A., Vanchugova L., Gorshkova M., Kovalenko E., Balabanyan V., Melnikov P., Baklaushev V., Chekhonin V., Kreuter J., Gelperina S. Doxorubicin-loaded PLGA nanoparticles for the chemotherapy of glioblastoma: towards the pharmaceutical development. Int J Pharm 2019; 572: 118733, https://doi.org/10.1016/j.ijpharm.2019.118733.
- Dzhalilova D.S., Zolotova N.A., Mkhitarov V.A., Kosyreva A.M., Tsvetkov I.S., Khalansky A.S., Alekseeva A.I., Fatkhudinov T.H., Makarova O.V. Morphological and molecular-biological features of glioblastoma progression in tolerant and susceptible to hypoxia Wistar rats. Sci Rep 2023; 13(1): 12694, https://doi.org/10.1038/s41598-023-39914-9.
- Alekseeva A.I., Sentyabreva A.V., Kudelkina V.V., Miroshnichenko E.A., Ikonnikov A.V., Kopantseva E.E., Kosyreva A.M., Fatkhudinov T.K. Rat glioma 101.8 tissue strain: molecular and morphological features. Int J Mol Sci 2025; 26(18): 8992, https://doi.org/10.3390/ijms26188992.